一氧化氮诱导星形胶质细胞HIF-1α活化的实验研究
2020-11-17王朝驹王德伟伏建峰史清海
董 越,王朝驹,王德伟,王 黎,李 凯,伏建峰,史清海
大脑缺氧失代偿将造成神经功能紊乱及损伤。缺氧代偿是动态平衡的,其中低氧诱导因子(hypoxia-inducible factor, HIF)是细胞感知缺氧的分子感受器,而HIF-1α活化是细胞缺氧代偿与适应性的关键分子,参与多种缺氧代偿相关基因的转录调控[1-5]。一氧化氮(nitric oxide, NO)被认为是一种细胞间的信使分子,经典模式是具有舒张血管的作用[6-8]。另有研究表明,NO可诱导HIF-1α活化表达,发生类似缺氧感知反应的作用[2,9-11]。本研究将大鼠原代脑星形胶质细胞(astrocytes, ASTs)分别给予外源性NO供体药物预处理和内皮源性脑微血管内皮细胞(microvascular endothelial cell, MECs)共培养的方式,观测ASTs细胞HIF-1α活化表达的变化,从而探索缺氧脑损伤与缺氧代偿之间的动态平衡,借此发现缺氧脑损伤药物防护新靶点与新策略。
1 材料与方法
1.1细胞与试剂
1.1.1原代ASTs:取1日龄新生Wistar大鼠5只,窒息死亡后断头,手术取出大脑,眼科剪处理成1~3 mm3团块,0.25%胰酶、37℃消化15 min,70 μm孔径滤网过滤收集单个混合胶质细胞,接种于细胞培养瓶中贴壁生长,随后37℃、150 r/min、18 h振荡纯化,获得第1代细胞。继续传代培养至第4代后开展实验。
1.1.2原代MECs:取3周龄Wistar大鼠10只,3%戊巴比妥麻醉后断头,取大脑并小心剥离脑膜和血管,眼科剪处理至1~3 mm3的糜状组织团块,Ⅱ型胶原蛋白酶+DNA酶Ⅰ、37℃、200 r/min振荡消化1 h,20% BSA重悬细胞,离心后吸取贴近管底沉淀层。重悬后,胶原蛋白酶/分解酶+DNA酶Ⅰ、37℃、200 r/min振荡消化1 h,70 μm孔径滤网过滤收集未过筛混合物,33% Percoll梯度密度离心,使用长针管吸取管底白色层,加入含嘌呤霉素(4 μg/ml)ECM完全培养基重悬细胞,接种于预先包被纤连蛋白(2 μg/cm2)细胞培养瓶中贴壁生长,获得第1代细胞。继续传代培养至第4代后开展实验。
1.1.3主要试剂和设备:DMEM/F12培养基、0.25%胰蛋白酶购自美国Gibico;ECM培养基购自美国ScienCell;胎牛血清购自杭州四季青;2,2′-(Hydroxynitrosohydrazino)bis-ethanamine(DETA NONOate)、NG-Nitro-L-arginine Methyl Ester(L-NAME)、Ⅱ型胶原蛋白酶、DNA酶Ⅰ、纤连蛋白购自美国Sigma公司;胶原蛋白酶/分解酶购自德国Roche公司;牛血清白蛋白购自美国Genview公司;嘌呤霉素二盐酸购自比利时ACROS公司;L-精氨酸购自美国Amresco公司;Percoll分离液购自北京鼎国。HIF-1α兔多抗(ab2185)、β-actin小鼠单抗(ab3280)、HRP-羊抗兔二抗(ab6721)、HRP-兔抗鼠二抗(ab6728)购自美国Abcam公司。Nitriate/Nitrate荧光检测试剂盒购自美国Biovision公司。70 μm细胞筛网购自美国BD公司;ThinCert共培养细胞培养板购自德国Greiner公司。蛋白电泳仪、转印槽/转膜仪、ChemiDoc凝胶成像系统购自美国Bio-Rad公司;Varioskan Flash荧光酶标仪购自美国Thermo Scientic公司。
1.2给药和细胞培养
1.2.1药物处理:6孔板实验组每孔加DETA NONOATE 150 μl至终浓度分别为0.4、0.6、0.8、1.0 mmol/L,对照组给予150 μl PBS。DMEM/F12完全培养基、ECM完全培养基需添加L-精氨酸至终浓度500 μmol/L;内皮型一氧化氮合酶(eNOS)抑制剂(L-NAME)给药终浓度至100 μmol/L。
1.2.2细胞培养条件:常氧组为21% O2、5% CO2、74% N2;低氧组为1% O2、5% CO2、94% N2。
1.2.3细胞共培养:将ASTs接种在6孔细胞共培养板上层孔内(0.4 μm孔径),MECs接种在已包被纤连蛋白的共培养板下层孔内,使用ECM完全培养液,常氧37℃、5% CO2培养。抑制剂组预先给药L-NAME终浓度至100 μmol/L。培养12 h后,收集上层ASTs。
1.3检测指标和方法
1.3.1细胞增殖活性:将细胞接种于96孔板,实验组每孔加DETA NONOATE 10 μl至终浓度分别为0.4、0.6、0.8、1.0、1.2和1.4 mmol/L,对照组给予10 μl PBS。常氧37℃、5% CO2培养箱中培养24 h后,每孔加MTT溶液(5 mg/ml)20 μl,孵育4 h后弃除上清,加150 μl DMSO振荡呈色。在490 nm波长下检测各孔吸光度值(OD值),计算细胞相对增殖活性百分率。
1.3.2检测NO释放水平:ASTs经药物处理和常氧、低氧培养12 h后,弃培养液上清,检测NO水平。96孔板每孔加入75 μl待测样品、5 μl Enzyme Cofactors、5 μl Nitrate reductase,室温孵育2 h;每孔加入5 μl Enhancer,避光室温孵育30 min;每孔加入5 μl DAN试剂,避光室温孵育10 min;每孔加入5 μl NAOH试剂,避光室温孵育10 min。在Ex360 nm、Em450 nm波长下读取各孔荧光值,通过标准曲线计算样品Nitrite/Nitrate浓度反映NO释放水平。
1.3.3检测HIF-1α蛋白水平:采用上样缓冲液裂解细胞直接获得上样蛋白样品,8% SDS-PAGE凝胶电泳,恒流湿法转印至PVDF膜,封闭,孵育一抗:HIF-1α一抗(1∶1000),β-actin一抗(1∶2000),孵育二抗:HRP-羊抗兔和兔抗鼠IgG二抗(1∶5000),超敏ECL化学发光显影。
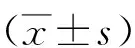
2 结果
2.1低氧和低氧培养时间对ASTs细胞HIF-1α蛋白水平的影响 大鼠原代脑ASTs在常氧和低氧条件下培养12 h后,低氧组HIF-1α蛋白水平较常氧组增高(P<0.01);低氧条件下培养12、24、48 h后,HIF-1α蛋白表达水平均较常氧组增高,其中培养12 h蛋白表达水平最高(P<0.05,P<0.01)。见图1。
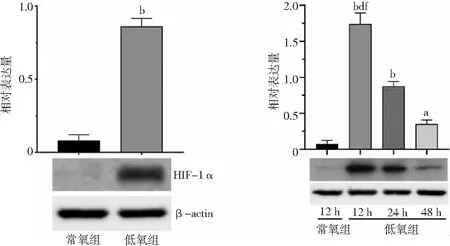
图1 低氧及低氧培养时间对ASTs细胞HIF-1α蛋白表达相对强度的影响ASTs为星形胶质细胞,HIF-1α为低氧诱导因子-1α;常氧组氧气浓度为21%,低氧组为1%;与常氧组比较,aP<0.05,bP<0.01;与低氧组24 h比较,dP<0.01;与低氧组48 h比较,fP<0.01
2.2DETA NONOATE对ASTs细胞增殖活性的影响 DETA NONOATE在0.4~1.2 mmol/L浓度时,大鼠原代脑ASTs的增殖活性比较差异无统计学意义(P>0.05);DETA NONOATE在1.4 mmol/L浓度时大鼠原代脑ASTs增殖活性较未给药组显著降低(P<0.05)。见图2。
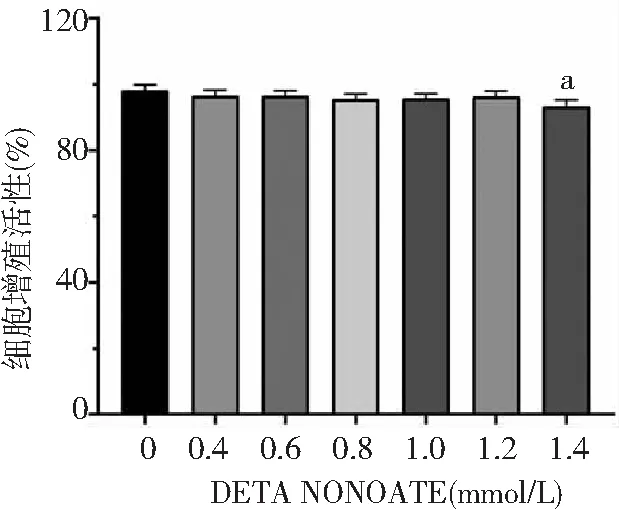
图2 不同浓度DETA NONOATE组大鼠原代脑ASTs增殖活性比较ASTs为星形胶质细胞;与未给药组比较,aP<0.05
2.3DETA NONOATE对HIF-1α蛋白表达的影响 常氧条件下,大鼠原代脑ASTs给予0.8、1.0 mmol DETA NONOATE预处理12 h后及低氧组HIF-1α蛋白水平高于未给药组(P<0.01)。1.0 mmol DETA NONOATE给药预处理12、24 h后及低氧组HIF-1α蛋白水平高于未给药组(P<0.01)。见图3。
图3 DETA NONOATE对ASTs细胞HIF-1α蛋白表达的影响ASTs为星形胶质细胞,HIF-1α为低氧诱导因子-1α;常氧组氧气浓度为21%,低氧组为1%;与未给药组比较,bP<0.01
2.4不同氧气条件下MECs和ASTs细胞NO释放水平 常氧组和低氧组大鼠原代MECs总NO释放水平均高于大鼠原代脑ASTs,低氧组MECs总NO释放水平高于常氧组(P<0.01)。常氧条件下,MECs在给予eNOS抑制剂L-NAME(100 μmol/L)预处理后总NO释放水平降低(P<0.01)。见图4。
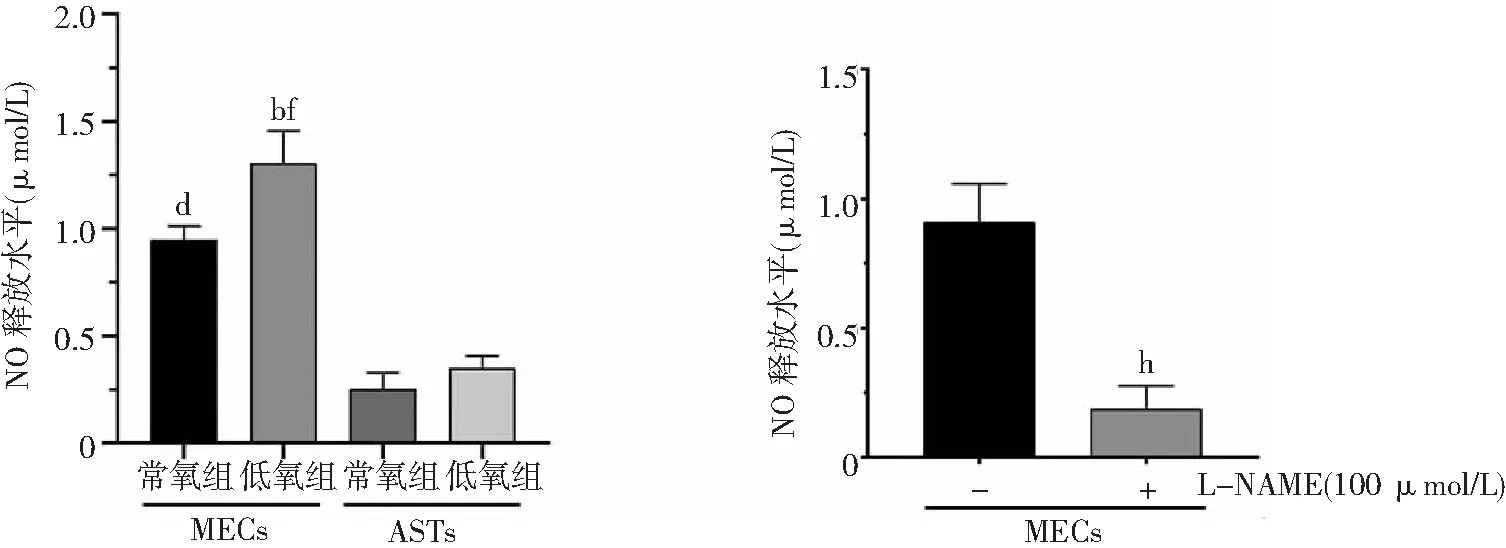
图4 常氧组和低氧组MECs和ASTs细胞NO释放水平比较MECs为微血管内皮细胞,ASTs为星形胶质细胞,NO为一氧化氮;常氧组氧气浓度为21%,低氧组为1%;与常氧组MECs比较,bP<0.01;与常氧组ASTs比较,dP<0.01;与低氧组ASTs比较,fP<0.01;与未加L-NAME组比较,hP<0.01
2.5MECs对ASTs细胞HIF-1α蛋白水平的影响 常氧条件下,将大鼠原代MECs和大鼠原代脑ASTs共培养,共培养组ASTs中HIF-1α蛋白水平较单独ASTs培养组增高(P<0.01);共培养组给予L-NAME(100 μmol/L)预处理后,ASTs中HIF-1α蛋白水平与ASTs单独培养比较差异无统计学意义(P>0.05)。见图5。
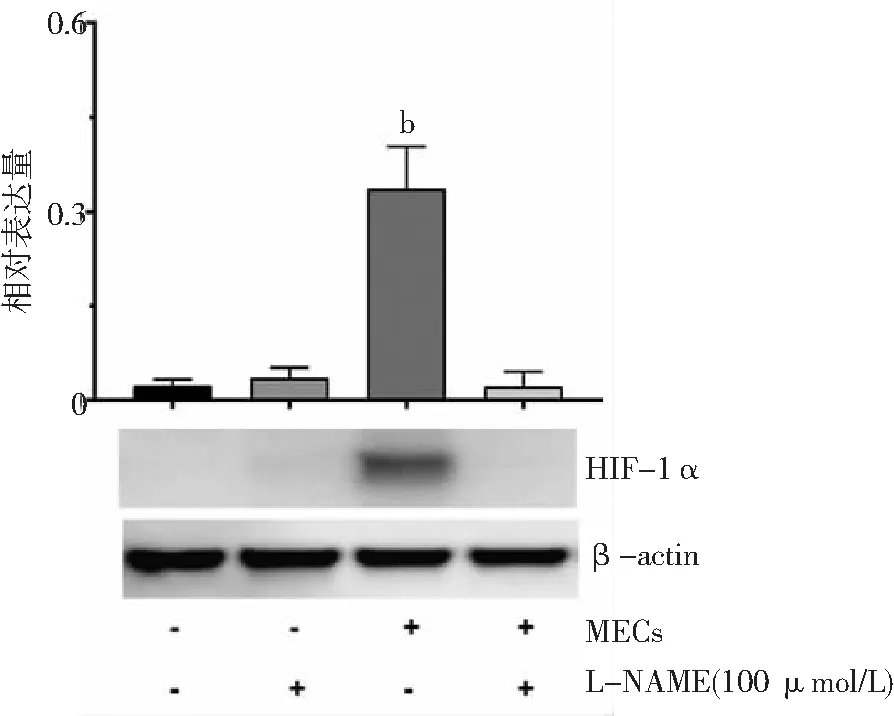
图5 常氧条件下MECs对ASTs细胞HIF-1α蛋白表达水平的影响MECs为微血管内皮细胞,ASTs为星形胶质细胞,HIF-1α为低氧诱导因子-1α;与ASTs细胞单独培养组比较,bP<0.01
3 讨论
细胞感知缺氧的感受器称之为HIF,包括HIF-1、HIF-2和HIF-3,其中研究较多的是HIF-1。HIF-1是由α、β亚基构成的异源二聚体,其中α亚基受氧气浓度调控,核心机制是氧气作为脯氨酰羟化酶(PHD)的辅助分子参与羟化α亚基的脯氨酸残基,羟化后的α亚基经过泛素化途径降解[3,12];缺氧将阻断α亚基的降解,活化的α亚基具有转位胞核、与β亚基结合、调控靶基因转录表达等作用[4-5,13]。本研究针对大鼠原代分离的脑ASTs,在体外1%氧气条件下培养可出现典型的缺氧感知即HIF-1α活化反应;尤其是缺氧12 h后,HIF-1α活化表达水平最高。但是,缺氧24、48 h后HIF-1α活化表达水平下降,出现HIF-1α活化的单个脉冲模式。根据以往的文献,我们推测HIF-1α介导细胞急性期缺氧反应,适应缺氧的持续性反应是由HIF-2α介导的细胞慢性期缺氧反应[14],而HIF-2α同样是氧依赖性核转录因子,参与多种缺氧相关靶基因的转录调控,但相关机制仍需深入研究。
NO是一种细胞信使分子,在体内的生成是由一氧化氮合酶(NOS)催化L-精氨酸产生。根据组织来源差异,NOS通常包括神经元型NOS(nNOS)、诱导型NOS(iNOS)和eNOS[6]。经典的NO分子作用机制是:血管内皮细胞产生的NO活化血管平滑肌细胞内的可溶性鸟苷酸环化酶(sGC),激活蛋白激酶G(PKG)途径,调控钙离子稳态,抑制肌球蛋白与肌动蛋白的结合,舒张血管平滑肌[7-8]。此外,另有研究证实NO参与调控HIF-1α的活化表达,机制可能是阻断Fe2+绑定PHD,从而阻断α亚基的降解[2,9-11]。本研究针对大鼠原代分离的脑ASTs,在体外常氧条件下,给予NO供体药物DETA NONOATE预处理,我们观测到了典型的HIF-1α活化反应,尤其是1.0 mmol/L DETA NONOATE预处理12 h,HIF-1α活化表达水平最高,与低氧条件下观测到的缺氧感知即HIF-1α活化反应现象一致,表明体外培养的ASTs在外源性给予NO能够诱导发生类似缺氧反应的HIF-1α活化现象。
为了进一步研究NO调控HIF-1α活化表达的生理现象,我们采用细胞共培养模式模拟脑组织中血管内皮细胞来源的NO诱导ASTs细胞HIF-1α活化的实验研究。在中枢神经系统中,ASTs是构成脑组织的主要支撑结构,血管、神经元以及其他细胞有序分布其中,ASTs包裹脑血管,直接与MECs接触并可发生物质转运[15-16]。细胞共培养实验是研究相邻不同细胞间物质与信息传递的有效实验方法[17]。本研究将大鼠原代脑MECs和原代脑ASTs通过Transwell技术进行共培养,体外培养的MECs在给予内皮细胞生长添加物(ECGs)和500 μmol/L L-精氨酸条件下,可以生成一定量生理水平的NO。共培养12 h后的ASTs观测到了典型的HIF-1α活化反应,与低氧条件下观测到的缺氧感知即HIF-1α活化反应现象一致;与此同时,抑制内皮细胞eNOS的活性后,HIF-1α活化反应被抑制,表明体外培养的ASTs在给予内皮源性NO后能够诱导发生类似缺氧反应的HIF-1α活化现象,与文献报道一致[9]。
本研究初步观测到体外培养的ASTs在给予2种来源NO后均可诱导HIF-1α活化。但NO调控HIF-1α活化的机制,以及与低氧适应性HIF-1α活化的过程有无差别,HIF-1α活化的持续时间、活化表达强度等具体问题仍需要我们深入研究。此外,体外培养MECs生成NO,释放扩散并在ASTs内发挥作用与在生理条件下NO的作用有何异同,NO的生成水平、作用持续时间等也是需要解决的科学问题。上述问题的充分阐释,将使我们深入认识缺氧感知与HIF-1α活化机制,了解缺氧脑损伤与缺氧代偿之间的动态平衡,发现缺氧脑损伤药物干预的防护新靶点与新策略。
