家蚕丝腺中FMBP-1基因的转录水平及RNAi分析
2020-11-17赵国栋成嘉璐钱荷英徐安英
赵国栋,张 潇,黄 鑫,成嘉璐,钱荷英,李 刚,徐安英
(1.江苏科技大学 蚕业研究所/生物技术学院,镇江 212100)(2.中国农业科学院 蚕业研究所,镇江 212100)
鳞翅目昆虫家蚕(Bombyxmori)具有强大的吐丝结茧能力,一直以来被人类驯养从而发挥出巨大的经济价值和社会价值,目前也是生物研究中一种极为热门的模式动物,是进行生理生化、分子遗传研究的重要模型[1-2].
家蚕丝腺是天然的蛋白质资源库,能够为蚕丝蛋白的合成提供场所和物质材料.根据其结构和功能的不同,可以将家蚕丝腺分为吐丝管,前部丝腺(ASG)、中部丝腺(MSG)和后部丝腺(PSG)等[3].家蚕丝蛋白主要由丝胶蛋白(主要在中部丝腺合成)和丝素蛋白(主要在后部丝腺合成)组成.在幼虫各龄的眠期和蜕皮期,家蚕合成少量的丝蛋白,当进入五龄盛食期时,丝素蛋白,丝胶蛋白在家蚕体内大量合成[4-6].研究表明丝蛋白基因的表达涉及复杂的调控机制,受到多个特异因子的调控,主要体现在转录水平,目前已发现至少有6种转录因子参与到丝蛋白基因的表达调控中,分别是SGF-1、SGF-2、SGF-4、FMBP-1和FBF-A1[7-8].一般认为这些不同的蛋白结合因子通过结合丝蛋白基因上游相应位点,实现对丝蛋白基因表达的调控.
最初丝腺蛋白特异性转录因子FMBP-1(Fibroin-modulator-binding protein-1)、FMBP-2、FMBP-3被检测到与丝蛋白基因内含子元件结合,后来发现这些FMBP均与上游元件结合[9].从FMBP-2、FMBP-3结合的蛋白中鉴定为BmFkh和POU-M1.BmFkh在中部丝腺和后部丝腺中均有表达,是丝素蛋白和ser-1基因共同的调控元件[10-11].POU-M1基因在包括丝腺在内的许多组织中均有表达,该基因可能是一种抑制子或者与其他因子协同发挥作用[12-13].而FMBP-1被发现在四龄和五龄幼虫摄食期的后部丝腺中含量较高,但在四龄蜕皮期的中部和后部丝腺中含量较低,推测其与丝蛋白基因的特异性表达密切相关[9].
本研究以家蚕和野桑蚕以及不同丝量品种的家蚕为供试材料,利用实时荧光定量PCR技术检测丝腺组织中FMBP-1基因的转录水平,比较其在不同品种中的转录水平差异,同时采用RNAi技术探究该基因在丝蛋白基因表达中发挥的作用,为进一步研究丝蛋白基因的表达调控提供相关的理论基础和数据支持.
1 实验
1.1 材料与主要试剂
1.1.1 材料供试家蚕品种菁松、皓月和大造,均由江苏科技大学蚕业研究所品种资源组保存并提供,野桑蚕来源于江苏科技大学蚕业研究所桑园.在标准条件下用新鲜的桑叶饲养,饲育温度25℃±1℃,相对湿度 60%~75%,光照昼夜12 h交替.
1.1.2 主要试剂保幼激素(JHⅢ)购自美国Sigma-aldrich公司,总RNA抽提试剂盒TRIzol、反转录试剂盒SuperScriptTMFirst-strand synthesis System for RT-PCR以及SYBR Premix Ex Taq试剂盒均购自宝生物工程(大连)有限公司.siRNA由上海吉玛制药技术有限公司设计并合成,序列为F:GCC GGU CGA UAU GAU ACA ATT;R:UUG UAU CAU AUC GAC CGG CTT.
1.2 方法
1.2.1 保幼激素溶液的配制及添食
先将保幼激素(JHⅢ)用95%乙醇溶解至50 μg/mL,使用时再用双蒸水将其稀释至10 ng/mL.将新鲜桑叶浸入保幼激素溶液5 s,自然晾干后添食家蚕5龄4 d幼虫,以清水浸叶并晾干为对照处理.
1.2.2 家蚕丝腺总RNA的提取及cDNA第1链合成
将收集的各品种家蚕和野桑蚕五龄中期幼虫丝腺置于预冷的研钵中,添加液氮研磨至粉末,加入Trizol提取组织的总RNA,-70℃保存备用.提取的总RNA经1%琼脂糖凝胶快速电泳检测其完整性,并用酶标仪测定其浓度.cDNA第1链用SuperScriptTMFirst-strand synthesis System for RT-PCR试剂盒合成,合成反应50 μL体系包括:总RNA 1 μg,50 μmol/L Oligo(dT)16引物1 μL,5×M-MLV buffer 10 μL,10 mmol/L dNTP 2.5 μL,40 U/μL RNase Inhibitor 0.5 μL,200 U/μL M-MLV 1 μL;于42℃反应1 h合成cDNA,70℃ 15 min灭活反转录酶,加RNAse H 后37℃ 20 min消化剩余的RNA,-20℃保存备用.
1.2.3 引物设计
根据GenBank数据库中获得的家蚕丝腺转录因子FMBP-1的编码序列(登录号:NM-001043504.1),采用Primer5.0软件,按照荧光定量PCR引物的设计原则设计所需的引物,设计的引物序列如表1.引物由上海生工生物工程股份有限公司合成.

表1 Real-time PCR引物对Table 1 Primer pairs for Real-time PCR
1.2.4 实时荧光定量PCR
采用SYBR PrimeScriptTMRT-PCR试剂盒,在ABI Prism 7300型荧光定量PCR仪(美国,Applied Biosystems)上进行测定,具体实验步骤按照说明书进行,反应体系为20 μL.反应程序为:95 ℃变性1 min;随后40个循环:95 ℃ 15 s, 60 ℃ 31 s.反应过程由测定仪软件自动设定,每个样品重复测定3次.
1.2.5 RNAi分析
根据GenBank数据库中获得的家蚕丝腺转录因子FMBP-1的编码序列,按照siRNA设计原则委托上海吉玛制药技术有限公司生产.
选取生长一致的家蚕皓月幼虫,在5龄第2 d开始分成实验组和对照组分别饲养.注射前饥饿1 h,放置冰上1 min,用50 μL微量注射器从幼虫背面注射FMBP-1 siRNA,每头注射5 μg,对照组注射同体积PBS,48 h后解剖收集实验组和对照组的中部丝腺和后部丝腺,并提取总RNA,反转录成cDNA,利用qRT-PCR检测RNAi后FMBP-1基因和丝蛋白基因的表达情况.
分别观察并记录对照组和实验处理组家蚕化蛹、结茧、化蛾阶段的变化差异,并调查两组家蚕茧层率.
1.3 数据处理
荧光定量RT-PCR的结果数据用实验仪器自带的Sequence detection software version 1.3.1软件处理,并参照Jan H Schefe的方法进行效率校正[14].图表采用Microsoft Office Excel软件制作,并分析差异显著性.
2 结果与分析
2.1 FMBP-1基因在不同品种家蚕和野蚕丝腺中的转录水平差异
首先采用实时荧光定量PCR的方法,分别测定了家蚕(菁松)和野蚕五龄幼虫不同发育时间中部丝腺和后部丝腺FMBP-1基因的转录水平.结果如图1:家蚕菁松5龄1 d和5龄4 d中部丝腺中FMBP-1基因的mRNA转录水平明显高于野蚕(图1(a)),在后部丝腺中,5龄4 d和5龄7 dFMBP-1基因的mRNA转录水平同样高于野蚕(图1(b)).这与家蚕和野蚕蚕茧的大小是一致的,说明该基因与丝蛋白的表达调控有一定的相关性.
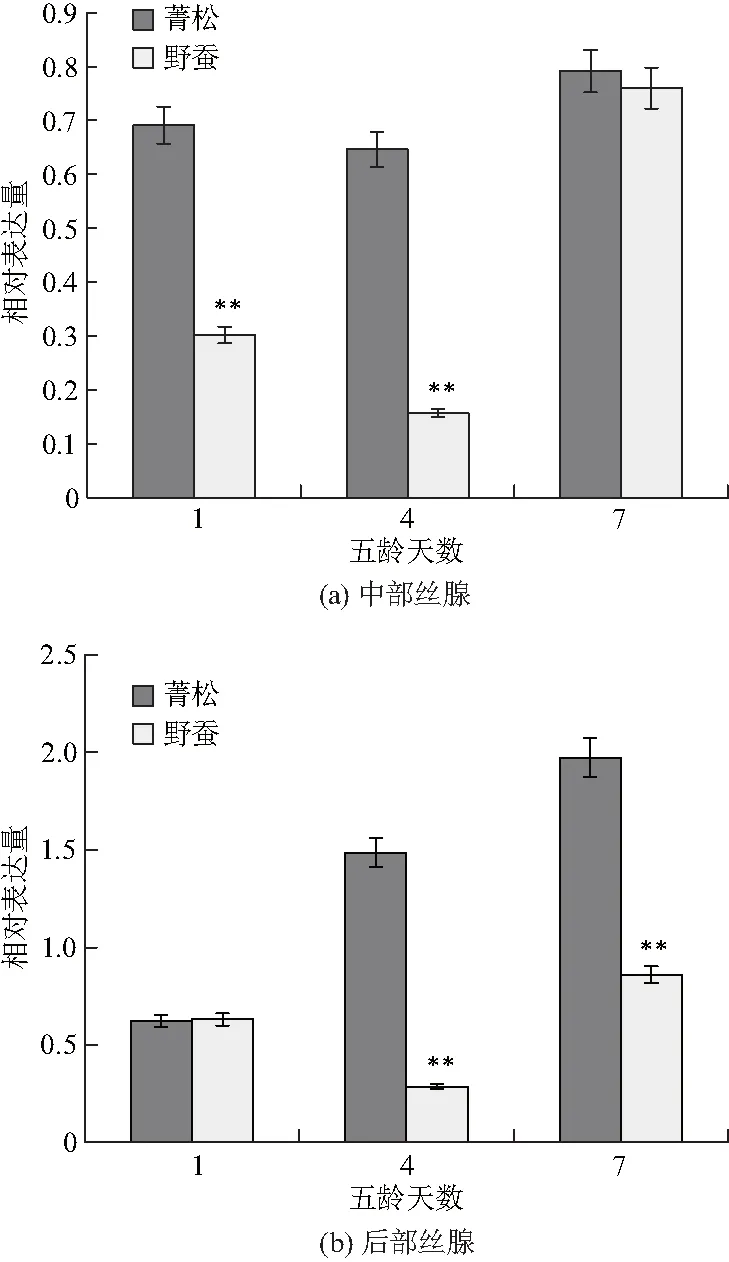
“*”表示差异显著(P<0.05),**表示差异极显著(P<0.01),图2~7同.
图1FMBP-1基因在家蚕(菁松)和野蚕丝腺中的转录水平
Fig.1Transcriptional level ofFMBP-1 gene in the silk
glands ofBombyxmori(Jingsong)andBombyxmandarina
采用同样的方法,分别检测多丝量品种皓月和少丝量品种大造五龄幼虫不同时间中部丝腺和后部丝腺中FMBP-1基因的转录水平,结果如图2,该基因在皓月品种中部丝腺和后部丝腺的五龄3个测定时间,其mRNA转录水平均高于大造品种(图2),表明该基因与家蚕茧丝量存在一定的相关性.
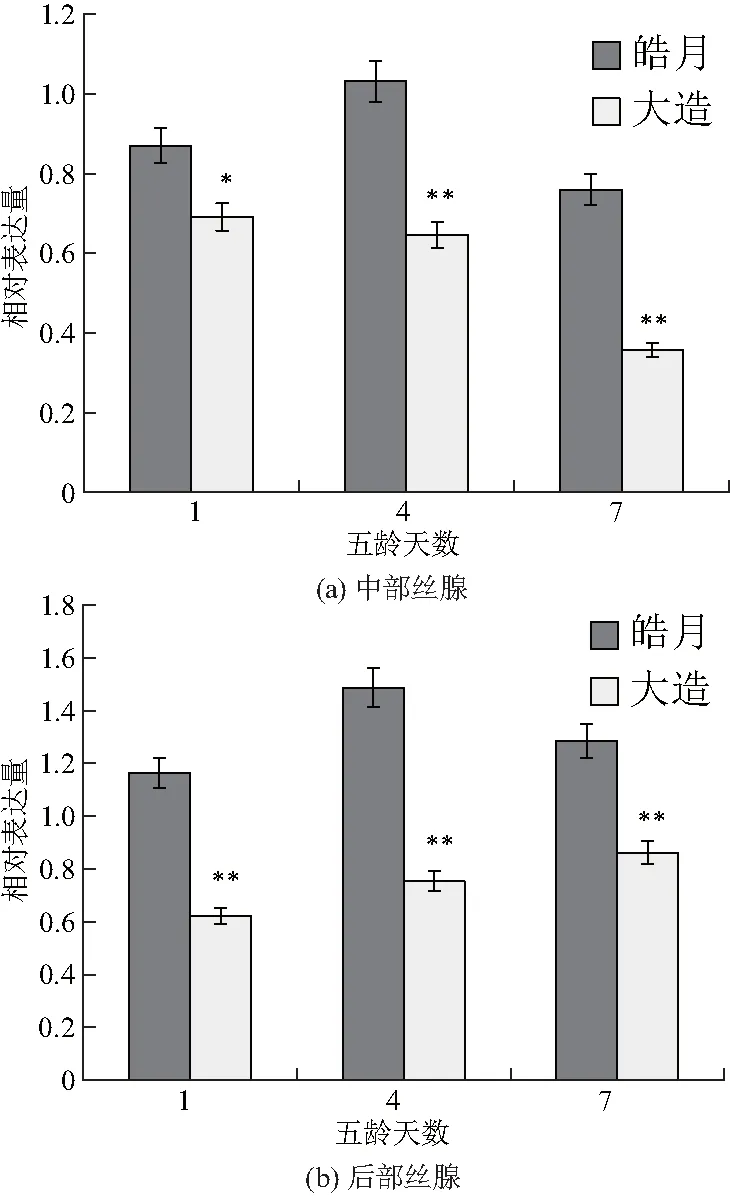
图2 FMBP-1基因在皓月和大造丝腺中的转录水平Fig.2 Transcriptional level of FMBP-1 genein the silk glands of Haoyue and Dazao
2.2 添食保幼激素对五龄幼虫丝腺中FMBP-1基因转录水平的影响
与对照组相比,添食保幼激素(JH)后,中部丝腺中FMBP-1基因的mRNA转录水平先呈现下降趋势然后上升,后部丝腺中,添食保幼激素后,实验组FMBP-1基因的mRNA转录水平同样先下降后上升,而且相对表达量的峰值延迟1 d(图3),由此推断FMBP-1基因参与蚕丝蛋白的合成,或对丝蛋白的合成起到一定的调控作用.

图3 添食保幼激素后家蚕丝腺组织FMBP-1基因转录水平Fig.3 Transcriptional level of FMBP-1 gene inthe silk glands of silkworm after feeding JH
2.3 RNAi对家蚕幼虫FMBP-1基因干扰效果及影响分析
2.3.1 RNAi对家蚕丝腺FMBP-1基因转录水平的影响
通过RNAi技术对家蚕皓月丝腺组织FMBP-1基因的转录进行干扰,并采用实时荧光定量PCR检测干扰后家蚕丝腺该基因的转录水平变化,结果如图4,在家蚕中部丝腺和后部丝腺中,FMBP-1基因的转录水平与对照组相比分别下降了38.9%和25.4%,说明对FMBP-1基因的干扰效果较为显著.

图4 RNAi干扰后家蚕丝腺FMBP-1基因的转录水平Fig.4 Transcriptional level of FMBP-1 genein the silk glands of silkworm after RNAi
2.3.2 干扰FMBP-1基因表达对家蚕表型性状的影响
RNAi处理后家蚕表型性状的变化,如图5,与对照组相比,RNAi处理后的家蚕蛹体积变小,茧壳皱缩,茧层明显变薄,化蛾后,蚕蛾腹部存在一定程度的皱缩.此外,通过RNAi干扰FMBP-1基因表达后对家蚕的茧层率也有影响,与对照组相比,RNAi实验组的茧层率显著下降(图6).根据RNAi后家蚕表型性状的变化,推测FMBP-1基因在丝蛋白的合成过程中发挥着重要的作用.
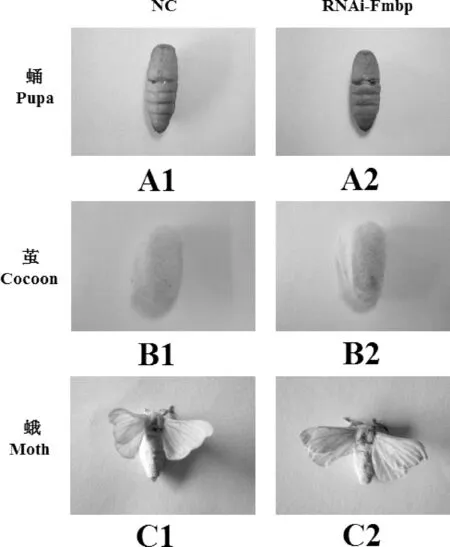
图5 通过RNAi干扰FMBP-1基因表达的家蚕表型性状Fig.5 Phenotype of Bombyx mori after FMBP-1gene were disturbed by RNAi
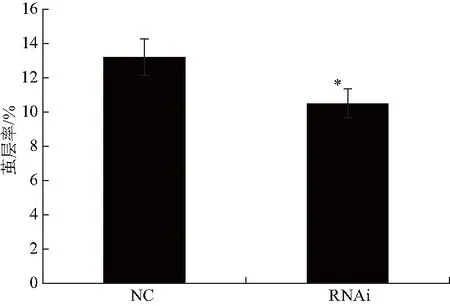
图6 RNAi干扰FMBP-1基因表达对家蚕茧层率的影响Fig.6 Effects of silencing the expression ofFMBP-1 gene on cocoon layer rate
2.3.3 干扰FMBP-1基因表达对丝蛋白基因转录水平的影响
为进一步检测FMBP-1基因对丝蛋白合成的作用,我们采用实时荧光定量PCR进一步从分子水平检测了丝素重链Fib-H、丝素轻链Fib-L和P25基因的转录水平,结果如图7,FMBP-1基因经RNAi干扰后,实验组中Fib-H、Fib-L和P25基因的转录水平与对照组相比都显著下降,分别下降46%、41%和80%,表明FMBP-1基因对丝蛋白基因的转录有重要的作用.
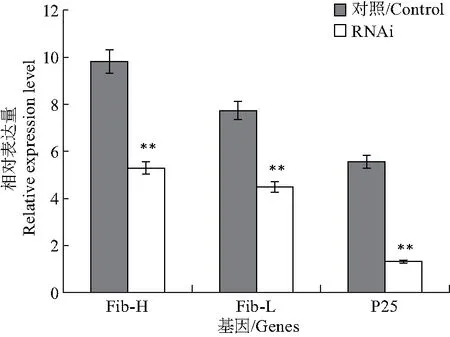
图7 干扰FMBP-1基因表达对丝蛋白基因转录水平的影响Fig.7 Effects of silencing the expression of FMBP-1gene on the transcriptional levels of silk protein genes
3 讨论
家蚕丝腺是高度特异化的器官,具有超强合成丝蛋白的能力,一直是蚕业科学研究的重点[15].丝蛋白基因的表达特异性受到多个特异因子调控,对家蚕丝腺功能基因转录调控的研究以及分析丝腺特异性表达基因的调控机制具有积极的意义.丝蛋白的合成主要在五龄盛食期,而在眠期和蜕皮期基本处于关闭状态.家蚕在五龄中期以前,食下的桑叶蛋白质主要用于蚕体自身的构成,到五龄中后期,蚕体生长基本完成,食入的桑叶蛋白质则主要用于蚕丝蛋白的合成.其中,顺式作用元件和反式作用因子的调控以及二者之间的相互作用对于丝蛋白在家蚕丝腺中的特异性表达常常起到重要的作用[16].
先前的研究表明FMBP基因是一种正调节因子,主要在家蚕五龄丝腺组织表达[17].本实验分析比较了家蚕和野蚕、以及多丝量品种皓月和少丝量品种大造丝腺的FMBP-1基因的转录水平,实验结果表明,FMBP-1基因的转录水平与家蚕丝量多少密切正相关.
家蚕丝腺的生长发育受到蜕皮激素和保幼激素的协同调控[18].保幼激素由昆虫咽侧体分泌,它能够保持幼虫的虫态,调控昆虫发育、变态和生殖等过程[19].文献[20-21]研究发现通过喂食保幼激素类似物可以增加15%的茧丝量,而且能促进后部丝腺细胞RNA的合成.另有研究表明保幼激素类似物可以使家蚕幼虫的龄期延长,并且可以使后部丝腺的RNA合成活性呈现先降后升的趋势,丝蛋白合成活性也呈现出先降后升的趋势.文中通过喂食保幼激素,发现喂食后的家蚕丝腺内FMBP-1基因的含量有显著的变化,推测该基因在保幼激素的调控通路中发挥着重要作用,有待进一步研究,也说明该基因对丝蛋白合成有至关重要的作用.
此外,本实验还利用RNAi技术,对FMBP-1基因在丝腺组织的功能进行了探究分析,结果表明,FMBP-1基因对家蚕蚕茧的茧层率有重要影响,对蚕丝蛋白的表达调控发挥着重要作用,这与之前的研究结果也是一致的[8],当然,调控的机理还待进一步研究,希望本实验的研究结果能为进一步探究丝腺特异性转录因子的深入研究提供线索和参考.
