某院无菌体液念珠菌感染及耐药分析
2020-11-16林滢廖娟方凤
林滢 廖娟 方凤

【摘要】 目的:分析近年来笔者医院无菌体液中念珠菌感染的种类、临床分布及药敏情况,为临床医生抗真菌治疗提供依据。方法:收集福建中医药大学附属人民医院2015年1月-2019年12月自临床患者无菌体液中分离的念珠菌403株,对其菌种分布及药敏情况进行回顾性分析。结果:在分离出的403株念珠菌标本中,分离率前五位的菌种分别为白念珠菌(48.1%)、近平滑念珠菌(15.9%)、热带念珠菌(15.4%)、光滑念珠菌(14.6%)及克柔念珠菌(3.2%)。念珠菌分离率前三位的无菌体液类型为尿液(74.9%)、血液(8.4%)、胸水(5.0%)。念珠菌分离率前三位的科室分别为重症医学科(19.4%)、泌尿外科(12.4%)、肺病科(10.4%)。403株菌对5-氟胞嘧啶、两性霉素B、氟康唑、伏立康唑、伊曲康唑的敏感性分别为98.2%、100%、93.1%、95.3%、92.1%,未发现对两性霉素B耐药的菌株。结论:分离自临床患者无菌体液中的念珠菌以白念珠菌为主,其次为近平滑念珠菌、热带念珠菌,念珠菌抗真菌药物有较高的敏感性,临床应合理选用抗真菌药。
【关键词】 念珠菌 无菌体液 药敏分析
doi:10.14033/j.cnki.cfmr.2020.27.068 文献标识码 B 文章编号 1674-6805(2020)27-0-03
[Abstract] Objective: To analyze the types, clinical distribution and drug sensitivity of candida infection in sterile body fluids in the author's hospital in recent years, to provide the basis for antifungal therapy for clinicians. Method: A total of 403 candida strains isolated from sterile body fluids of clinical patients in the People's Hospital Affiliated to Fujian University of Traditional Chinese Medicine from January 2015 to December 2019 were collected, the strain distribution and drug sensitivity were analyzed retrospectively. Result: Among the 403 strains isolated, the top five strains were Candida albicans (48.1%), Near-smooth Candida (15.9%), Tropical Candida (15.4%), Smooth Candida (14.6%) and Croc Candida (3.2%), respectively. The top three sterile fluid types in candida isolation rate were urine (74.9%), blood (8.4%) and pleural fluid (5.0%). The top three departments of Candida isolation rate were ICU (19.4%), Urology (12.4%) and Pulmonary (10.4%). The sensitivity of 403 strains to 5-flucytosine, Amphotericin B, Fluconazole, Voriconazole and Itraconazole was 98.2%, 100%, 93.1%, 95.3% and 92.1%, respectively. No amphotericin B resistant strain was found. Conclusion: The candida albicans isolated from the sterile body fluids of clinical patients are mainly Candida albicans, followed by Near-smooth candida and Tropical Candida. Candida antifungal drugs are highly sensitive, so antifungal drugs should be selected reasonably in clinical practice.
[Key words] Candida Sterile body fluid Drug sensitivity analysis
First-authors address: Peoples Hospital Affiliated to Fujian University of Tradition Chinese Medicine, Fuzhou 350004, China
近年來,随着广谱抗生素的过度使用,念珠菌的感染不断上升,特别在免疫功能严重低下及长期住院的患者中,增加了院内感染的发病率和死亡率[1]。随着抗真菌药的长期使用,敏感性较低的念珠菌特别是非白念珠菌检出率增多,且念珠菌对不同抗真菌药物的耐药性也发生了改变[1-2]。为探究福建中医药大学附属人民医院临床患者的深部念珠菌感染情况和药物敏感情况,本研究收集2015年1月-2019年12月分离自患者无菌体液中的念珠菌进行统计分析,为临床合理使用抗真菌药物提供重要依据,具体如下。
1 资料与方法
1.1 一般资料
收集福建中医药大学附属人民医院2015年1月-2019年12月临床送检的无菌体液标本,如尿液、血液、胸水、腹水、胆汁等,共分离到403株。剔除同一患者连续多次分离的重复菌株。
1.2 仪器与试剂
哥伦比亚血琼脂平板、麦康凯琼脂平板、巧克力琼脂平板、念珠菌显色培养基(均购自安图生物有限公司),Bact/Alert 3D全自动血培养仪及配套血培养瓶、VITEK2-compact全自动细菌鉴定仪、酵母菌鉴定卡、酵母样真菌药敏试剂盒(均购自法国生物梅里埃公司)。
1.3 方法
1.3.1 病原菌的分离与培养 按照《国家临床实验室操作规程》接收及接种标本,血液、胸水、腹水等标本打入血培养瓶中,用Bact/Alert3D全自动血培养仪培进行培养,将阳性瓶转种到哥伦比亚血琼脂平板及巧克力琼脂平板,尿液、胆汁、穿刺液等标本接种在哥伦比亚血琼脂平板及麦康凯琼脂平板上。
1.3.2 菌种鉴定 挑取可疑菌落分纯于念珠菌显色培养基,35 ℃培养24 h,挑取纯菌落配制1.8~2.0麦氏度的菌悬液,用酵母菌鉴定卡在VITEK2-compact全自动细菌鉴定仪上进行鉴定。
1.3.3 药敏试验 挑取纯菌落配制2.0麦氏度的菌悬液,取20 μl菌悬液加入安瓿培养基中,振荡混匀,在真菌药敏试条上的凹孔中加入135 μl混合液,35 ℃培养24 h观察结果,如果24 h菌生长不佳则延长至48 h观察结果。参加检测的药物有5-氟胞嘧啶、两性霉素B、氟康唑、伏立康唑、伊曲康唑。质控菌株为近平滑念珠菌ATCC22019及克柔念珠菌ATCC6258。药敏浓度结果按酵母样真菌药敏试剂盒说明书及美国临床和实验室标准化协会(CLSI)酵母菌稀释法药物敏感试验方案M27-E4判定。
1.4 统计学处理
采用Whonet 5.6软件分析统计数据,计数资料以率(%)表示。
2 结果
2.1 念珠菌菌种分布
403株念珠菌中共鉴定出10种念珠菌种类,其中以白念珠菌占比最高,为48.1%,其次分别为近平滑念珠菌(15.9%)、热带念珠菌(15.4%)、光滑念珠菌(14.6%)及克柔念珠菌(3.2%),同时也发现了较少见的菌种,如季也蒙念珠菌、溶脂念珠菌、都柏林念珠菌、中间念珠菌等,见表1。
2.2 样本来源
403株念珠菌共分离自13种不同标本,最主要来自尿液(74.9%),其次为血液(8.4%)、胸水(5.0%),见表2。
2.3 临床科室分布
403株念珠菌来自29个不同的科室,分离率前五位的科室分别是:重症医学科(19.4%)、泌尿外科(12.4%)、肺病科(10.4%)、肾病科(9.2%)、肿瘤科(8.7%),见表3。
2.4 耐药情况
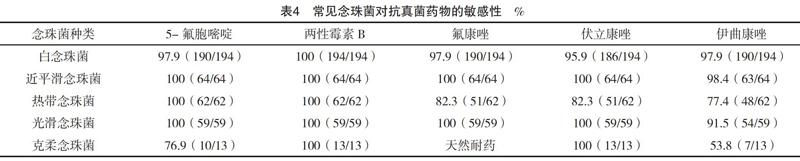
对分离出的403株念珠菌中主要的五种念珠菌进行药敏分析。403株念珠菌对5-氟胞嘧啶、两性霉素B、氟康唑、伏立康唑、伊曲康唑敏感性分別为98.2%、100%、93.1%、95.3%、92.1%;目前对两性霉素B未发现耐药菌株。其中白念珠菌、近平滑念珠菌、光滑念珠菌对五种抗真菌药的敏感性均较高,达到90%以上。热带念珠菌对氟康唑、伏立康唑、伊曲康唑均检出少量耐药菌株。克柔念珠菌对伊曲康唑敏感性较低,为53.8%;对5-氟胞嘧啶的敏感性也较其他念珠菌低,为76.9%,见表4。
3 讨论
念珠菌属是一种条件致病菌,正常情况下定植于人体黏膜表面,如口腔、胃肠道、泌尿生殖道[3],不引起致病。当人体免疫屏障和黏膜屏障的破坏,如使用大量激素和免疫抑制剂、导管或机械通气等有创性操作、器官移植等,使念珠菌侵入机体深部,引起深部真菌感染[4]。
本研究结果显示,分离自403株菌中,排名前三位的念珠菌为白念珠菌、近平滑念珠菌和热带念珠菌,其中白念珠菌数最多,占48.1%,与国内外的研究相同[5-7]。近年来,非白念珠菌及少见念珠菌分离率提高,非白念珠菌的检出比例超过了50%[8],与本研究结果相仿。随着鉴定手段的不断进步,少见念珠菌的检出率会逐年增加。在检出念珠菌的无菌体液标本中,尿液标本占比最大,达到74.9%,这与笔者所在医院送检的无菌体液种类分布有关,但同时也说明尿路真菌感染不容忽视。导致尿路念珠菌感染的危险因素有糖尿病、留置导尿管、使用广谱抗生素、尿路梗阻及进入重症监护病房等[9],因此有上述危险因素的患者应合理使用抗生素预防尿路念珠菌感染。有研究报道,念珠菌血症在医疗相关血流感染的常见原因中排名第4,在重症监护室重症感染的病因中排名首位[10],本研究也表明,从血液中分离出的念珠菌占无菌体液总数的8.4%,且重症医学科检出的念珠菌在所有病区中排名第一。重症医学科的念珠菌感染高发生率与年龄、长期使用抗生素、有创性操作及脏器功能衰竭有关。Gong等[11]研究表明,在重症医学科中接受过手术或有外伤的患者非白念珠菌感染的比例高于白念珠菌,而有锁骨下静脉置管或腹腔引流管的患者,白念珠菌感染更常见。因此,临床医生应根据每个患者不同的病情,合理地选择抗真菌药物。
常用的抗真菌药包括多烯类药物如两性霉素B,三唑类药物如氟康唑、伏立康唑、伊曲康唑,和棘白菌素类药物如卡泊芬净、米卡芬净等。有研究表明念珠菌属对氟康唑和伏立康唑总体耐药率为8.8%和3.8%,白念珠菌最为敏感,近平滑念珠菌敏感性也相对较高,而热带念珠菌对两种药物的耐药率5年间上升较为明显[8],而本研究的结果与之相比有一定差异。本研究显示近平滑念珠菌和光滑念珠菌对氟康唑和伏立康唑的敏感性最高,白念珠菌次之,而热带念珠菌检出的耐药株数相对较多。Zeng等[12]在对侵袭性念珠菌病的流行病学调查中发现,念珠菌属对三唑类药物总体的耐药性为:伊曲康唑耐药性最高,氟康唑次之,伏立康唑最敏感,这与本研究的结果相同。两性霉素B对念珠菌属有很高的活性,本研究暂未发现对两性霉素B耐药的菌株;但最新有研究发现对两性霉素B耐药的白念珠菌,可能由于基因突变造成的[13]。虽然两性霉素B临床效果良好但不能长期使用,因为它会引起入球小动脉收缩,从而导致肾血流量减少和肾小球滤过率降低及肾小管的损伤[14]。本研究显示,5-氟胞嘧啶对常见的白念珠菌、近平滑念珠菌等敏感性高,对克柔念珠菌的敏感性偏低,但5-氟胞嘧啶会阻碍DNA的合成,并可能导致骨髓毒性、白细胞减少和肝酶失衡[15]。因此在抗真菌药的选择上,临床医生应结合实验室药敏结果和患者自身情况合理用药。
综上所述,福建中医药大学附属人民医院无菌体液的念珠菌感染主要以白念珠菌为主,对常用抗真菌药较为敏感,但由于深部念珠菌感染的临床诊断较为困难,临床需结合病人的临床表现、实验室检查及危险因素,合理使用抗生素,避免菌群失调以及多重耐药真菌的出现。
参考文献
[1] Srivastava V,Singla R K,Dubey A K.Emerging Virulence, Drug Resistance and Future Anti-fungal Drugs for Candida Pathogens[J].Curr Top Med Chem,2018,18(9):759-778.
[2] Gowda D V,Afrasim M,Meenakshi S I,et al.A Paradigm Shift in the Development of Anti-Candida Drugs[J].Curr Top Med Chem,2019,19(28):2610-2628.
[3] Coutinho H D M.Factors influencing the virulence of Candida spp[J].West Indian Med J,2009,58(2):160.
[4] Kim J Y.Human fungal pathogens: Why should we learn?[J].J Microbiol,2016,54(3):145-148.
[5]汪倩钰,李从荣,郭静.武汉某院住院患者无菌体液真菌感染临床分布及耐药性分析[J].检验医学,2019,34(7):591-594.
[6] Mirhendi H,Charsizadeh A,Eshaghi H,et al.Species distribution and antifungal susceptibility profile of Candida isolates from blood and other normally sterile foci from pediatric ICU patients in Tehran,Iran[J].Med Mycol,2020,58(2):201-206.
[7] Guo L N,Xiao M,Cao B.Epidemiology and antifungal susceptibilities of yeast isolates causing invasive infections across urban Beijing,China[J].Future Microbiol,2017,12:1075-1086.
[8]王賀.中国多中心侵袭性酵母菌感染临床相关科学研究方法体系的探索和建立[D].北京:北京协和医学院,2017.
[9] Sobel J D,Fisher J F,Kauffman C A.Candida urinary tract infections-epidemiology[J].Clin Infect Dis,2011,52(6):S433-S436.
[10] Pappas P G,Lionakis M S,Arendrup M C.Invasive candidiasis[J].Nat Rev Dis Primers,2018,11(4):18026.
[11] Gong X,Luan T,Wu X,et al.Invasive candidiasis in intensive care units in China: Risk factors and prognoses of Candida albicans and non-albicans Candida infections[J].Am J Infect Control,2016,44(5):e59-e63.
[12] Zeng Z R,Tian G,Ding Y H,et al.Surveillance study of the prevalence, species distribution, antifungal susceptibility, risk factors and mortality of invasive candidiasis in a tertiary teaching hospital in Southwest China[J].BMC Infect Dis,2019,19(1):939.
[13] Touil H F Z,Boucherit K,Boucherit-Otmani Z,et al.Optimum Inhibition of Amphotericin-B-Resistant Candida albicans Strain in Single-and Mixed-Species Biofilms by Candida and Non-Candida Terpenoids[J].Biomolecules,2020,10(2):E342.
[14] Chatelon J,Cortegiani A,Hammad E,et al.Choosing the Right Antifungal Agent in ICU Patients[J].Adv Ther,2019,36(12):3308-3320.
[15] Ahmad K M S,Alshehrei F,Al-Ghamdi S B,et al.Virulence and biofilms as promising targets in developing antipathogenic drugs against candidiasis[J].Future Sci OA,2020,6(2):FSO440.
(收稿日期:2020-03-30) (本文编辑:马竹君)
