聚乙烯亚胺修饰的荧光素钠纳米颗粒在荧光素眼底血管造影术的应用和安全性△
2020-11-16杨倩蔡雯婷金惠子余咚卉沈天怡于靖
杨倩 蔡雯婷 金惠子 余咚卉 沈天怡 于靖
近几十年来,荧光素眼底血管造影(fundus fluorescein angiography,FFA)常用于老年性黄斑变性[1]、糖尿病视网膜病变[2]和血管闭塞[3]等视网膜脉络膜疾病的诊断。荧光素钠是一种水溶性荧光染料,由于其制备工艺简单、显影效果好,已在胶质瘤[4]、中枢神经淋巴瘤[5]及眼底血管疾病等多种疾病的诊断中发挥重要作用。但是在临床应用中,由于荧光素钠容易附着于细胞表面导致代谢缓慢,且易产生恶心、呕吐甚至过敏等不良反应,因此制备一种新型眼底血管造影剂格外重要。聚乙烯亚胺(polyethyleneimine,PEI)是一种可修饰的高度支化聚合物,广泛应用于基因和药物传递[6-11]、CT和MRI等多个领域[12-14]。在本研究中,我们制备了PEI修饰的荧光素钠(PEI-NHAc-FS)纳米颗粒(nanoparticles,NPs)用于FFA,既保留了荧光素钠用于视网膜脉络膜疾病诊断的光学性能,又较游离荧光素钠拥有更快的代谢速率。本研究探讨PEI-NHAc-FS NPs在FFA中应用和安全性。
1 材料与方法
1.1 材料
1.1.1 实验动物取健康棕色雄性挪威大鼠,鼠龄6~8周,体质量180~200 g(购自北京维通利华实验动物技术有限公司)。所有动物均严格按照《视力与眼科动物研究使用说明》和上海市第十人民医院《动物研究使用指南》的规定进行护理和使用,并严格遵守国家卫生和医学研究委员会对实验用动物护理和使用制定的相关指南。本研究遵循《实验动物管理条例》(2017修订版)的规定。
1.1.2 试剂和仪器人脐静脉内皮细胞、内皮细胞培养基(美国CA公司),胎牛血清(美国ΜT公司),支链PEI、N-羟基琥珀酰亚胺、1-乙基-(3-二甲基氨基丙基)碳酰二亚胺盐酸盐(EDC)、10 g·L-1戊巴比妥钠(美国Sigma公司),荧光素钠(广州白云山明兴制药有限公司),CCK-8检测试剂盒(上海翊圣生物科技有限公司),5 g·L-1托吡卡胺(日本参天制药株式会社),盐酸丙美卡因滴眼液(美国爱尔康公司),AV400核磁共振波谱仪(德国Bruker公司),紫外可见光分光光度计(美国PerkinElmer公司)。
1.2 方法
1.2.1 PEI-NHAc-FS合成将1 mL 荧光素钠(200 g·L-1)加入10 mol的EDC混合物中搅拌30 min,再加入10 mol的N-羟基琥珀酰亚胺搅拌3 h。然后将该溶液加入到5 mL PEI (76 g·L-1)中,剧烈搅拌3 d获得PEI-NH2-FS。为了对PEI-NH2-FS进行乙酰化,将2 mL三乙胺加入到PEI-NH2-FS原液中,30 min后再将1 mL的乙酸酐加入混合物中搅拌24 h。最后使用磷酸盐缓冲液对获得的混合物进行透析3 d,随后对PEI-NHAc-FS进行冻干处理。
1.2.2 材料表征分析使用核磁共振波谱仪和紫外可见光吸收光谱观察PEI-NHAc-FS的结构,并对合成的NPs结构进行表征。使用荧光激发-发射矩阵荧光光谱法测量荧光素钠、PEI-NHAc-FS的荧光强度(激发波长230~500 nm)。
1.2.3 细胞培养使用含胎牛血清、青霉素-链霉素、内皮生长补剂的内皮细胞培养液培养人脐静脉内皮细胞,放置于37 ℃、含体积分数5%CO2温箱中培养。
1.2.4 CCK-8法检测细胞毒性将对数生长期的人脐静脉内皮细胞消化计数,以每孔5000个(100 μL)铺入96孔板中,待细胞贴壁后,将0~10 μmol·L-1的荧光素钠和PEI-NHAc-FS加入到96孔板中,并分别培养12 h、24 h后吸尽各孔中培养基,每孔中加入10 μL CCK-8工作液,37 ℃闭光孵育2 h后,用酶标仪在450 nm波长下测定光密度(D)值,根据D值计算细胞活性。
1.2.5 脉络膜新生血管模型构建及动物分组根据既往研究方法,构建大鼠脉络膜新生血管(choroidal neovascularization,CNV)模型。腹腔注射10 g·L-1戊巴比妥钠30 mL·kg-1麻醉成功后,将挪威大鼠仰卧位固定于操作台上,局部应用5 g·L-1托吡卡胺散瞳,5 g·L-1盐酸丙美卡因滴眼液局部麻醉。距视盘等距离激光(532 nm)围绕视盘视网膜光凝,激光功率360 mW,光斑直径50 μm,曝光时间0.1 s。出现气泡或轻微出血说明Bruch膜破裂,提示激光诱导CNV大鼠模型成功建立。
取健康棕色雄性挪威大鼠90只,选取30只大鼠,根据荧光素钠和PEI-NHAc-FS NPs的浓度(5 g·L-1、10 g·L-1、50 g·L-1)将大鼠分为6组,每组5只,即分别于注射前及注射后5 min、20 min、30 min和60 min进行眼底照相,采集眼底血管荧光素图像。用激光诱导大鼠CNV后,取10只大鼠,随机分为10 g·L-1荧光素钠组和PEI-NHAc-FS NPs组,每组5只,分别于注射前及注射后5 min、20 min、30 min和60 min通过眼底血管造影成像观察病灶处渗漏。另取40只大鼠,随机分为10 g·L-1荧光素钠组和PEI-NHAc-FS NPs组,每组20只,于注射后10 min、20 min、30 min和60 min进行荧光冰冻切片。将10只大鼠随机分为对照组(注射生理盐水)和PEI-NHAc-FS NPs组,每组5只,行组织切片HE染色和视网膜电图检测。
1.2.6 眼底照相和血管造影按上述方法对大鼠进行麻醉及散瞳处理后,通过尾静脉分别注射不同浓度的荧光素钠和PEI-NHAc-FS NPs(5 g·L-1、10 g·L-1、50 g·L-1),并于注射前及注射后5 min、20 min、30 min、60 min进行眼底照相,采集眼底血管荧光素图像。
1.2.7 荧光冰冻切片经大鼠尾静脉注射10 g·L-1的荧光素钠和PEI-NHAc-FS NPs,于注射后10 min、20 min、30 min、60 min分批处死大鼠,摘取眼球并在低温恒温器中进行冰冻切片(厚度约5 μm),在荧光显微镜下观察切片并拍照。
1.2.8 HE染色经尾静脉向大鼠体内注射10 g·L-1的PEI-NHAc-FS NPs,28 d后处死大鼠。取心、脾、肾、肝、大脑、肌肉等组织,用磷酸盐缓冲液清洗,40 g·L-1多聚甲醛固定,梯度酒精脱水石蜡包埋,切片厚度约为5 μm,行HE染色。用光学显微镜观察切片并拍照。
1.2.9 视网膜电图检测经尾静脉向大鼠体内注射10 g·L-1的PEI-NHAc-FS NPs,28 d后记录视网膜电图。大鼠暗适应16 h后,腹腔注射戊巴比妥钠(40 mg·kg-1),肌肉注射甲苯噻嗪(6 mg·kg-1)深度麻醉大鼠。在大鼠鼻、尾和眼角膜分别放置记录电极、参考电极及接地电极。以发光二极管(3000 cd·m-2,10 ms)作为刺激器,通过视网膜电流记录系统检测视网膜的功能。
1.3 统计学分析采用SPSS 19.0统计学软件进行数据分析,计量资料用均数±标准差表示,两组间比较采用t检验,多组间比较采用单因素方差分析。检验水准:α=0.05。
2 结果
2.1 PEI-NHAc-FS的表征使用不同的方法对合成的PEI-NHAc-FS NPs进行表征检测。通过核磁共振和紫外可见光吸收光谱观察到荧光素钠与PEI成功耦合。发射荧光光谱显示,游离荧光素钠和PEI-NHAc-FS NPs的最大发射波长分别出现在546 nm和544 nm处。
2.2 细胞毒性检测结果CCK-8检测结果表明,不同浓度的荧光素钠和PEI-NHAc-FS NPs处理人脐静脉内皮细胞12 h、24 h后,细胞活性差异无统计学意义(P>0.05)。即使用10 μmol·L-1PEI-NHAc-FS NPs处理24 h和未处理之间细胞存活率差异亦无统计学意义(P>0.05)。
2.3 静脉注射游离荧光素钠和PEI-NHAc-FS NPs后血管荧光强度及大鼠CNV模型诊断结果FFA图像记录了不同时间点静脉注射5 g·L-1、10 g·L-1、50 g·L-1游离荧光素钠和PEI-NHAc-FS NPs的荧光强度(见图1)。在5 g·L-1游离荧光素钠组和PEI-NHAc-FS NPs组中,均仅显影视网膜主要血管,不能用于FFA的诊断。而在10 g·L-1游离荧光素钠组和PEI-NHAc-FS NPs组可清晰地显示视网膜主要血管及微血管的结构,且在注射后30 min时血管荧光强度基本相同。更重要的是, PEI-NHAc-FS NPs组在60 min时荧光强度已基本消失,而游离荧光素钠组仍保持较强的荧光强度。同时,由于50 g·L-1的PEI-NHAc-FS NPs浓度高,代谢慢,所以本研究采用10 g·L-1PEI-NHAc-FS NPs作为最终浓度。
采用激光光凝建立大鼠CNV模型,尾静脉分别注射10 g·L-1游离荧光素钠和PEI-NHAc-FS NPs进行FFA成像。结果显示,造影剂经尾静脉注射后,视网膜血管内可见荧光成像,同时病灶部位可见荧光渗漏(见图2)。

图1 FFA检测静脉注射不同浓度游离荧光素钠和PEI-NHAc-FS NPs后不同时间血管荧光强度 图中A表示游离荧光素钠,B表示PEI-NHAc-FS NPs
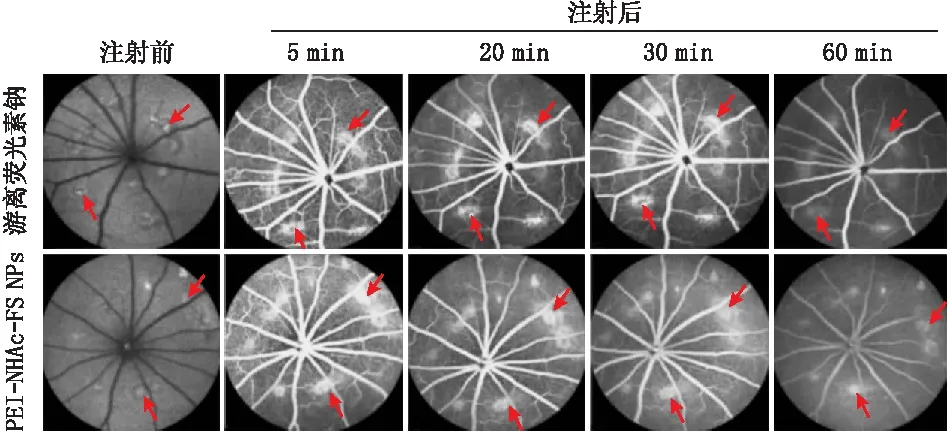
图2 注射前及静脉注射10 g·L-1游离荧光素钠和 PEI-NHAc-FS NPs后不同时间FFA图像 箭头指示病灶
2.4 荧光冰冻切片检测注射荧光素钠和PEI-NHAc-FS NPs后不同时间视网膜各层荧光强度尾静脉分别注射10 g·L-1荧光素钠和PEI-NHAc-FS NPs后,于注射后10 min、20 min、30 min、60 min制作冰冻切片并采集荧光图像。结果显示,游离荧光素钠组在视网膜组织中荧光较强,对视网膜组织有较强的吸附和渗透作用,而PEI-NHAc-FS NPs组在视网膜组织中荧光较弱,对视网膜组织吸附较弱,在体内代谢更快(见图3)。

图3 荧光冰冻切片检测静脉注射10 g·L-1 游离荧光素钠和PEI-NHAc-FS NPs后不同时间视网膜各层荧光强度
2.5 HE染色和视网膜电图进行体内生物安全性分析结果大鼠尾静脉注射PEI-NHAc-FS NPs后28 d,通过HE染色观察到心、肝、脾、肾、大脑和肌肉与注射磷酸盐缓冲液后相比无明显组织形态学改变和损伤(见图4A)。采用视网膜电图检测视网膜功能学改变发现,静脉注射PEI-NHAc-FS NPs后28 d a波振幅为(111.00±6.94)μV,注射磷酸盐缓冲液后a波振幅为(112.63±20.45)μV,差异无统计学意义(t=-1.310,P>0.05)。注射PEI-NHAc-FS NPs后b波振幅为(341.47±13.07)μV,而注射磷酸盐缓冲液后b波振幅为(343.42±36.23)μV,两组差异也无统计学意义(t=-0.088,P>0.05)(见图4B和图4C)。
3 讨论
本研究通过N-羟基琥珀酰亚胺/EDC交联法制备PEI-NH2-FS[15]。根据文献报道,PEI在成像和药物传输中广泛应用,说明PEI可作为良好的纳米载体[6,12]。由于PEI和PEI-NH2-FS表面存在具有毒性的脒基和酰胺原[16-17],因此我们通过乙酰化修饰来降低材料毒性,这也为眼底造影剂的安全应用提供了保障。此外,荧光光谱法测量结果表明,在PEI乙酰化后,荧光素钠的荧光性质几乎无变化,仍能对眼底血管有效显影。
本研究所制备的材料主要优点包括:(1)减少了造影剂在患者体内的滞留。荧光素钠是一种小分子产物,作用于细胞后残留多,本研究应用的新型FFA造影剂可以降低荧光素钠在细胞中的滞留率。(2)减小了PEI-NHAc-FS NPs对人血-脑屏障的潜在毒性。研究表明,PEI-NHAc-FS NPs在体内和体外对CT/MR成像均具有良好的生物相容性[18-20]。由于酰胺原的乙酰化,PEI-NHAc-FS NPs与未加PEI-NHAc-FS NPs组细胞存活率无明显差异。Zhou等[12]研究证实PEI结合Au NPs后在一定浓度范围内无细胞毒性。Calarco等[21]的实验结果也说明,PEI在乙酰化后可以显著降低基因毒性,提高生物相容性,这与本研究结果一致。总之,PEI-NHAc-FS NPs具有良好的细胞相容性,是一种安全的造影剂。
在临床诊断中,高浓度的荧光素钠虽然显影效果好,但是代谢时间长[22],如何让荧光素钠在保证成像效果的前提下,尽量减少使用浓度和提高代谢速度就成了一个巨大的挑战。本研究对三种浓度梯度的荧光素钠和PEI-NHAc-FS NPs(5 g·L-1、10 g·L-1、50 g·L-1)进行了系统地分析。其中10 g·L-1的游离荧光素钠和PEI-NHAc-FS NPs在注射后30 min内均可清晰地显示视网膜血管的结构,但PEI-NHAc-FS NPs中的荧光素钠比游离荧光素钠在血管中清除速度更快;同时PEI-NHAc-FS NPs也能够准确、有效诊断CNV渗漏。
正常情况下,造影剂静脉注射后会随着血液进入全身循环,甚至对相关器官造成影响。既往研究发现,毒性明显的造影剂会对器官的组织形态造成影响[23],但在本研究中,并未出现各器官组织形态受损情况,说明该新型造影剂是安全的。此外,经尾静脉注射PEI-NHAc-FS NPs后反映光感受器电活动的负波(a波)和反映Müller细胞和双极细胞的正波(b波)未见明显变化[24],说明其对视网膜功能无明显影响。本研究采用HE染色和视网膜电图进行体内生物安全性分析结果显示, PEI-NHAc-FS NPs作为造影剂具有良好的生物安全性。
总之,我们合成了用于眼底血管造影的新材料PEI-NHAc-FS NPs。该材料制备方法简单、生物相容性好、性质稳定、代谢率高,能有效显影视网膜血管和CNV渗漏,在FFA诊断中具有广阔的应用前景。
