西太平洋秋季130°E断面有色溶解有机物的分布特征及光降解行为研究
2020-11-16刘可杨琳杨桂朋张婧
刘可,杨琳,杨桂朋,张婧
( 1. 中国海洋大学 化学化工学院,山东 青岛 266100;2. 中国海洋大学 海洋化学理论与工程技术教育部重点实验室,山东青岛 266100)
1 引言
海洋溶解有机物(Dissolved Organic Matter, DOM)是地球表面上最大的还原碳库之一[1]。DOM中能够吸收紫外和可见光的组分,称之为有色溶解有机物(Chromophoric DOM, CDOM)[2]。CDOM是一种复杂的混合物,是水环境中DOM重要的吸光部分,既能阻止有害紫外线对水生生物的伤害,保护水生生态系统,又能产生小分子有机物,为浮游植物所利用;但对可见光的吸收又会抑制光合作用,影响初级生产力[3]。CDOM吸光后能发出荧光的组分,称为荧光溶解有机物(Fluorescent DOM, FDOM)[4]。目前采用三维荧光光谱(EEMs)结合平行因子分析(PARAFAC)技术来分析FDOM的荧光组分,进一步解析CDOM的来源[5]。
在海岸环境中,CDOM主要来自陆源的输入[6];而开阔大洋中CDOM主要来源于现场自生源[7]。目前,开放海域CDOM在海洋生态系统以及生物地球化学循环中的作用已有一定的研究,例如,CDOM既可作为海洋水色遥感中常用的参数[8],也能作为光降解的底物[9]。光化学反应可将高分子有机物转化为低分子有机物,为海洋浮游生物和微生物提供重要的营养物质[10]和碳源[11],因此研究CDOM的光化学降解在海洋碳循环中的作用是非常有意义的。西太平洋处于中低纬度水团形成的十字路口[12],环流系统复杂,且受到密度跃层的影响,因此整体具有高温、寡营养盐、低生产力的特征[13]。对西太平洋海域CDOM的分布特征已有一定了解[14–15],而对该地区CDOM光降解行为的研究还较少。Yamashita和Tanoue[14]在太平洋海域的研究表明,热带和亚热带海区表层吸收系数a(320)和荧光强度分布基本相同。本文研究区域位于西太平洋热带海区,因此选取了一个站位来研究CDOM在太阳光模拟辐射过程中吸收光谱和荧光光谱的变化趋势。
本文通过研究西太平洋130°E断面上层200 m水体CDOM吸收光谱和荧光光谱的空间分布,以及CDOM在太阳光模拟实验中的光降解行为,来探讨该海域CDOM光降解对上层水体CDOM和FDOM分布特征的影响,这有助于进一步揭示西太平洋CDOM的化学组成和来源,及在西太平洋有机碳的生物地球化学循环中的作用。
2 材料和方法
2.1 样品采集与预处理
本研究搭乘“科学”号海洋考察船,于2018年10月3日至11月5日对西太平洋进行现场调查,采样范围为2~21°N,130°E,总共采集了17个站位的样品,如图1所示。西太平洋中部的北赤道流在靠近菲律宾海岸时发生分流,一支是向北的黑潮(KC),另一支是向南的棉兰老流(MC)[16]。随着向南流动,在7°N和3°N附近分别形成了棉兰老涡(ME)和哈马黑拉涡(HE)两涡旋,其中ME为冷涡[15–17]。此次调查采用CTD(SBE 911)和12 L的Niskin采水器在各站位采集水样,采样层次分别为表层、50 m、DCM(叶绿素浓度最大值水层)、150 m、200 m,用CTD测量深度、温度和盐度。

图1 西太平洋秋季调查站位及主要环流Fig. 1 Sampling stations and the main currents in the western Pacific Ocean
样品采集后立即取300 mL海水样品用0.7 μm的GF/F膜过滤,滤液储存于60 mL棕色玻璃瓶内,用于CDOM的测定,冷藏避光保存直到实验室进行分析。滤膜对折放入用锡纸包裹的10 mL离心管中用于叶绿素的测定,在−20°C冷冻保存。水样进行光谱分析前,避光放置至室温。现场所用的滤膜、滤器、棕色玻璃样品瓶和锡纸都预先在马弗炉中450°C灼烧4 h[19]。另外取未过滤的100 mL水样于聚乙烯瓶中用于营养盐的测定,在−20°C冷冻保存。
2.2 测定分析
2.2.1 CDOM吸收光谱测定
CDOM的吸收光谱采用岛津UV-2550紫外−可见分光光度计进行测定,在波长200~800 nm范围内进行扫描,间隔为1 nm,以Milli-Q水作为参比,配以10 cm的比色皿。通过减去700~800 nm范围内的平均值以校正由细小颗粒物散射和仪器引起的基线漂移[19],吸收系数按以下公式计算:

式中,a(λ)为CDOM在波长 λ处的光吸收系数(单位:m−1);A(λ )为波长 λ 时的吸光度;A(λo)为700~800 nm间吸光度的平均值;L为比色皿长度(单位:m)。在研究西太平洋海域时,Yamashita和Tanoue[14]及王泽华等[15]都表明用320 nm处的吸收系数能够更好地表征CDOM的吸收光谱,故本研究也选取a(320)来表征CDOM的相对浓度。
光谱斜率计算公式如下[20]:
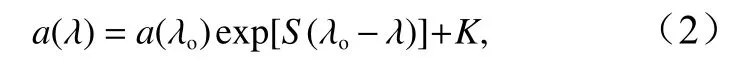
式中,a(λ)为光吸收系数; λo为参比波长;S为吸收光谱曲线的光谱斜率(单位:nm−1),在275~295 nm范围内对吸收曲线进行拟合得到S值(S275−295),参比波长选择280 nm[19];K为背景参数。光谱斜率S275−295是通过Origin软件非线性拟合得到的,能很好地表征CDOM分子量的大小,还可示踪CDOM在UV-B短波段内的光化学反应,来预测CDOM的来源[21–22]。
2.2.2 FDOM三维荧光光谱测定
采用F-4500荧光分光光度计对样品进行三维荧光分析测定,以Milli-Q水作为空白,进行荧光扫描。激发光源为150 W氙灯,光电倍增管电压700 V,扫描速度为2400 nm/min,激发波长200~400 nm,发射波长250~500 nm,间隔均为5 nm。测定的荧光结果扣除Milli-Q水的空白后,采用德洛内(Delaunay)三角形插值法[23]消除拉曼散射和瑞利散射[24],并以Milli-Q水为参考基准,对所得到的信号进行归一化处理,并以拉曼单位(Raman Unit, R.U.)来表示。在样品的整个测试过程中,严格控制Milli-Q水和样品的温度、样品空白等条件,以保证所获得结果具有可靠性。最后将数据导入到MATLAB软件中,采用平行因子分析来确定主要的组分数[25]。
2.2.3 叶绿素a的测定
采用荧光法测定叶绿素a(Chla)的含量[19],主要步骤分为:在4°C的黑暗条件下,用10 mL 90%的丙酮溶液萃取滤膜24 h左右,然后在4000 r/min转速下离心10 min,取上清液2 mL测定。用荧光分光光度计F-4500在激发波长为436 nm、发射波长为670 nm的条件下测定,然后根据Chla的标准曲线求得Chla浓度,该方法的检测限为0.01 μg/L。
2.2.4 营养盐的测定
取出样品自然解冻至室温,在实验室用营养盐自动分析仪(AutoAnalyzer 3,SEAL)测定,具体的实验方法见参考文献[26]。
2.3 溶解氧的采集与测定
打开Niskin采水器上方气门,先放出少量海水洗涤溶解氧(DO)样品瓶两次,然后把玻璃管插到DO瓶底部,装满至海水溢出瓶体积约2倍时轻缓提起玻璃管移出,立即加入氯化锰和碱性碘化钾溶液,盖好瓶塞(注意不要有气泡),再将瓶上下颠倒30余次,使之混合均匀,放在暗处。样品固定1 h后,先加酸溶解,再用硫代硫酸钠标准溶液滴定游离碘,换算DO浓度。
2.4 光化学降解
如图1所示,在E130-30站位表层5 m采集大体积海水样品,用聚醚砜膜(0.22 μm,PALL)过滤,除去大部分细菌,置于酸洗和灼烧过的1 L棕色玻璃瓶中。将水样装入密闭的石英管中(体积约95 mL),在模拟太阳光(CPS+)下照射,通过循环水来保证整个实验过程中温度恒定为25°C,分别在光照0,12 h,24 h,48 h,60 h取样。为排除其他因素对光降解的影响,用锡箔纸包裹石英管(暗处理)在光照24 h和60 h后取样,作为对照组。
3 结果与讨论
3.1 西太平洋CDOM的吸收光谱特征
西太平洋调查海域秋季130°E断面上层水体温度、盐度、a(320)、Chla、S275−295、DO的分布趋势如图2所示。由图2a可知,海水表层温度约为30°C,随水深增加而逐渐降低,到100 m水深其温度开始迅速降低出现温跃层,最高值出现在E130-16站位表层。盐度(图2b)范围为26.48~35.39,在表层低、次表层较高。Chla的浓度范围为0.011~0.730 μg/L(图2d),最高值出现在E130-26站位的75 m水深,Chla浓度低于1 μg/L,说明该海域具有低生产力的特征[13]。
吸收系数a(320)的变化范围为0.025~0.640 m−1,平均值为(0.20±0.08) m−1,此值与王泽华等[15]研究的西太平洋冬季上层水体CDOM的吸收系数(0.01~1.07 m−1,平均值为0.18 m−1)相比,平均值相近。如图2c所示a(320)在纬度方向的0~200 m水层呈高低交错的垂直条带分布,且在菲律宾海的5°~15°N范围内集中出现高值。在垂直方向上,a(320)表层相对较低,随深度增加而增加,在100~200 m水层集中出现较高值,个别水域位于50~100 m水层。由图2d可知在Chla出现高值的区域,a(320)均没有出现高值,这可能与海洋浮游植物在生长期间新产生的溶解有机物在表层和真光层易发生光降解有关[27]。a(320)在100~200 m水体较高,DO浓度较表层低,Yamashita和Tanoue[14]发现a(320)与DO在太平洋也有类似的分布特征,DO浓度较低是由于海洋内部的生物活动,说明a(320)在西太平洋出现高值可能与次表层的生物活动有关。吸收系数a(320)与温度、盐度、DO、营养盐的相关性分析如表2所示,a(320)与DO有明显的负相关性,但与氮、磷、硅营养盐有显著正相关性。西太平洋上层水体盐度范围基本在30~35之间,受河流等陆源物质输入影响较小,故此海域CDOM可能主要源于生物的生产活动。
光谱斜率S275−295可以用来表征分子量的大小和来源,S275−295越高,分子量越小[21–22]。Helms等[22]发现S275−295在开阔海域中较高,近岸河口海域较低。S275−295的分布如图2e所示,S275−295变化范围介于0.016~0.112nm−1之间,平均值为(0.035±0.009) nm−1,具有表层较高、75 m以下较低的特征,表明研究海域表层CDOM分子量较小,75 m以下CDOM分子量较大。del Vecchio和Blough[28]发现海洋中S275−295在0.02~0.03 nm−1范围内,而西太平洋海域S275−295平均值高于此数值范围,说明研究海域有机质具有明显海源性特征。在研究区域上层水体中,a(320)在50 m以浅水体相对较低,但该水层S275−295较高、海水温度高于25°C,推测是由于太阳辐射使现场生产的CDOM发生较强的光漂白降解所致[28]。S275−295在站位E130-16(9°N)表层出现最高值,而a(320)最低、温度最高,可能由于此站位CDOM的光降解程度更为剧烈。a(320)在站位E130-24的150 m水层上下出现最高值,S275−295相应最低,说明分子量最大,可推测该处存在CDOM的再生产或积累作用。
3.2 FDOM的荧光光谱特征
3.2.1 荧光组分特征
对研究区域FDOM的三维荧光光谱进行平行因子分析,鉴别出两种荧光组分如表1所示。与文献进行对比可知:分别为类酪氨酸组分C1和类腐殖质组分C2。C1峰对应的激发/发射波长为(270(225)nm/310 nm)与类酪氨酸B峰相似[30–31],属于典型的类蛋白质组分,主要来源于微生物降解或生物残骸[29]。C2(290 nm/410 nm)峰为海洋类腐殖质,也称为“M”荧光团[29],在太平洋[14]和大西洋海湾[34]中已经观测到,其主要与海洋微生物对有机物的降解有关[30]。

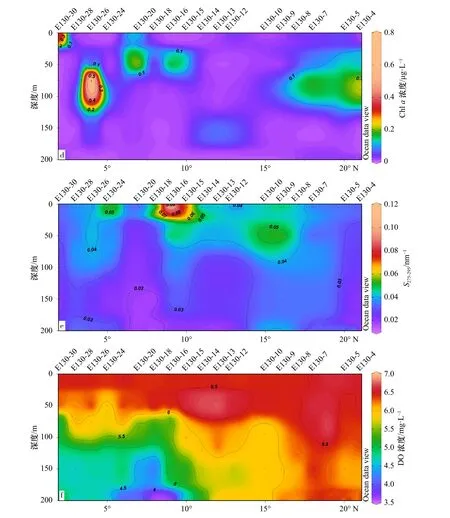
图2 西太平洋上层水体温度、盐度、a(320)、Chl a浓度、S275-295、DO浓度的分布Fig. 2 Distribution of temperature, salinity, a(320), Chl a concentration, S275-295, DO concentration in the upper waters of the western Pacific Ocean

表1 西太平洋上层水体FDOM的主要荧光组分Table 1 Principle fluorescent component of FDOM in the upper waters of the western Pacific Ocean
3.2.2 FDOM荧光组分的分布特征
上层水体中两种荧光组分的荧光强度分布如图3所示,类酪氨酸C1的荧光强度范围为0.00046~0.03600 R.U.,平均值为(0.00890±0.00940) R.U.。海洋类腐殖质C2的荧光强度范围为0~0.0160 R.U.,平均值为(0.0056±0.0046) R.U.。C1的平均荧光值高于C2。类酪氨酸C1在棉兰老涡处附近(E130-20站位)出现较强的荧光强度(图3a),可能因为棉兰老冷涡所伴随的上升流将较深处的营养物质带至上层水体[4,26],促进浮游植物的生产活动并使Chla浓度升高,说明C1与浮游植物的生产活动有关;75 m水深以下水温较低(<25°C),光照较弱,Chla浓度、DO浓度均相对较低(图2d,图2f),说明浮游植物活动性较弱,C1在该水体荧光值较高可能受微生物利用棉兰老涡−上升流携带的营养物质进行生物活动的影响[11]。结果表明棉兰老冷涡−上升流所带来的营养物质促进浮游植物生产和微生物活动,同时促进类酪氨酸C1产生。

图3 西太平洋上层水体中C1和C2荧光强度的分布Fig. 3 Distribution of C1 and C2 fluorescence intensity in the upper waters of the western Pacific Ocean

表2 西太平洋上层水体a(320)和荧光组分与温度、盐度、DO浓度、Chl a浓度、营养盐的相关性分析Table 2 Correlation analysis of a(320) and fluorescent components with temperature, salinity, DO concentration, Chl a concentration,and nutrients in the upper waters of the western Pacific Ocean
如图3b所示垂直方向上,类腐殖质C2在100~200 m水层较高(除7°N附近),表层较低,可能因为表层较强的太阳辐射促进海水FDOM发生光化学降解[4]。Chla浓度与C2荧光值的分布没有相关性(表2),Rochelle-Newall和Fisher[35]研究表明,海洋类腐殖质荧光物质不来源于海洋浮游植物,源于细菌生物量的增加。另外,类腐殖质C2在E130-4站位出现最高荧光值(图3b),此站位位于黑潮源区[16,36],具有较明显的高温、高盐特征(图2a,图2b)。故C2可能来源于黑潮在流经吕宋岛东侧暖涡所带来的东南、北向流交替而产生的海洋类腐殖质[16]。
3.3 CDOM的光化学降解
3.3.1 CDOM的光降解
为更好地了解CDOM在光化学降解过程中的组成成分及性质的变化规律,同样选取吸收系数a(320)作为研究对象。在E130-30站位采集的表层水样可能已经在海洋中发生过光降解,但在实验室进行光照模拟实验发现CDOM仍能发生剧烈光降解,如图4a所示。a(320)在光照60 h后吸收系数从开始的0.063 m−1下降到0.010 m−1。a(320)在前12 h降解速率很快,降解到初始的60.9%。a(320)从12~48 h一直逐渐增加,可能是因为前12 h降解较快,生成大量的低分子DOM,在光诱导下这些低分子量有机物会发生合成作用[37],使CDOM逐渐升高在48 h时达到最大。但随光照时间的增加,由光诱导作用合成的CDOM会逐渐降解,到60 h时CDOM下降为0.01 m−1。而对照组即暗处理在相同的实验条件下,吸收系数基本上保持不变,可以说明实验过程中a(320)的减少是因为光降解引起的。由图4b可知,S275−295在前12 h逐渐增加,之后逐渐下降,到48 h出现最低值(0.039 nm−1),最后又逐渐增加,到60 h出现最高值为0.067 nm−1。结果表明,光降解中a(320)减小,S275−295会增加,说明光降解导致CDOM分子量降低。在整个光照实验中,考虑暗处理对S275−295的影响后,光辐射下发生的光化学反应使S275−295增加45%。

图4 a(320)和S275-295在E130-30站位随光照时间的变化曲线Fig. 4 Variation curve of a(320) and S275-295 at the E130-30 during irradiation time

图5 CDOM的特征吸收光谱(a)和吸收损失光谱(b)的变化曲线Fig. 5 Variation curve of characteristic absorption spectrum (a)and absorption loss spectrum (b) of CDOM
由图5a发现,在光照24 h和48 h时,吸收系数在400~500 nm波长范围内有所升高,说明这两个时间段可能生成了中间产物[38]。在60 h时,吸收系数在400~500 nm波长范围内趋近于0,表明随光照时间增加,CDOM发生剧烈光降解。从图5b可以看出不同波长处吸收值的损失速率不同,光照60 h后,UVB波段(280~320 nm)(吸收系数损失的平均值为(0.24±0.077) m−1)较UV-A波段(320~400 nm)((0.12±0.028) m−1)损失多,在可见光(400~550 nm)范围内吸收系数的损失速率很小((0.062±0.0094) m−1),表明CDOM在光降解过程中紫外区吸收值的降解更加显著。郭卫东和程远月[39]在研究天然日光照射下九龙江口CDOM的光降解中和李奕洁[38]在夏季长江口的光降解行为研究均表明,CDOM的光降解主要发生在紫外区,且吸收系数随波长增大呈指数减小。
3.3.2 FDOM的光降解
类酪氨酸C1和海洋类腐殖质C2荧光组分的光降解行为如图6所示。由图可知光照60 h后,C1和C2分别降解97.5%和53.3%。其中C1在前12 h降解速率最快,降解到初始的85.9%;C2降解速率较慢,到12 h仅降解12.3%。说明类酪氨酸组分更易发生光降解,且光降解程度大于海洋类腐殖质组分。目前光化学研究已有类似的结果,如Helms等[40]在光照68 d后发现酪氨酸荧光(峰B)的光降解程度更大;Zhu等[41]在研究长江口及邻近海域时表明类酪氨酸荧光是一种中间体,易受光降解影响;对于海源类腐殖质不易发生光化学降解可能因为芳香性较低[27,38]。而暗处理即对照组在相同的实验条件下,两类荧光组分的荧光强度与初始值相比变化都不大,说明实验中CDOM荧光强度的损失是由光降解引起的。

图6 C1和C2荧光组分的光降解曲线Fig. 6 Photodegradation curves of C1 and C2 fluorescent components
综上所述,通过对光模拟实验中吸收系数和荧光光谱随辐照时间变化趋势的研究,能进一步解释西太平洋上层水体的分布特征。西太平洋上层水体表层a(320)显示CDOM相对浓度较低,S275−295相对较高,与光模拟实验中a(320)减小、S275−295增大变化趋势相一致,表明西太平洋表层水体a(320)较低是由于光降解的作用。在光降解模拟实验中C1易发生光降解,且光降解程度大于C2,可以进一步解释C1在纬度方向上(除7°N以外)有较低的荧光强度与其易发生光化学降解有关;C2光降解速率相对较慢,在表层较低与受到强太阳辐射发生光降解有关。这些结果表明光降解是西太平洋海域CDOM的重要去除途径。
4 结论
为进一步了解西太平洋溶解有机物的生物地球化学过程,本文对2018年秋季西太平洋130°E断面上层水体CDOM吸收和荧光光谱的分布特征、及光降解实验过程相应参数变化进行研究,可以得出如下结论:
(1)西太平洋上层水体CDOM的吸收系数a(320)在表层相对较低,主要与CDOM的光漂白去除有关;在100~200 m水层较高与次表层的生物活动有关。a(320)与Chla高值区的空间位置不一致,可能与海洋浮游植物在生长期间新产生的溶解有机物在表层和真光层易发生光降解有关。
(2)利用三维荧光光谱−平行因子分析技术对FDOM进行三维荧光分析,得到两种荧光组分,类酪氨酸组分(C1)和海洋类腐殖质组分(C2)。C1主要源于棉兰老冷涡−上升流所带来的营养物质对浮游植物生产活动和微生物活动的促进作用;C2主要源于黑潮所带来的海洋类腐殖质的输入。
(3)光化学降解实验发现,CDOM吸收值的损失主要发生在紫外波段。光照60 h后,C1和C2分别降解97.5%和53.3%,说明类酪氨酸组分相较于海洋类腐殖质组分更易发生光降解。通过对光模拟实验中吸收系数和荧光光谱随辐照时间变化的研究,能进一步解释西太平洋上层水体的分布特征,还表明光降解是CDOM的重要去除途径。
