南极红藻Iridaea cordata和Curdiea racovitzae转录组分析及其极端光环境适应相关基因的挖掘
2020-11-16刘晨临王秀良林学政
刘晨临,王秀良,林学政
( 1. 自然资源部第一海洋研究所,山东 青岛 266061;2. 中国科学院海洋研究所,山东 青岛 266071;3. 青岛海洋科学与技术试点国家实验室 海洋生物学与生物技术实验室,山东 青岛 266237)
1 引言
生活在南极的大型海藻约有120~130种,其中有三分之一的是南极特有的[1]。在西南极半岛,大型海藻广泛生长在潮间带或浅岸海底的礁石上。乔治王岛(King George Island)的梅尔维尔角(Melville Cape),90%以上的岩石底层被海藻覆盖。而在将军湾(Admiralty Bay),夏季大型海藻带几乎环绕着整个海湾沿岸,覆盖了约37%海湾面积。褐藻和红藻在潮下带岩石基底上呈垂直分布,最深可达100 m水深处[2–3]。大型海藻是近岸海洋系统重要的初级生产者,为其他海洋生物提供庇护和食物来源[4]。除生态学意义,许多大型海藻也具有较高的经济价值,目前对南大洋海藻资源的开发利用日益成为热点[5]。产胶红藻Iridaea cordata(Turner)Bory和Curdiea racovitzaeHariot是南极和亚南极海岸潮间带和潮下带的常见物种[6]。I. cordata产卡拉胶[7],其硫酸多糖具有抗癌活性[8],C. racovitzae则是产琼胶海藻[9]。
许多来自南极的物种只在低于5℃的温度条件下生长和繁殖。低温需求决定了它们在南极的北部分布边界。I. cordata的最适生长温度在0~5℃,生存温度的上限为11~16℃[10]。除冰冻和低温外,海藻的生长发育也被南极地区多种极端的光环境影响。夏季,潮间带海藻暴露在强烈的紫外线辐射下,需要有效的紫外线伤害的防御和修复能力[11–12]。在I. cordata中发现了能够吸收紫外线,降低紫外辐射伤害的类菌胞素氨基酸[13]。而冬季由于极夜和海冰覆盖,黑暗时间较长,海藻生长必须适应弱光环境,降低其光合作用和生长对光照的需求量[14–15]。在南极漫长黑暗的冬季,因为具有较高的光合效率和极低的光补偿点和光饱和点,I. cordata仍然能够持续生长[10]。
目前,对南极大型海藻的研究主要集中在生态分布、生物量和生物多样性[2–3,6,15–16]、功能活性物质的发现[17–18],以 及 光 合 生 理 活 性[10–12,19–20]等 方 面。迄 今 为止,除了南极绿藻Prasiola crispa的转录组数据[21],未见其他南极海藻功能基因或转录组学研究的报道。南极藻类因其特有的耐受极端环境的能力,成为发现新基因和新代谢机制的理想材料。而转录组测序和分析是发现这些基因资源最经济、有效的手段。我们从两种南极红藻的转录组序列中,挖掘了一些独特的可能与其南极极端光环境,包括弱光和强紫外线辐射等适应相关基因,为后续开展南极红藻极端环境适应机制研究提供了依据。同时从南极红藻中发现的光修复酶基因,在化妆品领域也有开发利用的前景。
2 材料与方法
2.1 海藻样品
2018年2 月,在第34次中国南极科学考察中,依托“向阳红01”号科学考察船,在西南极南设得兰群岛乔治王岛的长城站附近(62.216°S,58.960°W)潮间带采集红藻样品。采样时阴天有小雨,气温约2℃。用无菌海水清洗藻体后,置于船上−150℃冰箱保存。保持冷冻状态至回国后,在实验室提取藻样的总RNA。
2.2 总RNA提取和cDNA文库的构建
首先将冷冻的海藻样品浸入液氮中,用冷却的研钵研磨成细粉。使用天根植物RNAprep试剂盒提取总RNA。采用微量核酸定量仪检测RNA的质量和浓度。测序文库使用TruSeq RNA样品制备试剂盒(Illumina, USA)构建。用Illumina PCR引物进行15个循环的PCR反应,选择性富集两端连接接头分子的DNA片段,并用AMPure XP系统纯化(Beckman Coulter,USA)。采用安捷伦(Agilent)生物分析仪2100系统中的高灵敏度DNA分析技术对产物进行定量。Illumina Hiseq测序委托上海派森诺生物技术有限公司完成。
2.3 转录组数据组装和功能注释
在数据组装前先过滤原始数据。使用Cutadapt(v1.15)软件删除引物或接头序列。过滤掉超过10%碱基质量低于Q20的或未知核苷酸(Ns)碱基超过5%的序列。使用Trinity (v2.5.1)软件对转录本进行拼接[22]。选择每个基因最长的转录本作为该基因的代表性序列称为非冗余基因。BlastX同源搜索NCBI非冗余蛋白数据库NR (http://www.ncbi.nlm.nih.gov),E-value<10–5。利用真核生物直系同源蛋白质聚类EggNOG(Evolutionary Genealogy of Genes: Non-supervised Orthologous Groups,http://eggnog.embl.de/version_3.0/)对非冗余基因进行功能分类注释[23]。利用京都基因与基因组百科全书KEGG(Kyoto Encyclopedia of Genes and Genomes,http://www.kegg.jp/)进行代谢通路注释,获得物种内分子间相互作用和反应的网络。KEGG代谢通路注释以双向最佳匹配(BBH)的方法,采用KAAS软件完成[24]。使用PrimerPro(http://webdocs.cs.ualberta.ca/~yifeng/PrimerPro/)的微卫星搜索模块(MISA)筛选简单重复序列(SSRs)。
2.4 系统进化树的构建
基因家族系统进化树的构建用MEGA X软件完成[25],将选择的序列经MUSCLE比对后,采用默认参数,用邻接法构建系统树。经过1000次自展值的检验,显示一致性的系统树。
3 结果与讨论
3.1 南极红藻Iridaea cordata和Curdiea racovitzae转录组组装和注释
南极红藻I. cordata和C. racovitzae的形态如图1所示。红藻的鉴定采用克隆的18S rRNA基因与Gen-Bank已知序列进行比对,相似性为100%。
每种红藻的转录组测序量约为6 G,I. cordata和C. racovitzae的转录组序列分别拼接成了14055条和12006条非冗余基因(表1)。非冗余基因的平均长度分别为1473 bp和1448 bp。I. cordata的鸟嘌呤和胞嘧啶(GC)含量约为53.82%,C. racovitzae的GC含量约为47.28%。GC含量在一定程度上反映了基因组的热稳定性。角叉菜Chondrus crispus的GC含量约为55.6%[26],而龙须菜Gracilariopsis lemaneiformisGC含量为48.13%[27]。南极红藻的GC含量与常温红藻的GC含量差别不大。
I. cordata和C. racovitzae转录组序列在各个数据库的注释情况见表2。在NR数据库,I. cordata和C.racovitzae分别有4788条(34.07%)和4468条(37.21%)非冗余基因得到注释。在Swissprot数量库中I. cordata和C. racovitzae则分别有4864(34.61%)和4938(41.13%)条非冗余基因得到注释。紫菜Pyropia tenera转录组序列在UniProt数据库(不含其他紫菜属物种的基因组和转录组序列)中也仅有33.6%的重叠群匹配到同源序列[28]。这说明了红藻基因与公共数据库中已知基因序列间的同源性较低,继续丰富不同种类红藻基因数据资源是很有必要的[29]。

图1 南极红藻Iridaea cordata (a)和Curdiea racovitzae (b)的形态Fig. 1 The morphology of Iridaea cordata (a) and Curdiea racovitzae (b)
I. cordata和C. racovitzae中被EggNOG注释的非冗余基因分别有4523和4238条(图2)。除了一般功能预测和功能未知的分类,翻译后修饰、蛋白反转和分子伴侣类别的非冗余基因(579,581)最多,其次依次是翻译、核糖体结构和起源(485,485)、信号传导机制(389,321)、碳水化合物转运和代谢(301,280)、能量的产生和转换(259,279)、RNA加工和修饰(237,221)、复制、重组和修复(209,176)、细胞内转移、分泌和囊泡转运(209,220)、氨基酸转运和代谢(201,209)以及转录(198,193)等分类。
3.2 南极红藻转录组序列与常温近缘红藻基因组序列的比较
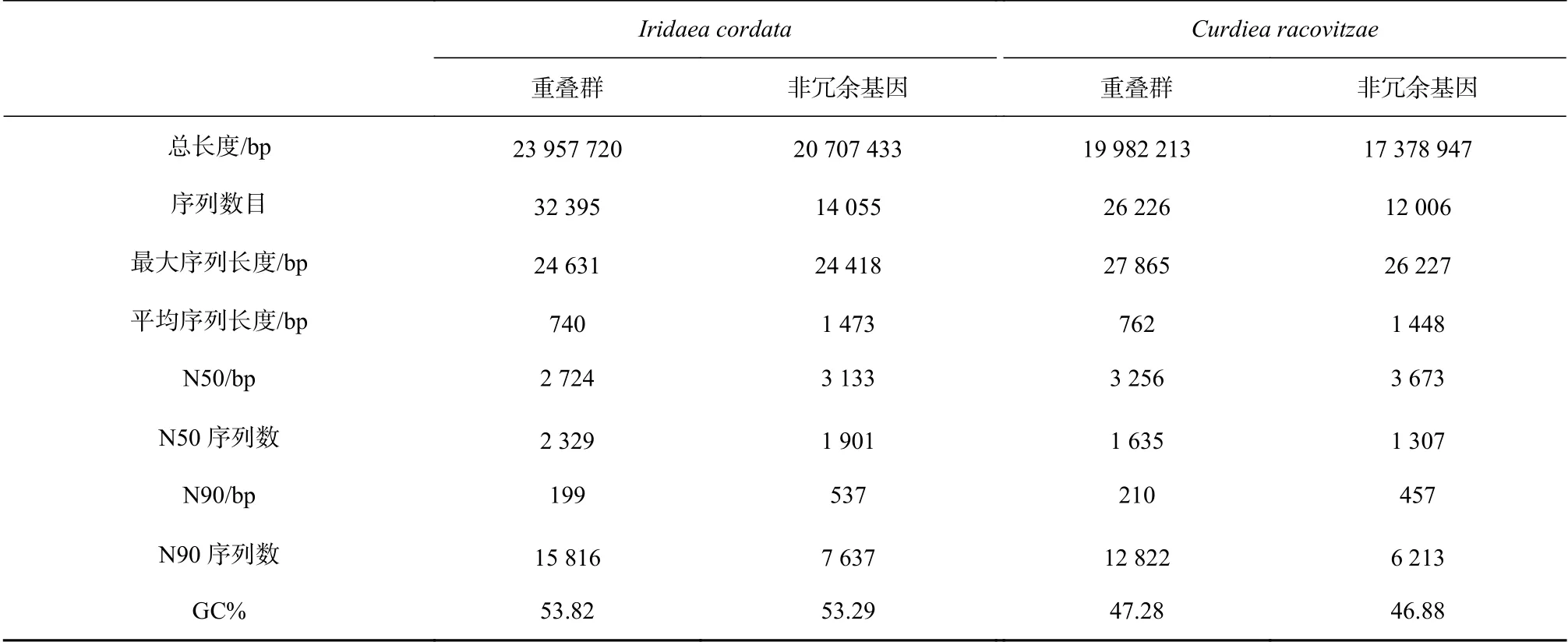
表1 南极红藻Iridaea cordata和Curdiea racovitzae转录本和非冗余基因Table 1 The contigs and unigenes of Iridaea cordata and Curdiea racovitzae
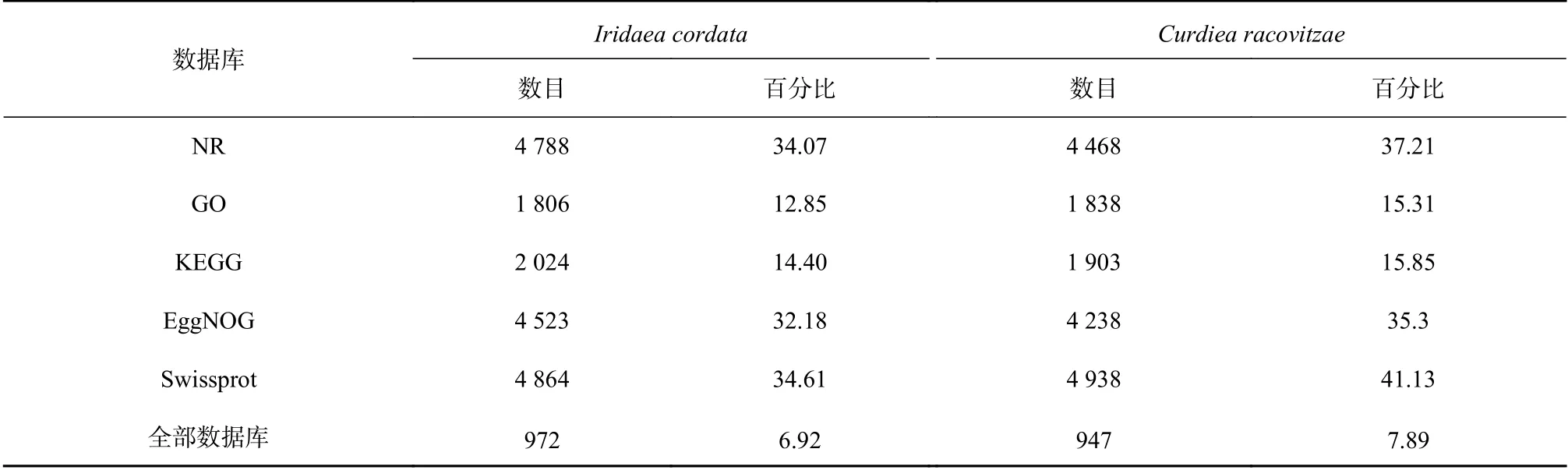
表2 Iridaea cordata和Curdiea racovitzae转录组序列在各个数据库的注释结果Table 2 The annotation results of Iridaea cordata and Curdiea racovitzae transcriptome
在已完成全基因组测序的红藻中,角叉菜与I. cordata都属于杉菜目,亲缘关系最近。龙须菜与C.racovitzae同属于江蓠目,有较近的亲缘关系。我们将所测的两种南极红藻的转录组序列分别与角叉菜(基因组GenBank序列收录号:PRJEA78309、PRJNA 193762)和龙须菜 (PRJNA361418) 的基因组的蛋白编码序列用本地BlastX(E-value<10−5)进行比较,发现有5955条I. cordata的非冗余基因与4059条角叉菜的序列匹配。C. racovitzae的4964条非冗余基因匹配到了3596条龙须菜基因序列(图3),但是两两物种间,互相不匹配的序列占有更大比例,说明同目的红藻间遗传差异较大。
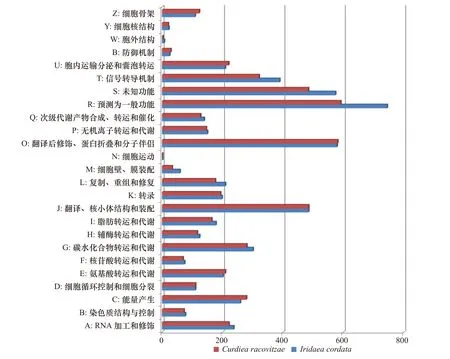
图2 Iridaea cordata和Curdiea racovitzae转录组序列的EggNOG功能分类Fig. 2 EggNOG function classification of Iridaea cordata and Curdiea racovitzae
3.3 捕光复合物基因家族
在光系统中,捕光复合物LHC (Light-Harvesting Complex) 负责捕获光能并将能量转移到反应中心。除了吸收光,这些蛋白质还参与了光保护反应,以清除光合作用过程中产生的活性氧[30]。我们从红藻角叉菜、龙须菜和耐受酸热环境的单细胞红藻Galdieria sulphuraria(PRJNA13023) 的基因组序列,以及两种南极红藻转录组序列中,通过BlastP比对、KEGG注释分析和Pfam注释查找有CB (Chloro a/b-bind) 结构域的序列[31],筛选了假定的LHC家族基因,利用这些基因编码的蛋白序列构建了系统树(图4)。之前的研究认为红藻中仅有光系统I(PSI)相关的,与叶绿素a和类胡萝卜素结合的LHC天线蛋白,称为LHCR[32–33]。LHCR的数目在不同红藻间存在差异,蛋白分离纯化的结果表明紫球藻有6种不同的LHCR蛋白,G. sulphuraria有5种,而Cyanidioschyzon merolae只有3种[33]。
从角叉菜、龙须菜和G. sulphuraria的基因组序列中各找到了5、13和10条Lhc序列。角叉菜的5条Lhcr基因均编码红藻型LHC蛋白,龙须菜有7条Lhcr基因,6条其他类型的Lhc基因。G. sulphuraria中有9条Lhcr基因和1条其他类型的Lhc基因。从I. cordata和C. racovitzae转录组中分别找到了8条和5条Lhc基因。分别包括4条Lhcr和1条Lhcf基因。Lhcf编码岩藻黄质和Chla/c结合蛋白,属于PSI天线复合体。LHCF是硅藻和褐藻中的主要天线蛋白,但还未见在红藻中的报道[34–35]。此外,I. cordata转录组中还包含多条与绿藻LHC蛋白同源的序列,参照莱茵衣藻LHC的分类,分别为Lhca2,Lhca6和Lhcb基因(图5)。在莱茵衣藻中,LHCa2和LHCa6属于PSI,而LHCb属于PSII。
目前关于LHC蛋白的进化还缺少切实的证据,一种观点认为,红藻、绿藻和高等植物Lhc基因家族是共同起源,独立进化的[32]。在进化过程中,由于藻胆体的丢失,有些Lhca(LhcI) 的基因功能进一步分化,成为PSII的天线蛋白[33]。绿藻中编码Chla/b-和Chla/c结合蛋白的基因在LHCI / LHCII分化之前就已经彼此分离[36]。LHCb是植物生长和光保护反应的关键蛋白。目前对PSII中LHC蛋白的研究主要在高等植物和绿藻中,而其他物种中则少见报道[36]。对于南极红藻I. cordata特有的Lhc基因的蛋白产物还需要蛋白分离纯化等生物化学的方法进行验证。但是Lhc基因家族的扩张能够增强I. cordata在光限制环境中的光吸收和能量转移能力,可能是适应南极冬季弱光环境生存的关键。

图3 角叉菜Chondrus crispus与Iridaea cordata,龙须菜Gracilariopsis chorda与Curdiea racovitzae匹配基因数目的韦恩图Fig. 3 Diagram of the matching gene numbers between Chondrus crispus and Iridaea cordata, Gracilariopsis chorda and Curdiea racovitzae
3.4 光裂解酶基因家族
环境非生物胁迫,如干旱或紫外线,可诱导藻类DNA损伤。目前发现的两种光裂解酶,环丁烷嘧啶二聚体(CPD)光裂解酶和6−4光裂解酶,可以特异性地修复不同类型的UV诱导的DNA损伤,CPD和6−4嘧啶酮光产物 (6−4 PP)[37]。光裂解酶属于紫外线/蓝光激活蛋白家族—光裂解酶/隐花色素(CPF)家族,这个超家族包括光裂解酶、隐花色素(Cry)和Cry-DASH。这三类成员有很高的同源性,都含有能结合两个生色团的PHR(Photolyase Homology Region)功能区[38],但是Cry-DASH和隐花色素的PHR无光裂解酶活性[39]。
从红藻角叉菜、龙须菜和G. sulphuraria的基因组序列,以及南极红藻的转录组序列中通过Pfam注释,选取了所有含PHR功能区的序列,作为假定的光裂解酶/隐花色素CPF家族蛋白序列,同时参考Fortunato等[40]构建的CPF超级家族系统树,选择其中的绿藻、硅藻、褐藻和拟南芥的序列,与我们筛选的红藻CPF家族蛋白序列一起构建了的系统进化树,并对进化树的分支进行了功能划分(图6)。I. cordata的转录组序列中有4条CPF家族基因,分别属于6−4光裂解酶,光裂解酶CPD I和CPD II家族。C. racovitzae转录组序列中有6条CPF家族基因,分别编码隐花色素Cry、Cry-DASH、Cry-DASH II和光裂解酶CPD II。6−4光裂解酶分支的物种,包括红藻、硅藻、褐藻、绿藻和高等植物。Fortunato等[40]未在角叉菜中发现6−4光裂解酶基因,认为只有单细胞红藻中有6−4光裂解酶,但是我们在除C. racovitzae之外的所有红藻中,都找到了6−4光裂解酶同源序列,说明其在红藻中是广泛存在的。光裂解酶CPD,分为2个分支,CPD II广泛分布于各类生物物种[40],与我们的结果一致。而CPD I则主要存在于细菌、古细菌、蓝细菌和真菌中[37,40]。Fortunato等[40]未在灰色藻、甲藻和红藻角叉菜中找到CPD I家族基因,但是在我们构建的系统进化树中,在红藻I. cordata,龙须菜以及硅藻中都找到了CPD I的同源序列。我们认为在少数种类的硅藻和红藻中存在的CPD I基因可能是通过水平基因转移从原核生物中获得的,用于修复其因生活环境严酷而造成的DNA损伤。在I. cordata转录组中未找到红藻中普遍存在的Cry和Cry-DASH序列,同时在C. racovitzae转录组中未发现6−4光裂解酶,可能是转录组测序未能完全覆盖基因组中所有编码序列导致的。
3.5 简单重复序列SSR
从转录组序列中筛选的SSR序列,因为其丰富性且与编码基因紧密相关,成为在物种适应性、生物地理分布和进化研究中的重要分子标记。利用MISA软件分别从I. cordata的3014条非冗余基因中鉴定出5560个SSR位点,从C. racovitzae的1636条非冗余基因中鉴定出2473个SSR位点。其中单核苷酸重复最多。紫菜P. seriata中三核苷酸的数目最多[29]。SSR的频率和分布被认为取决于各种因素,如数据集的大小、工具和使用的标准[41]。

图4 捕光复合物的系统进化树Fig. 4 Phylogenetic tree of the light harvesting complex superfamily

图5 Iridaea cordata的Lhca2、Lhca6和Lhcb基因编码的蛋白序列与绿藻LHC序列的比较Fig. 5 Alignment of Lhca2, Lhca6 and Lhcb of Iridaea cordata with homologous LHCs in green algae
南极历史上的冰川期对潮间带物种造成了毁灭性的破坏,但是南极大陆架边缘仍有零散的冰川未影响到的区域,成为潮间带海藻的庇护所。在过去的500万年间,南极地区至少发生了38个冰期−间冰期循环[42]。由此可能会导致南极潮间带生物生殖隔离和遗传分化的产生[43]。利用单一基因的DNA条形码序列研究冰川期栖息地减少对南极半岛和南设得兰群岛常见的6种大型红藻遗传多样性的影响,由于得到的遗传多样性水平极低,无法有效划分海藻的种群,难以确定南极海藻起源的冰川庇护所的位置[6]。采用SSR标记获得海藻种内的更精细的遗传学分化,则有希望解决这一问题。同时SSR标记还可以应用于研究南极的地质演变以及预测气候变化对南极生态系统的影响。
4 结论
南极红藻是南极地区重要的生物资源,作为极端环境生物,对其转录组序列的研究有助于新基因和代谢途径的发现。由于实验材料获取和运输保藏的困难,很难获取新鲜的材料提取RNA用于转录组测序,这可能是目前南极大型海藻转录组学研究较少的原因。我们依托“向阳红01”号的船载超低温冰箱,保证了从样品采集到实验室RNA提取的过程中,材料保存完好。提取到了符合建库要求的RNA,顺利完成了两种产胶红藻的转录组测序工作。通过分析转录组序列,我们发现了一些可能与南极红藻光限制和紫外线辐射等极端光环境适应相关的特有基因,南极红藻更加多样化的Lhc基因可能是增强I. cordata在光限制环境中的光吸收和能量转移能力,适应南极冬季弱光环境生存的关键。而光裂解酶基因与其适应极地的强紫外线辐射密切相关。这些基因的功能仍有待于进一步的验证。通过转录组测序获得的SSR标记也为南极红藻的适应性和遗传多样性的研究开展奠定了基础。
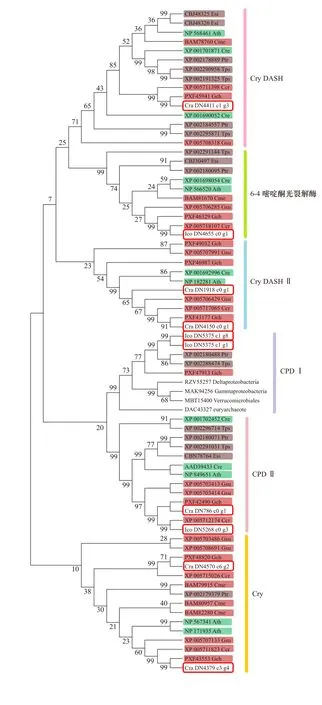
图6 光裂解酶/隐花色素超家族的系统进化树Fig. 6 Phylogenetic tree of the cryptochrome/photolyase family
