红参皂苷在人尿液的排泄实验研究△
2020-11-16杨秀伟周琪乐
杨秀伟,周琪乐
北京大学 药学院/天然药物及仿生药物国家重点实验室,北京 100191
红参Ginseng Radix et Rhizoma Rubra是五加科多年生草本植物人参PanaxginsengC. A. Mey.的根和根茎经蒸制成的产品,驰名中外。人参根和根茎含有独特的四环三萜达玛烷型三萜[1-5],经蒸制后许多成分发生了化学结构转化[6-9],药性亦发生了改变[9]。本课题组前期研究报道了红参中人参皂苷的定量分析[10],本实验研究人口服红参后,其中的人参皂苷在人尿液中的排泄。
1 材料
1.1 仪器
岛津LCMS-8050超高效液相色谱-质谱联用仪,包括Nexera X2 UFLC液相系统:LC-30AD二元泵、SIL-30AC自动进样器、SPD-M30A检测器、CTO-20AC柱温箱;8050型三重四级杆定量质谱:配备ESI离子源和LabSolution工作站;Mettler XS105DU十万分之一电子天平(METTLER TOLEDO,Zurich,Switzerland);AR4120型万分之一电子天平[奥豪斯国际贸易(上海)有限公司];KQ5200超声波清洗仪(昆山市超声仪器有限公司,功率:200 W,频率:40 kHz)。
1.2 试药
红参(批号:20131201JLRG)水提取物(批号:PG-Y-201606)由长春加一健康食品有限公司提供,主要制备方法[6]:干燥的红参粗粉(10 kg)用沸水提取3次,每次80 L,提取4 h;合并提取液,减压浓缩得干膏4.65 kg。
对照品人参皂苷(G):20(S)-G-Rh1(1)、G-Rd (2)、G-Rk3(3)、G-Rh4(4)、20(S)-G-Rg3(5)、20(R)-G-Rg3(6),20(S)-原人参三醇(PPT)(7)、20(R)-PPT (8)、G-化合物(C)-K (9)和20(S)-原人参二醇(PPD)(10) 系本课题组从红参[6]或人参茎叶总皂苷酸水解产物[11]中分离制备,纯度经液相色谱-质谱(LC-MS)测定均大于98%。以上10个对照品的化学结构式见图1。
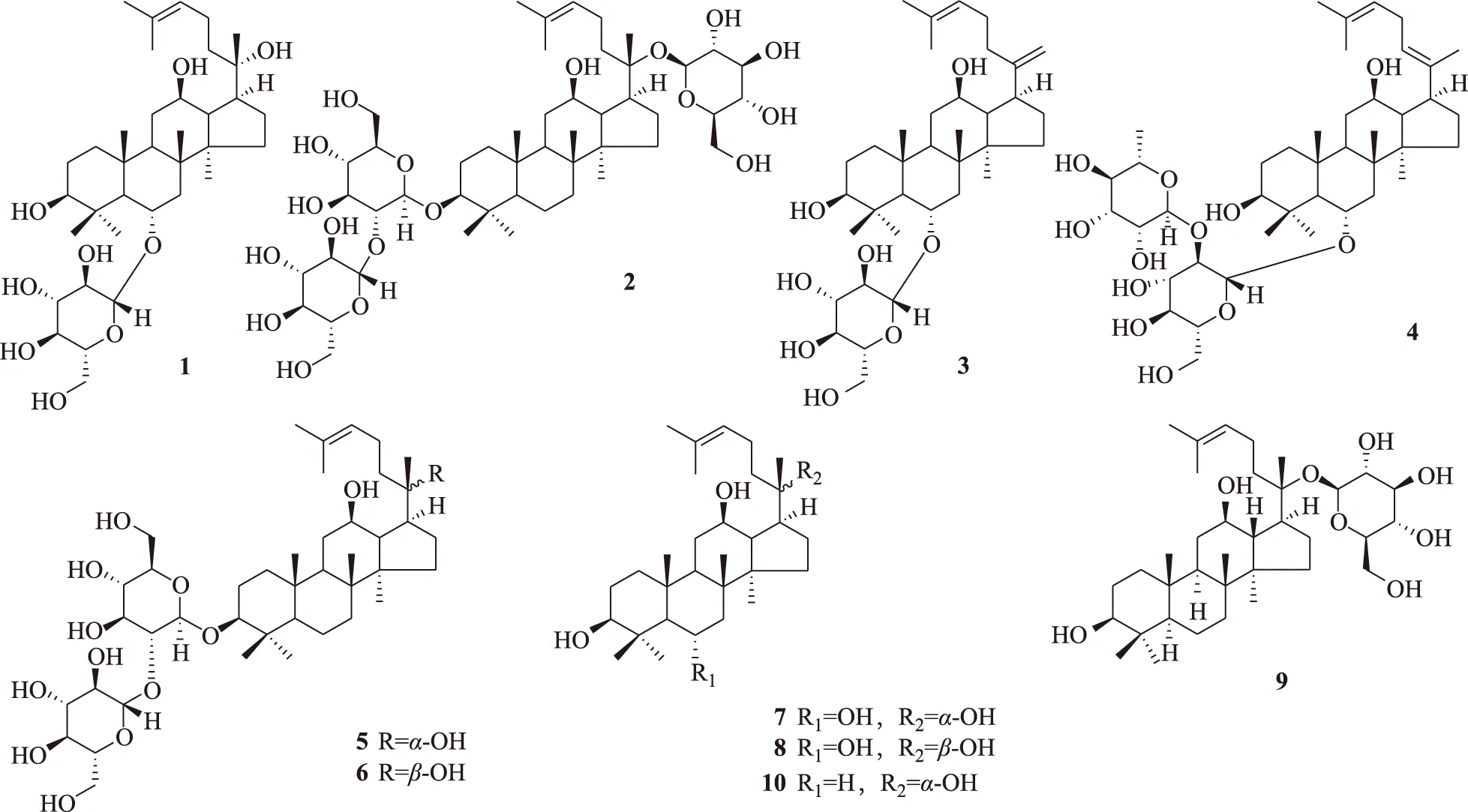
图1 10个对照品(以及口服红参水提取物后在人尿液中监测到的这些化合物)的结构
LC-MS级别乙腈和甲醇(Fisher Scientific Inc.);色谱纯级别乙腈和甲醇(天津西华特种试剂厂);超纯水(18 MΩ/cm)为本实验室用Milli-Q Advantage A10 (Millipore,Billerica,USA)制水机自制;HPLC级别乙酸铵(Sigma-Aldrich公司)。
2 方法
2.1 色谱与质谱条件
液质分析C18色谱柱为Waters ACQUITY UPLCBEH Shield RP18(100 mm×2.1 mm,1.7 μm);预柱Waters ACQUITY UPLCBEH Shield RP18VanGuardTMPre-Column (5 mm×2.1 mm,1.7 μm)。流动相为0.1 mmol·L-1醋酸铵水溶液(A)和乙腈(B),采用梯度洗脱方式,梯度洗脱(0~4 min,72%~67%A;4~6 min,67%~61%A;6~6.1 min,61%~58%A;6.1~13 min,58%~53%A);流速为0.4 mL·min-1;柱温为35 ℃;进样体积为2 μL。
质谱优化参数:雾化气流速为3 L·min-1;干燥气流速为10 L·min-1;加热气流速为10 L·min-1;接口加热器温度为300 ℃;脱溶剂管温度为250 ℃;接口电压:-3.0 kV;检测器电压为1.80 kV。电离源为电喷雾离子源,负离子扫描模式,扫描方式为多反应监测(multiple reaction monitoring,MRM)。
选择监测的10个化合物及内标地高辛(digoxin)的MRM离子对、滞留时间(dwell time)、Q1和Q3能量、碰撞能量(CE)见表1。
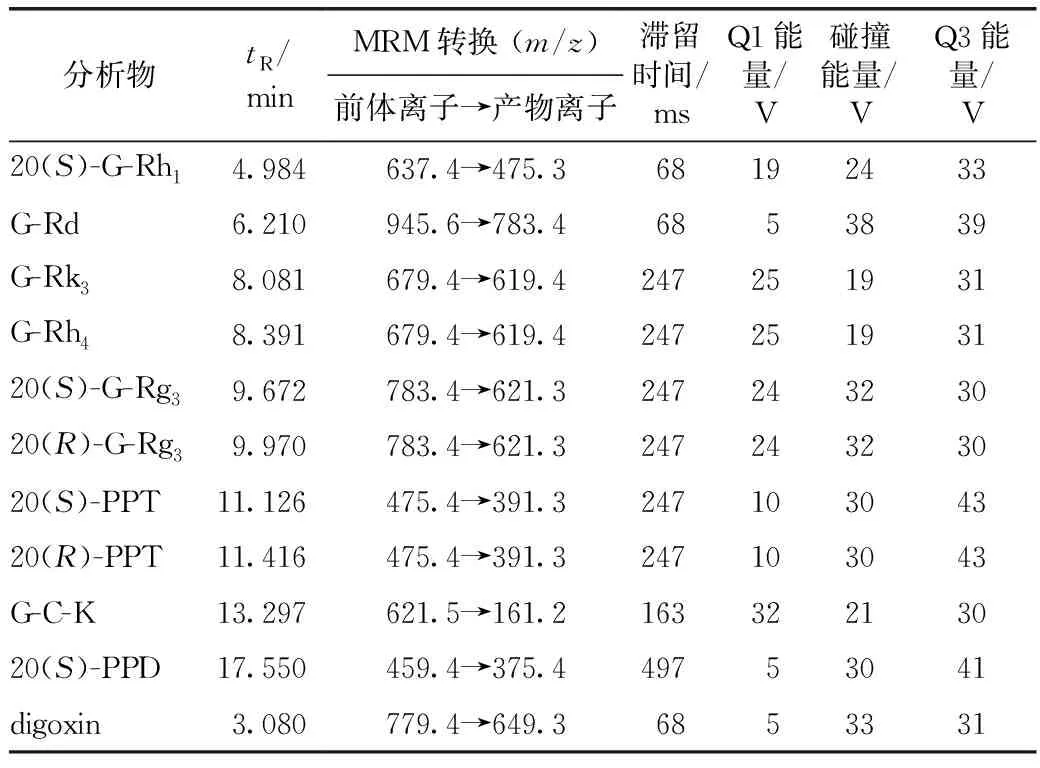
表1 测定的10个三萜成分及内标(地高辛)的质谱MRM参数
2.2 储备液及工作溶液的配制
精密称取上述10个对照品各适量,分别精密加入LC-MS级甲醇配制成1.0 mg·mL-1的储备液;精密称取内标化合物地高辛适量,加入LC-MS级甲醇配制成1.0 μg·mL-1的内标溶液。制备标准溶液时,以甲醇将储备液稀释成一系列工作溶液,密封,置4 ℃冰箱中保存,备用。
2.3 混合对照品溶液的配制
分别移取适量储备液混合并稀释制成混合对照品母液。连续稀释混合对照品母液得到一系列混合对照品线性工作液。
2.4 方法学验证
分别对分析方法的专属性、系统适用性、线性、检测下限和定量下限、重复性、提取回收率和稳定性进行方法学考察,结果表明,该方法能够用于上述10个分析物的含量测定(数据略)。各待测化合物的内标校正曲线的线性范围和回归方程见表2。
2.5 口服红参提取物
成年人(62 kg体质量,男,55周岁)口服红参提取物2 g(相当于4.30 g红参),然后分别在0~3、3~6、6~12、12~24 h收集尿液,尿液经过滤后,加入甲醇-乙腈(3∶1)沉淀离心后,收集上清液待进一步处理分析。
3 结果与分析
3.1 色谱行为
在选定的色谱条件下,10个人参皂苷类化合物和内标地高辛的保留时间见表1;MRM图谱显示无内源性物质对其干扰,口服红参水提取物后各时间段人尿液样品对应的10个化合物的MRM图谱见图2。
3.2 人尿液中10个人参皂苷类成分含量
人口服红参水提取物后各时间段尿液中能检测到的10个化合物的绝对含量见表3。

表2 各待测分析物的内标校正曲线的线性范围和回归方程 ng·mL-1
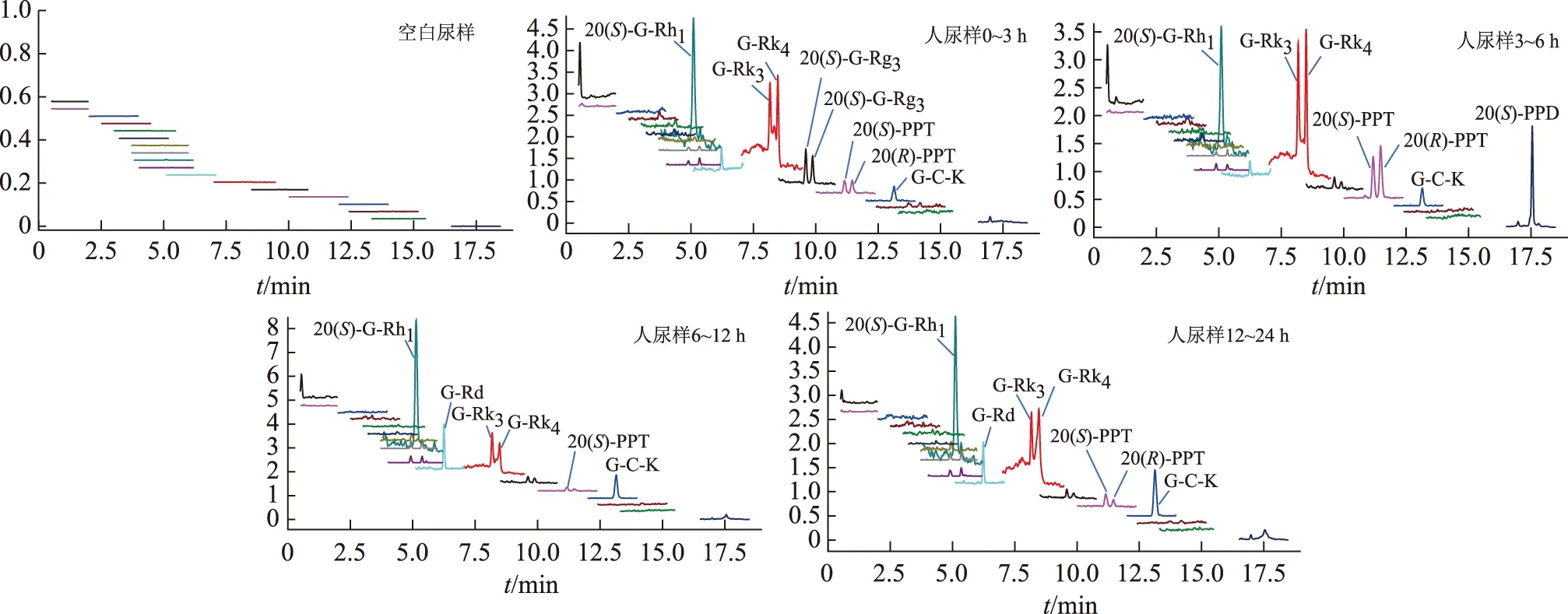
图2 人口服红参提取物后各时间段尿液的MRM图谱

表3 人口服红参水提取物后各时间段尿液中10个化合物的绝对含量 ng
4 讨论
在人口服红参水提取物后24 h排泄的尿液中能检测到10个人参三萜类化合物,其化学结构见图1。化合物2、5、6、9和10为二醇型达玛烷三萜,化合物1、3、4、7和8为三醇型达玛烷三萜。表3中的10个分析物中,除G-C-K在红参水提取物中不存在外,其他9个人参三萜类化合物在红参水提取物[6,10]中均存在,尽管如此,本研究结果也不能排除它们是某个或某些人参皂苷在人体内的代谢产物,如:已有研究显示,志愿受试者口服G-Re(200 mg),在尿液中可检测到原形化合物G-Re及其代谢产物G-Rg1、G-F1、G-Rh1和PPT[12],说明G-Re在体内可代谢为G-Rh1,后者经尿液排泄。证明G-C-K肯定是作为人参皂苷的体内代谢产物,在体内代谢产生,经尿液排泄。在体内代谢转化为G-C-K的红参中的皂苷,可能包括二醇型达玛烷三萜G-Ra1、G-Ra2、G-Rb1、G-Rb2、G-Rb3、G-Rc、G-Rd、西洋参皂苷-R1(quinquenoside-R1,Q-R1)[6,10]以及相关的中间代谢产物,见图3。因此,G-C-K可能以较高的血药浓度出现在体循环中。生物活性研究表明,G-C-K能改善脑缺血再灌注损伤,具有抗炎活性,能够通过抑制肿瘤细胞的增殖、侵入和转移,促进肿瘤细胞凋亡及提高化疗药物对其敏感性,减轻其对正常细胞的毒副作用等途径而表现出良好的抗肿瘤作用[13]。这些结果一方面提示,红参中多样性化学结构的一些皂苷,在体内可代谢为同一代谢产物G-C-K,使其血药浓度提高,更好地发挥作用;另一方面提示能代谢为G-C-K的原形红参皂苷,可能是红参的质量标志物。G-C-K继续水解掉C-20的葡萄糖基,可代谢为20(S)-PPD[14],20(S)-PPD也是生物活性物质[13]。
在红参三醇型达玛烷三萜皂苷中,如G-Re、G-Rf、G-Rg1、G-Rg2、G-Rh1、三七皂苷(notoginsenoside)-R1和R2[6,10]等逐级水解掉糖基,代谢为PPT[14];C-20差向异构化,PPT存在20(S)-PPT和20(R)-PPT平衡形式,它们也是生物活性物质[13,15]。如果G-Re代谢脱去C-20位的葡萄糖基和C-6位糖链末端的鼠李糖基转化为G-Rh1[14],甚至代谢到PPT,则对细胞沉默调节蛋白1(silent information regulator two homolog 1,SIRT 1)激活作用增强[15],有利于红参发挥延缓人衰老的作用。
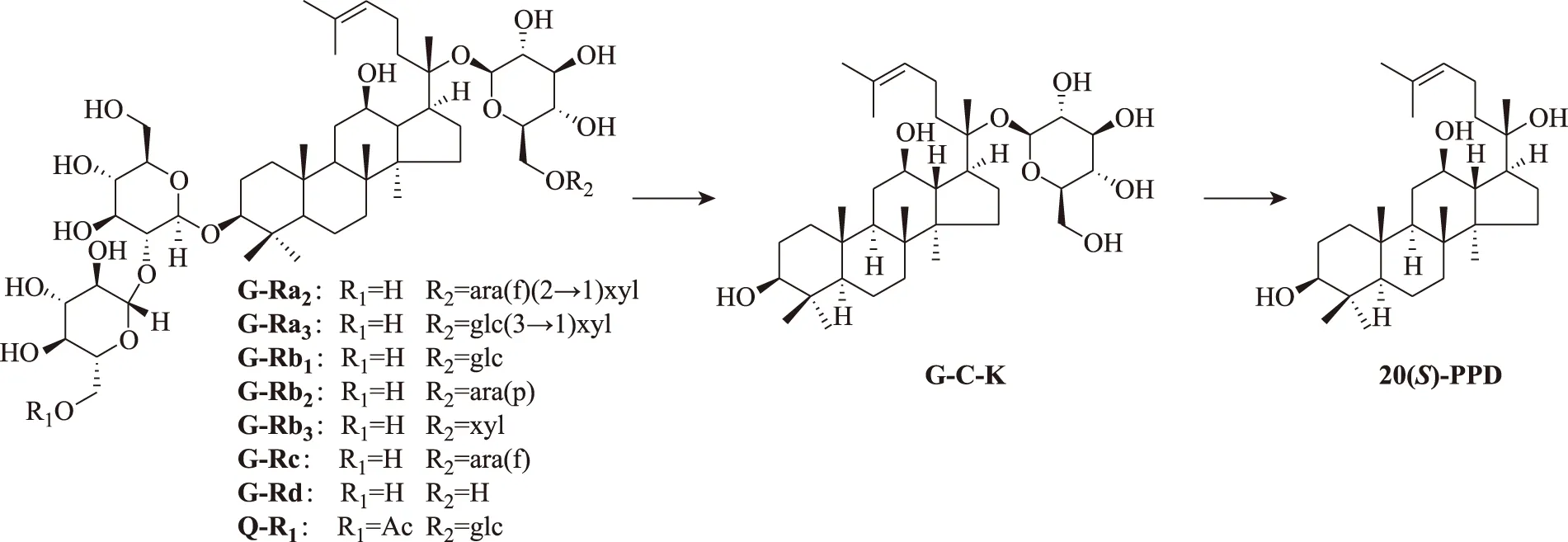
图3 红参中可能转化为G-C-K的皂苷
本研究结果证明,红参含有的某些人参皂苷类成分可在体内代谢转化为生物活性更强的物质,它们是前药(pro-drug)。
