合成气一步法制低碳烯烃OX-ZEO催化剂研究进展
2020-11-16王前进尚蕴山许德平邢爱华
王前进,尚蕴山,许德平*,邢爱华*
(1.中国矿业大学(北京)化学与环境工程学院,北京 100083;2.北京低碳清洁能源研究院,北京 100011)
低碳烯烃是石油化工行业的最基本原料。近年来,我国低碳烯烃的需求都在日益增长,而目前76%烯烃的产出都是通过石油路线[1],但是我国的能源格局是“富煤、贫油、少气”,并且石油对外依存度在逐年攀升,现已高达70%[2]。发展煤炭和生物质等非石油资源转化为合成气来制取低碳烯烃等化学工业原料具有重要战略意义和广阔发展前景。
合成气生产低碳烯烃有多步间接合成法和一步直接合成法两种工艺。多步法工艺是由合成气先生产甲醇和/或二甲醚,后者再转化生产低碳烯烃。该法目前已有多种成熟工艺用于工业生产,典型的有甲醇制低碳烯烃(MTO)和甲醇制丙烯(MTP)工艺。多步法制低碳烯烃,工艺流程长、投资大、能耗高,一定程度上提高了生产成本。一步法主要是合成气经由F-T合成直接制低碳烯烃,该法由于缩短了流程,有助于降低投资和生产成本,因此受到重视并进行了大量研究。但是,该法产物主要受ASF分布的限制,C2~C4烃类选择性不会超过58%,这阻碍了其工业化。
2016年中国科学院大连化物所包信和院士提出了“OX-ZEO”一步法制低碳烯烃新技术路线,其采用金属氧化物-分子筛复合催化剂。合成气在金属氧化物上反应生成乙烯酮等中间体,该中间体直接进入邻近的分子筛孔道,在分子筛的择形酸催化作用下生成低碳烯烃。该路线不受ASF分布的限制,C2=~C4=选择性可达到80%[3]。2019年9月,此技术路线在延长石油集团榆林能源化工公司进行千吨级工业试验,实现CO单程转化率超过50%,低碳烯烃(乙烯、丙烯和丁烯)选择性大于75%,取得圆满成功[4]。
1 不同OX-ZEO催化剂的制备方式
1.1 ZnCr体系金属氧化物的制备
Jiao等[3]首先采用共沉淀法制备ZnCrOx氧化物。将Zn/Cr/Al物质的量比为3.5/1/1的硝酸盐溶解在100 mL蒸馏水中,以(NH4)2CO3水溶液作为沉淀剂,在70℃共沉淀,然后在相同温度下老化3 h,过滤并用蒸馏水洗涤后将所得产品在110℃下干燥过夜,然后在500℃下煅烧1 h得到金属氧化物。MSAPO分子筛的制备是以n(SiO2):n(Al2O3):n(H3PO4):n(TEA):n(H2O)=0.48:1:1.6:3:50的比例将30%硅溶胶,82%AlOOH,85%磷酸和三乙胺(TEA)充分分散在去离子水中,然后将其放入衬有聚四氟乙烯的高压釜中,并在180~200℃的温度范围内保持12~28 h,离心洗涤使其pH达到7.0~7.5,然后在110℃下干燥12 h以上,在550℃下煅烧3 h。将制得的分子筛和金属氧化物以1:1的质量比均匀混合,压片-破碎到粒径大小为20~40目。在400℃,2.5 MPa,空速7714 mL/(h·gcat)的反应条件下,催化剂具有17%的CO转化率,80%的低碳烯烃选择性。碳氢化合物中的94%都是C2~C4烃,甲烷选择性在2%以下。
Su等[5]将物质的量比为1:3的Zn、Cr硝酸盐溶解,配制成金属离子为1 mol/L的混合溶液,(NH4)2CO3作为沉淀剂,配制成1 mol/L的溶液。在70℃下将两种溶液同时滴加到盛有20 mL去离子水的烧杯中。通过调节沉淀剂的滴加速度,将溶液pH控制在7.0~8.0。在70℃下老化2 h,过滤洗涤后,在80℃下干燥12 h,然后将样品置于马弗炉中以2℃/min速率升温到500℃,并煅烧5 h,所获得的二元氧化物即为ZnCrOx。催化剂中分子筛为低硅AlPO-18,其配方的物质的量的比为0.33 HCl:1.34 TEAOH:1.00 Al2O3:1.00 P2O5,将晶化浆液前驱体放入带聚氟四乙烯内胆的压力容器中,170℃加热72 h,过滤、洗涤、干燥,550℃焙烧4 h。分子筛与金属氧化物是分别压制破碎和筛分成20~40目,然后再均匀混合制成催化剂。对金属氧化物/分子筛的质量比为1的催化剂,在390 ℃,4 MPa,空速1200 mL/(h·gcat),n(H2)/n(CO)为1的反应条件下,CO转化率为25.2%,C2=~C4=选择性为45.0%(不计CO2时为86.7%),此外C2~C4产物中烯烷比为29.9。
1.2 ZnZr体系金属氧化物的制备
Liu等[6]通过溶胶-凝胶法合成掺杂Zn的ZrO2(表示为Zn-ZrO2)。将Zr(NO3)4·5H2O,Zn(NO3)2·6H2O和柠檬酸溶解在100 mL去离子水中,得到的混合物在90℃蒸发至获得粘性凝胶,然后加热至180℃保持3 h,再在500℃下煅烧5 h。获得的样品表示为Zn-ZrO2(m:n),其中m:n是Zn/Zr的物质的量之比。 当m:n为1:16时,与H+交换程度为45%的SSZ-13分子筛耦合制备的催化剂,在400 ℃,3 MPa,空速1800 mL/(h·gcat),n(H2)/n(CO)为2的反应条件下,CO转化率为23%,C2=~C4=选择性为75%。XRD表征结果表明,Zn的添加没有改变ZrO2的晶体结构,并且在m:n小于1:16时,没有观察到ZnO的衍射峰。
在CO2芳构化反应中制备了典型的ae-ZnO-ZrO2气凝胶[7,8],其制备方式是将Zr和Zn的硝酸盐溶解在75 mL去离子水和225 mL乙醇的混合物中。搅拌30 min后,将1.95 g甲酰胺和30.2 g 1,2-环氧丙烷加入混合物中。在室温下搅拌30 min后,将前体溶液在水浴中加热至70℃,进行2 h凝胶化。将湿凝胶与乙醇进行溶剂交换,然后在260℃下超临界干燥条件下保持1 h,以保持高孔隙率。干燥后的固体在500℃下煅烧4 h,所得催化剂即为ae-ZnO-ZrO2。虽然研究中该催化剂与分子筛复配用于CO2加氢一步合成芳烃,但通过调整复合所用的分子筛类型,应该也适用于合成气一步合成低碳烯烃。
1.3 ZnAl体系金属氧化物的制备
Ni等[9]制备了ZnAlOx与SAPO-34耦合的催化剂,ZnAlOx金属氧化物的制备方式是将硝酸锌和硝酸铝溶解在150 mL去离子水中,沉淀剂碳酸铵溶解在150 mL的去离子水中。将两溶液同时滴加到水浴温度为70℃的烧杯中开始沉淀,控制pH=7.1~7.3,再老化3 h。沉淀物洗涤数次,在100℃下干燥过夜,在500℃下煅烧4 h。耦合后的催化剂在390℃,4 MPa,空速12000 mL/(h·gcat),n(H2)/n(CO)为1的反应条件下,CO转化率约为10%,C2=~C4=选择性约为65%。
2 金属氧化物物化性质对催化剂性能的影响
2.1 氧化物粒径大小的影响
金属氧化物纳米颗粒越小,往往会有更多的氧空位[10-12],表现出更高的活性。钴、钌和铁金属催化剂在合成气化学过程中被广泛研究[10,11,13-16]。Carballo等[14]观察到当钌粒子的尺寸小于10 nm时,周转频率(TOFCO)增长,对于粒子尺寸大于10 nm的,则保持不变,小于10 nm钌粒子的活性可以归因于更强的CO吸附能力。Li等[17]通过单一的ZnO组分和SAPO-34分子筛耦合,用于合成气一步法制低碳烯烃,合成了一系列的15~82 nm的ZnO粒子,证明了CO转化率和低碳烯烃的选择性以及碳氢化合物的时空收率都随着ZnO粒子尺寸的减小而显著增加,主要是因为粒子粒径越小,其可利用的活性位点越多。研究还发现,较大的颗粒有利于烷烃的形成,而较小的颗粒有利于烯烃的形成。
2.2 氧空位的影响
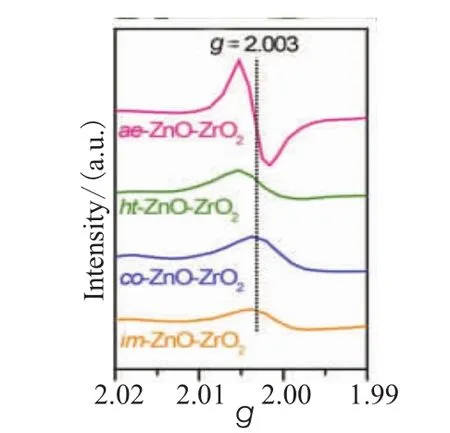
图1 不同方法制备的ZnO-ZrO2的EPR光谱[19]
据报道,部分还原的氧化物表面氧空位被认为是CO解离的活性位点[18,19]。Zhou等[19]在CO2芳构化的实验中,通过对不同方法制备的ZnO-ZrO2催化剂进行可见光辐照,结果如图1所示。这四种不同方法制备的ZnO-ZrO2混合氧化物使用X射线荧光光谱测试表明其组成非常相似,因此氧空位总量的差异应由不同的制备方式导致结构不同引起的。如图2所示,甲醇在ZnO-ZrO2催化剂上的生成速率几乎随着氧空位的总量线性增加,这表明氧空位的含量越多,催化剂的活性就越高。
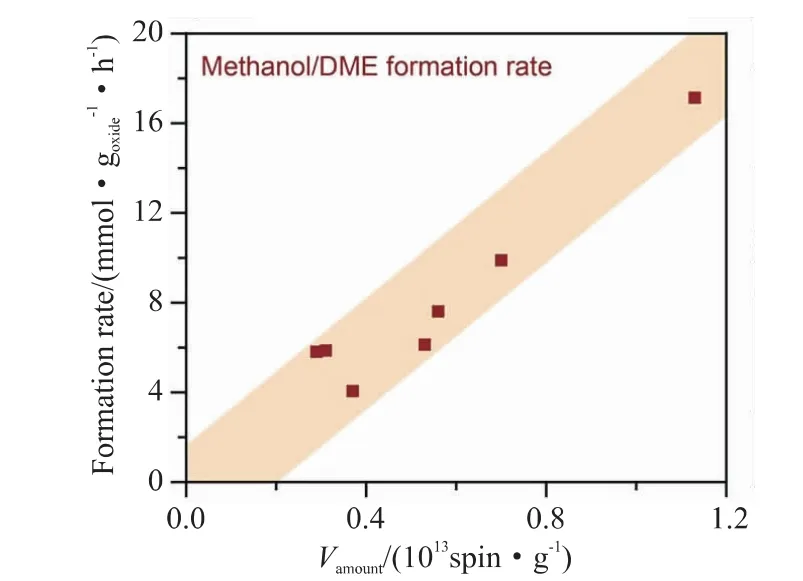
图2 不同制备方法和Zn/Zr比率的ZnO-ZrO2催化剂的CH3OH/DME生成速率取决于氧空位总量[19]
3 分子筛物化性能对催化性能的影响
合成气一步法制低碳烯烃所使用的双功能催化剂是由金属氧化物与分子筛两组分耦合而成。分子筛的主要作用是催化中间体转化为低碳烯烃,该催化过程是典型的酸催化和择形催化,分子筛的酸性以及孔道择形性是影响反应性能的主要因素。目前研究结果表明,SAPO-34、AlPO-18、SSZ-13分子筛等在一步法制低碳烯烃反应中表现出不同的反应特点。分子筛酸性质、孔道大小等物化参数显著影响产物分布。
分子筛的酸密度是影响产物分布的一个重要因素。Liu等[6]采用CHA拓扑结构的SSZ-13分子筛与掺杂Zn的ZrO2耦合,探究了分子筛酸性对催化性能的影响,结果发现随着B酸位点密度的增加,CO转化率从5%显著提高到约25%。当B酸位点密度较低时,双功能催化剂上主要产物是CH3OH/DME。当B酸位点密度升至0.10 mmol/g时,C2=~C4=的选择性达到75%,当B酸位点密度进一步增加,C2=~C4=的选择性逐渐降低,C2~C4烷烃选择性逐渐增加。因为B酸位点密度的增加,加大了氢转移反应,生成更多的烷烃。Cheng等[20]使用 ZnO-ZrO2与SAPO-34分子筛耦合,研究表明SAPO-34分子筛B酸位点密度是决定C2~C4烯烷比的关键因素,如图3所示,随着B酸位点密度增加,C2=~C4=的选择性逐渐降低。当B酸位点密度为0.21 mmol/g,CO转化率达到最高值为11%,C2=~C4=的选择性达到最大值74%。Jiao等[3]使用不同酸度的SAPO-34分子筛与ZnCrOx金属氧化物耦合,实验结果如图4所示,不同酸度的分子筛会导致C2~C4产物中烯烃与链烷烃选择性比的变化。使用几乎没有中等强度酸性位点的MSAPO与ZnCrOx耦合,结果表明该复合催化剂与纯ZnCrOx的催化剂具有相似的产物分布,上述研究表明,分子筛的酸密度在合成气一步法制低碳烯烃具有关键的作用,分子筛需要具有合适的酸密度,耦合催化剂才能更好地发挥催化作用。
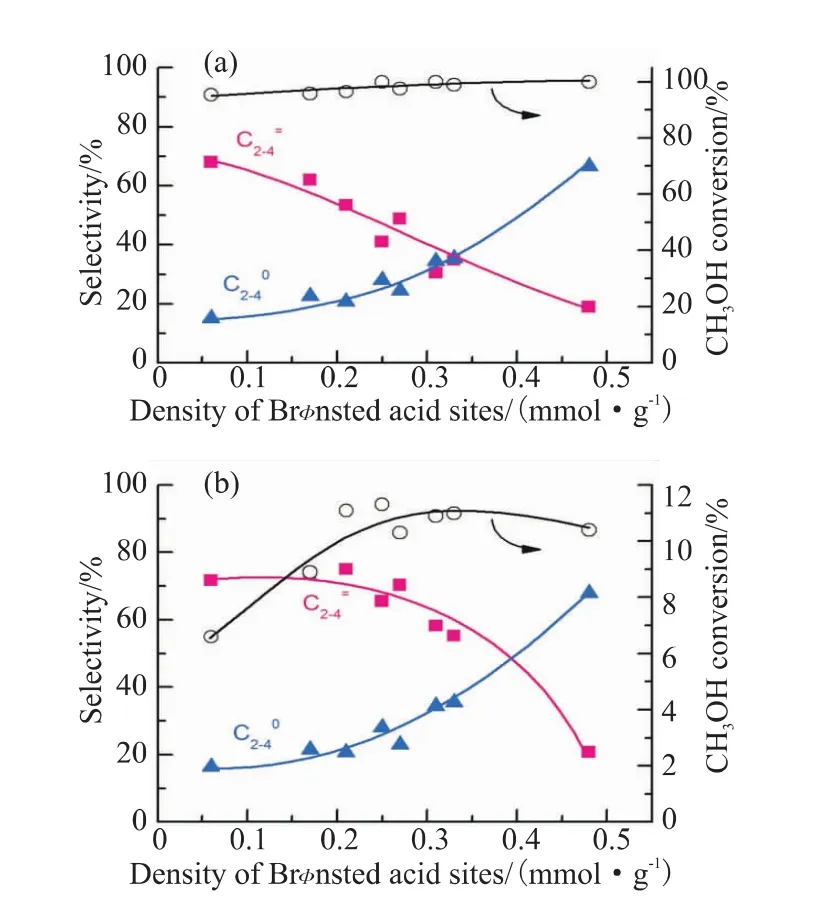
图3 B酸位点密度对CO、甲醇转化率和产物选择性的影响[20]
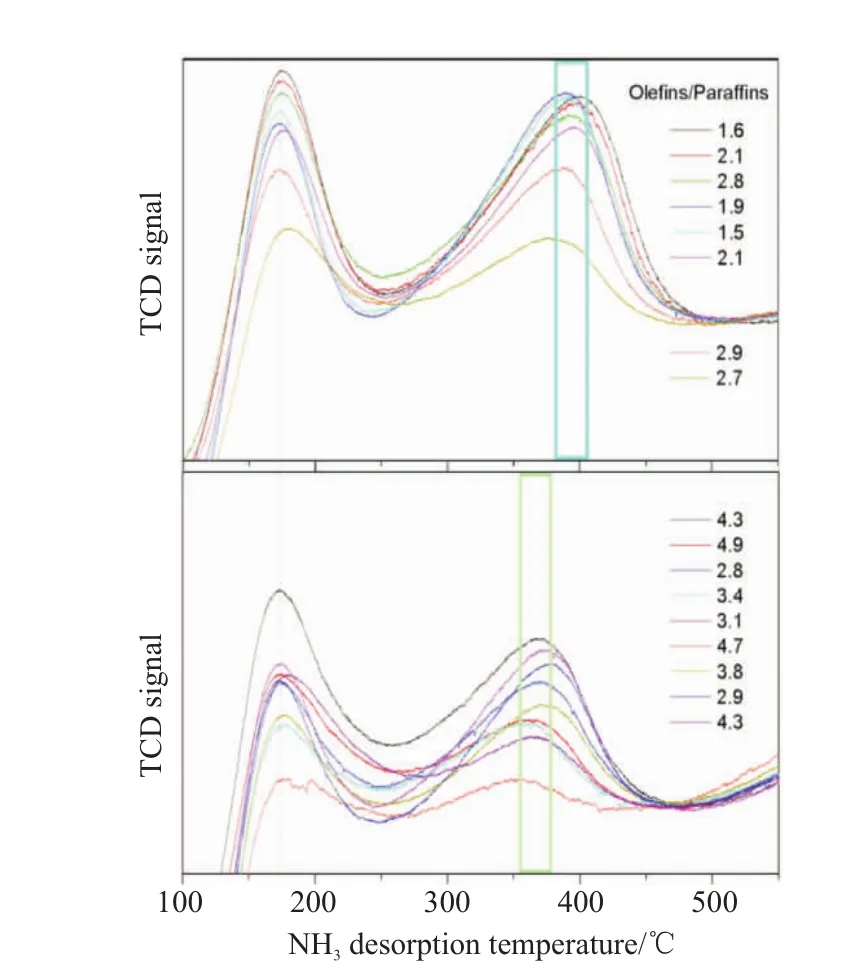
图4 不同酸度的分子筛对烯烷比的影响[3]
4 金属氧化物与分子筛复配形式的影响
4.1 金属氧化物与分子筛的质量比的影响
甲醇合成在热力学上是低温有利的反应,一般的反应温度为250℃左右,而甲醇转化制烯烃的反应需在约400~450℃下实施。利用在400℃下甲醇转化制烯烃反应是热力学上有利的,可以拉动甲醇合成反应,从而突破CO加氢制甲醇高温不利的热力学障碍[20]。当金属氧化物上生成中间体的量超出了分子筛最大的处理能力,则会出现反应中间体的累积,反应产物发生氢转移等二次反应,从而造成目标产物选择性降低,且严重时会造成催化剂失活;当金属氧化物上生成中间体的量低于分子筛最大的处理能力,则会出现部分分子筛未参与到反应中,造成催化能力的浪费。金属氧化物与分子筛需要有一个合适且匹配的比例。如图5所示,Jiao等[3]根据实验结果发现,CO转化率随着金属氧化物含量的逐渐增加出现了先增加后降低的趋势,C2=~C4=的选择性随着金属氧化物含量的逐渐增加出现了先增加后趋于稳定的趋势,该实验说明了金属氧化物与分子筛的质量比需要在一个合适的范围内,才能发挥最佳的催化性能。如图5所示,在该实验中,金属氧化物与分子筛的最佳质量比为1:1。
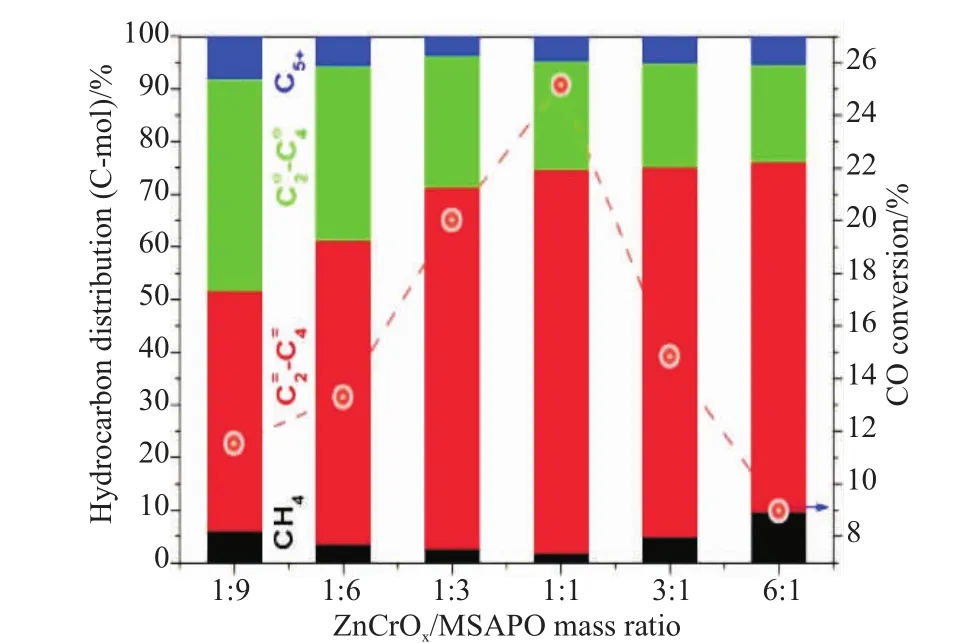
图5 金属氧化物与分子筛的质量比对产物分布和CO转化率的影响[3]
4.2 金属氧化物与分子筛混合方式的影响
金属氧化物与分子筛采用不同的混合方式,CO转化率和低碳烯烃产物的选择性都会不同。当金属氧化物与分子筛距离较远时,中间体不能及时地进入分子筛孔道而被“消耗”,分子筛的“拉动”效应弱化[21];另一方面,距离较远时,进入分子筛孔道的中间体形态也不同。Wei等[22]研究表明,当金属氧化物与分子筛距离较远时,生成的中间体CHxO会在扩散过程中加氢生成甲烷、甲醇,如果金属氧化物与分子筛相邻,生成的中间体为C1含氧化合物(CH2O、CH3OH),该中间体活性更高。Jiao等[3]将金属氧化物与分子筛以混合程度依次加深的四种模式混合,如图6所示,随着两组分混合程度的逐渐加深,C2~C4烃类的选择性从38%逐渐增长到94%;C2=~C4=的选择性从微量逐渐增长到80%;CH4的选择性从最初的53%逐渐降低到2%。该实验结果表明,当金属氧化物与分子筛这两组分的距离越小时,产物中C2=~C4=的选择性就越高。当金属氧化物与分子筛两组分的粒径相差较大时,也会影响产物的分布。
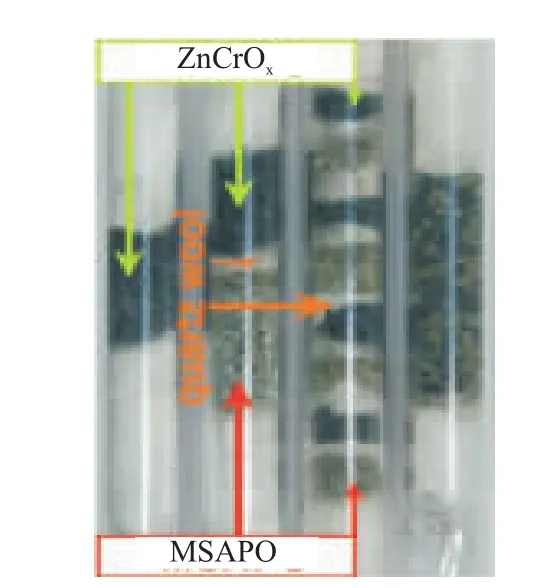
图6 金属氧化物与分子筛不同的耦合方式[3]
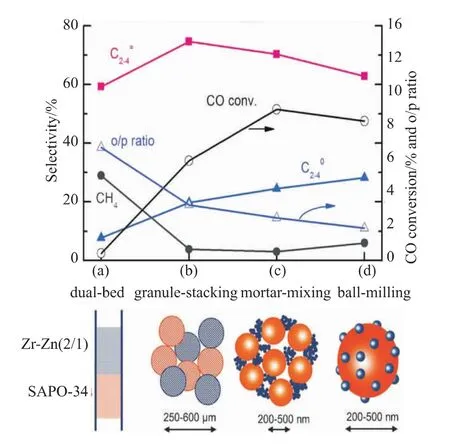
图7 金属氧化物与分子筛两组分的混合方式对CO转化率和产物选择性的影响[20]
Cheng等[20]也改变金属氧化物与分子筛两组分的混合方式,结果如图7(a)、(b)所示,随着两组分混合程度的加深,CO转化率逐渐增大,CH4选择性逐渐降低,C2=~C4=的选择性逐渐增大。当金属氧化物与分子筛的相对粒径大小逐渐增大时,结果如图7(c)、(d)所示,C2=~C4=的选择性逐渐下降,C2~C4烷烃的选择性逐渐增大,CO转化率也逐渐降低。该实验现象表明当金属氧化物的粒径远小于分子筛的粒径时,在分子筛表面更容易发生氢化反应,所以不利于提高低碳烯烃的选择性。
5 反应工艺参数的影响
5.1 H2/CO比的影响
在合成气的进料中,不同的H2/CO比会影响CO的转化率以及产物分布。Jiao等[3]改变了合成气的H2/CO的比,对CO转化率有较大的影响,如图8所示,n(H2)/n(CO)的比值从0.5增加到3,CO的转化率逐渐增长,当比值为3时,CO转化率为30%。Su等[5]在ZnCrOx耦合AlPO-18上研究发现,随着H2/CO比的增加,CO转化率逐渐增加,而H2的转化率明显降低,由于高浓度的H2可能会促进烯烃的氢化和逆向水煤气变换反应。一般最佳的n(H2)/n(CO)比值为2。

图8 H2/CO比对产物分布和CO转化率的影响[3]
5.2 反应压力的影响
提高反应压力,会增加分子间的碰撞,提高反应速率。Su等[5]在ZnCrOx耦合AlPO-18分子筛催化剂上研究反应压力对C2=~C4=选择性和CO转化率的影响,结果如图9所示,在390 ℃、n(H2)/n(CO)=1、GHSV=3600 mL/(h·gcat)的反应条件下,将压力从4 MPa增加到10 MPa时,CO转化率从25.2%明显提高到49.3%,而C2=~C4=的选择性仅从45.0%降低到43.3%。而Liu等[6]研究发现,当合成气压力在1 MPa时,CO转化率为10%,C2=~C4=的选择性为87%,C2~C4烯烷比为9.4;随着反应压力的增加,CO转化率显著增加,C2=~C4=的选择性降低 (如图10所示),当合成气压力在4 MPa时,CO转化率为~28%,C2=~C4=的选择性为~62%,C2~C4烯烷比为~1.3,甲烷选择性也随着反应压力的增加而增加,该实验结果表明氢化能力和CO转化率都是随着反应压力的提高而提高。因此,存在将合成气转化为低碳烯烃的最佳反应压力。
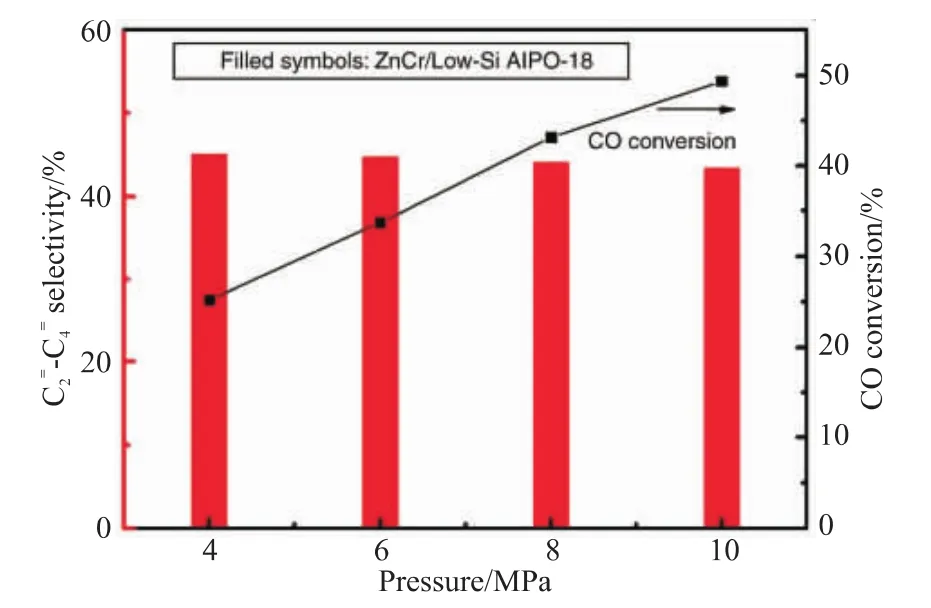
图9 反应压力对C2=~C4=选择性和CO转化率的影响[5]
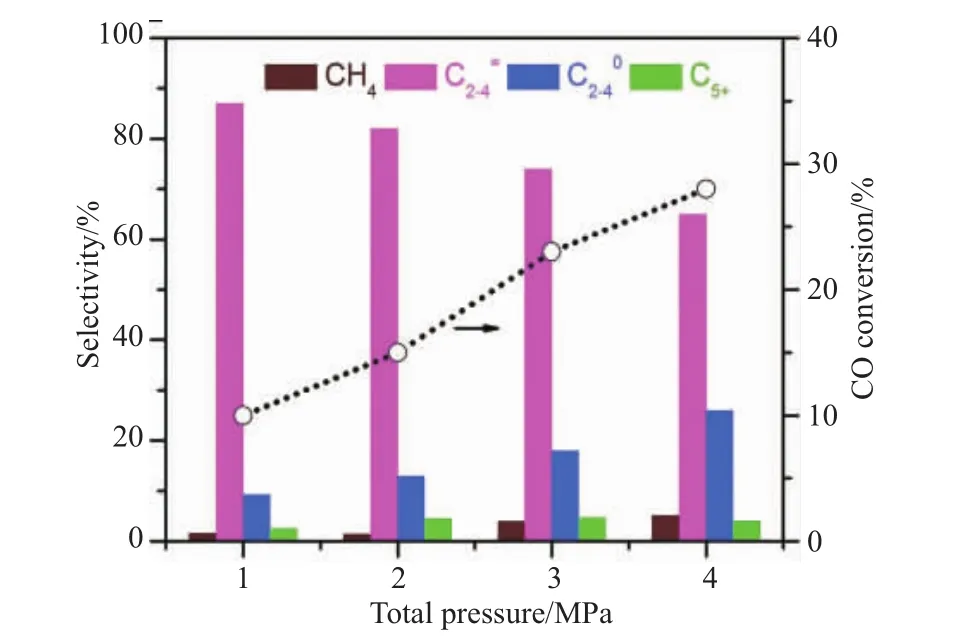
图10 反应压力对产物选择性和CO转化率的影响[6]
5.3 反应温度的影响
对于吸热反应,提高反应温度会提高反应速率,对于放热反应则相反。在合成气通过OX-ZEO路线制低碳烯烃的反应中,CO加氢反应生成中间体是放热反应,而中间体转化为低碳烯烃的反应则是吸热反应。 Raveendra等[23]在2%Zr-Zn/Al2O3-SAPO-34催化剂上研究温度的影响。结果如图11所示。在m(OX)/m(ZEO)为1:1、n(H2)/n(CO)为2、反应时间为5 h时:当反应温度为350℃时,CO的转化率仅为3.32%,C2=~C4=选择性为80%;当反应温度为400℃时,CO的转化率增加至8.25%,C2=~C4=的选择性降低至68.84%;反应温度进一步提高到450℃,CO的转化率增加至11.71%,但C2=~C4=选择性却明显降低至30.57%,该温度下主要产物为CH4和链烷烃。在低于400℃的反应温度下,CO的转化率较低,但对低碳烯烃的选择性较高,而较高的反应温度往往有利于CO转化,但不利于低碳烯烃的选择性。
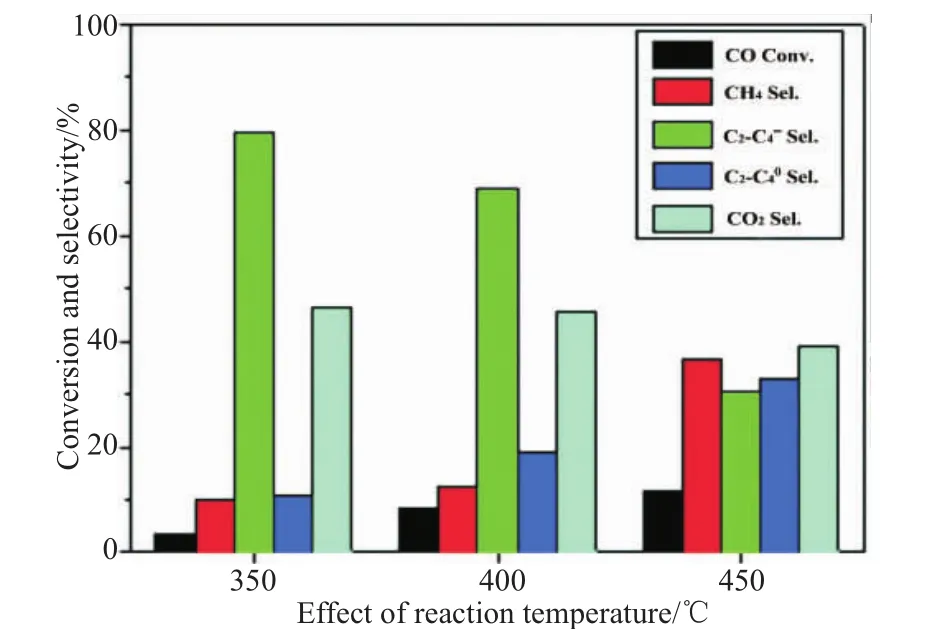
图11 反应温度对产物分布、CO转化率和C2=~C4=选择性的影响[23]
5.4 反应空速(GHSV)影响
反应空速关系到反应物在催化剂上的停留时间,较长停留时间有利于合成气的转化,但是过长的停留时间一方面会减少反应物进入系统中的量,另一方面,对产物选择性也会产生影响。最终影响目标产物的收率。Su等[5]在ZnCrOx耦合AlPO-18分子筛催化剂上研究了空速对反应的影响,从图12可以看出,随着GHSV的降低,ZnCrOx/Low-SiAlPO-18和ZnCrOx/SAPO-34催化剂的CO转化率均增加,而C2=~C4=的选择性逐渐降低。Liu等[6]发现在较短的接触时间下 (接触时间低于0.8 (s·g)/mL,Zn-ZrO2/SSZ-13-45H催化剂上主要产物为CH3OH和DME。如图13所示,接触时间的增加显著提高了C2=~C4=的选择性,当接触时间超过1.2(s·g)/mL时,由于烯烃的加氢作用,C2=~C4=的选择性下降,C2~C4烷烃选择性显著增加。该实验说明接触时间也不宜过长,否则会导致低碳烯烃等产物更容易被氢化。在确定反应空速时,要选择在合适的范围内。

图12 GHSV对C2=~C4=选择性和CO转化率的影响[5]
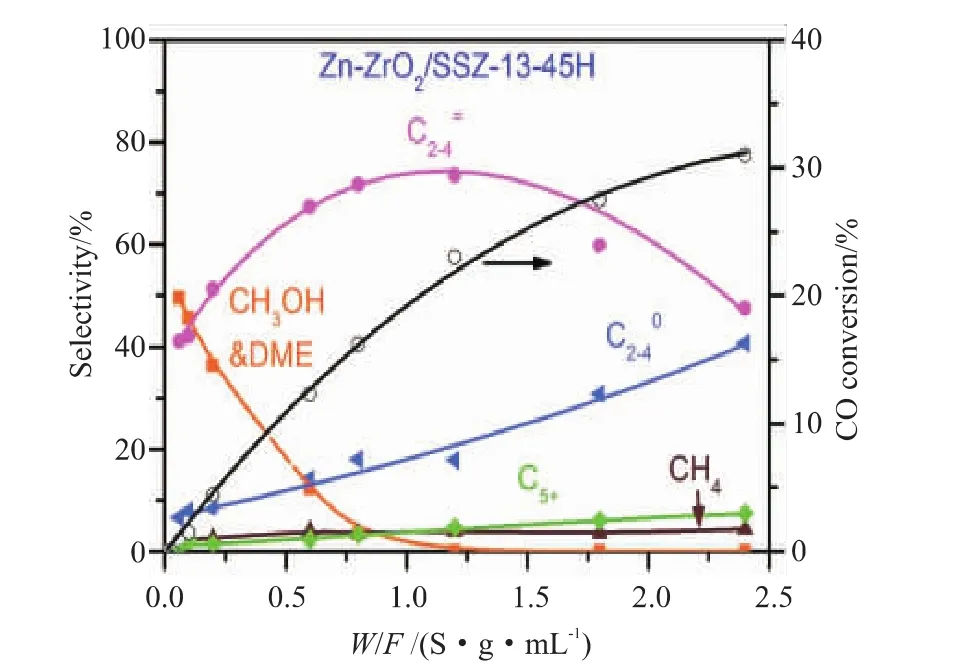
图13 产物选择性和CO转化率与接触时间的关系[6]
6 结语
合成气一步法制低碳烯烃是避开传统的石油路线生产低碳烯烃的新途径,可有效减缓可能会出现的石油危机。由于该路线具有流程短,能耗低等特点,符合未来工业化发展方向,所以越来越受到研究人员的关注。针对双功能催化路线(OX-ZEO体系),为了保证中间体在分子筛孔道内发生反应生成低碳烯烃,不仅要求金属氧化物和分子筛在一定的反应条件下具有很好的协同作用,而且,也要求两组分具有优良的催化性能和稳定性。该路线目前的挑战是:(1)反应的时空收率低,需要装填大量的催化剂;(2)反应中原料气转化不完全,需要将尾气中未参与反应的原料气进行循环,尾气还需要分离烯烃和烷烃,同碳数的烃类分离成本偏高;(3)反应的热效应影响大,进行工业化生产需要解决热效应的影响。所以,合成气经OX-ZEO催化剂制低碳烯烃的工业化尚有大量的工作需要进行。
