优化解题策略 高效突破原电池选择题
2020-11-16江西张万程
江西 张万程
纵观历年高考真题,电化学选择题在高考中考查频次较高,其中尤以原电池的考查最为常见。由试题呈现的信息可看出,高考化学试题逐渐向真实情境的方向发展,呈现新技术、新科研成果,在考查必备知识的同时,精心设问,凸显综合素质的考查,渗透对化学学科核心素养的考查,充分体现高考命题的要求。笔者总结了电化学考题中涉及原电池的常见角度,优化解答此类问题的策略,并归纳高考命题的方向,以期对师生的一轮复习有所帮助。
一、原电池知识体系

二、原电池优化解题策略
原电池在高考中的考查知识点主要有:正负极的判断、电子或离子的移动方向、电极反应式、电化学计算等,其中尤其以电极反应式的考查最为常见,几乎每道试题均有涉及,该考查点区分度高,对学生分析问题、解决问题的能力要求较高,较多学生在解决该类问题时,常常会陷入困境,无从下手。

根据题意,从氧化还原反应角度分析电池的总反应式,注意遵循守恒原则,列出表格,理清思路,能正确分析出电极反应式,原电池试题基本上迎刃而解。对于二次电池与燃料电池,应需要从以下角度进行分析。


三、真题全景赏析
1.金属-空气电池

试题电池装置图电极反应式2016·浙江卷·11正极:O2+4e-+2H2O4OH-负极:M-ne-+nOH-M(OH)n

续表
2.金属-CO2电池

试题电池装置图电极反应式2018·全国卷Ⅱ·12正极:3CO2+4e-2CO2-3+C负极:Na-e-Na+2018·天津卷·10(3)正极:6O2+6e-6O-2、6CO2+6O-23C2O2-4+6O2负极:Al-3e-Al3+
3.(微)生物燃料电池

试题电池装置图电极反应式2019·全国卷Ⅰ·12正极:MV2++e-MV+、N2+6MV++6H+2NH3+6MV2+负极:MV+-e-MV2+、H2+2MV2+2MV++2H+2015·全国卷Ⅰ·11正极:O2+4e-+4H+2H2O负极:C6H12O6+6H2O-24e-6CO2+24H+
4.其他电池

试题电池装置图电极反应式2018·浙江卷·10正极:2H++2e-H2↑负极:H2-2e-+2OH-2H2O2017·全国卷Ⅲ·11正极:S8+2e-+2Li+Li2S8、3Li2S8+2e-+2Li+4Li2S62Li2S6+2e-+2Li+3Li2S4、Li2S4+2e-+2Li+2Li2S2负极:Li-e-Li+2015·江苏卷·10正极:O2+4e-+2CO22CO2-3负极:H2-2e-+CO2-3H2O+CO2、CO-2e-+CO2-32CO2
5.锌系电池
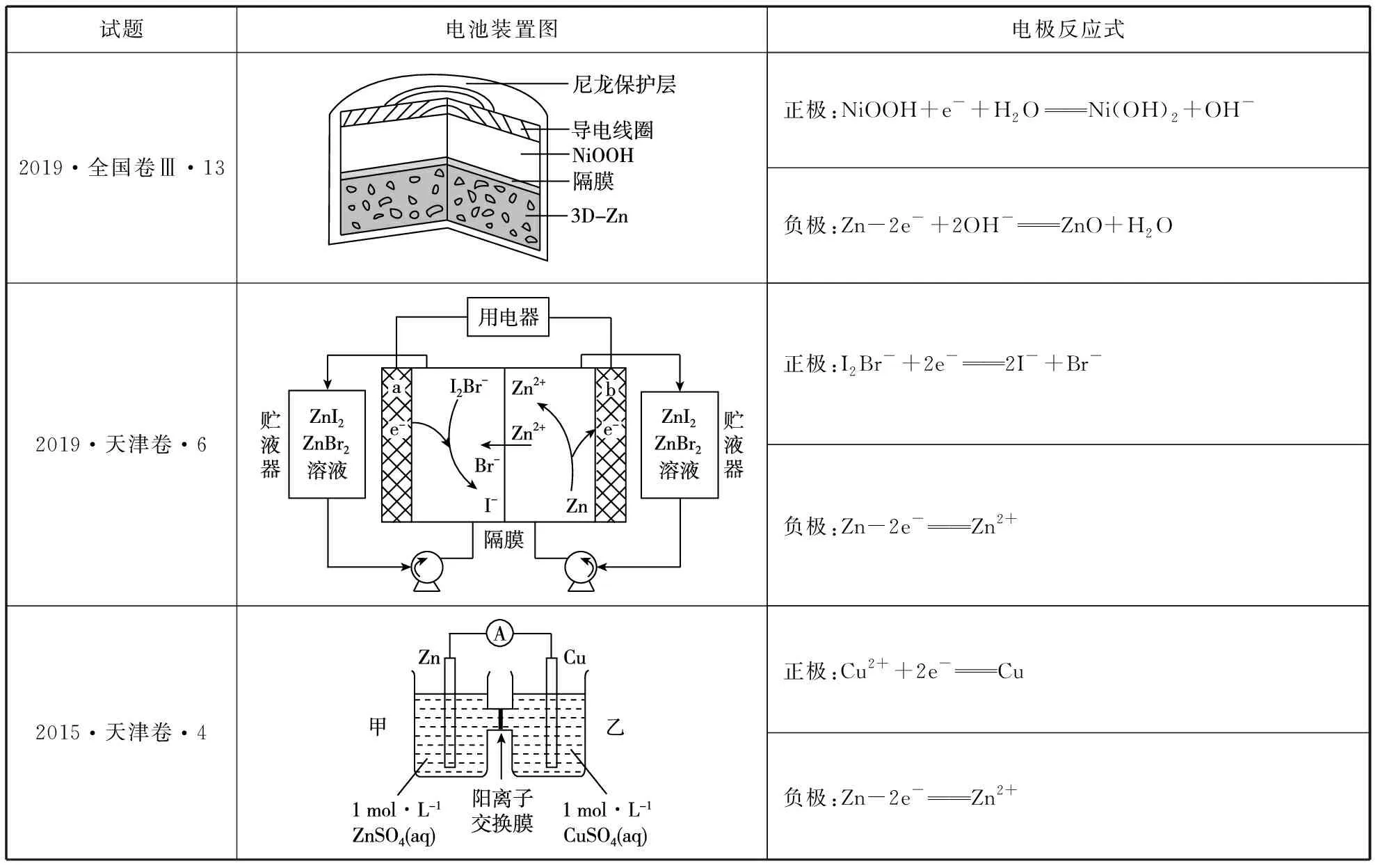
试题电池装置图电极反应式2019·全国卷Ⅲ·13正极:NiOOH+e-+H2ONi(OH)2+OH-负极:Zn-2e-+2OH-ZnO+H2O2019·天津卷·6正极:I2Br-+2e-2I-+Br-负极:Zn-2e-Zn2+2015·天津卷·4正极:Cu2++2e-Cu负极:Zn-2e-Zn2+
四、真题优化解题例析
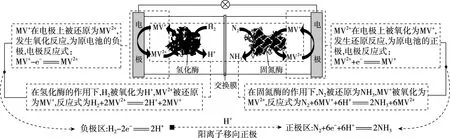
【例1】(2019·全国卷Ⅰ·12)利用生物燃料电池原理研究室温下氨的合成,电池工作时MV2+/MV+在电极与酶之间传递电子,示意图如下所示。下列说法错误的是
( )

A.相比现有工业合成氨,该方法条件温和,同时还可提供电能

C.正极区,固氮酶为催化剂,N2发生还原反应生成NH3
D.电池工作时质子通过交换膜由负极区向正极区移动
【答案】B
【优化解题】试题中未给出总反应式,可从题图中各电极区的转化关系进行分析,写出电极反应式。

【例2】(2019·天津卷·6)我国科学家研制了一种新型的高比能量锌-碘溴液流电池,其工作原理示意如图。图中贮液器可储存电解质溶液,提高电池的容量。下列叙述不正确的是
( )
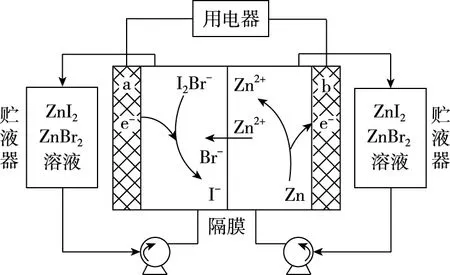

B.放电时,溶液中离子的数目增大
C.充电时,b电极每增重0.65 g,溶液中有0.02 mol I-被氧化
D.充电时,a电极接外电源负极
【答案】D
【优化解题】试题中未给出总反应式,可从题图中Zn2+的移动方向进行分析,写出电极反应式。



( )
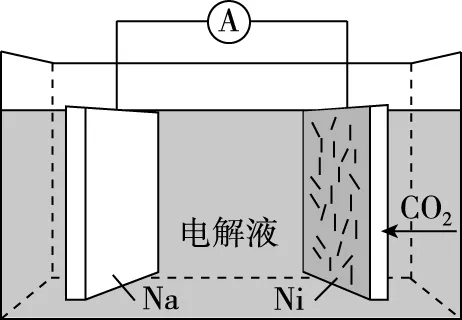
B.充电时释放CO2,放电时吸收CO2

【答案】D
【优化解题】由工作原理图可以看出,电池由CO2、负载碳纳米管的镍网、金属钠、溶于有机溶剂的NaClO4电解质构成,Na元素只有0价和+1价,Na在作电极时只能失去电子,作原电池的负极。根据所给出的总反应式进行氧化还原反应分析。

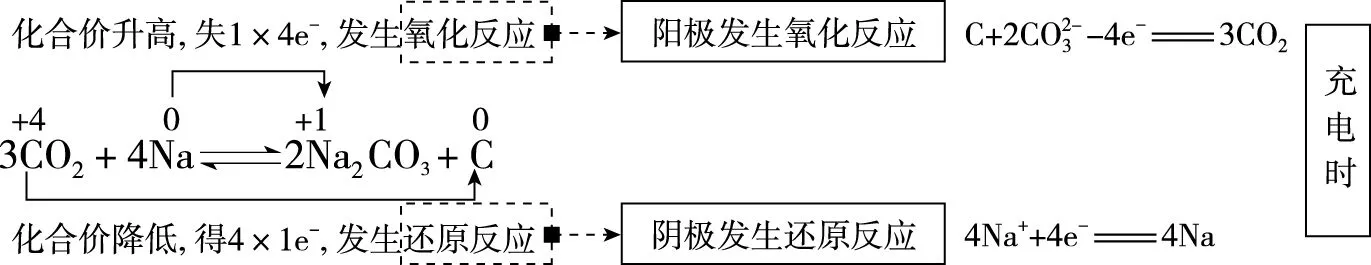
根据题意,“可呼吸”的Na-CO2二次电池,即在放电时吸收CO2,在充电时释放CO2,C-CO2为原电池的正极,也是充电时的阳极,Na-Na+为原电池的负极,也是充电时的阴极。综上可知,D项错误。
五、高考考查新热点——锂离子电池
锂离子电池仅在早年高考题中出现过,且次数较少,2016年四川卷考查过电动汽车中配载的一种可充放电的锂离子电池,2014年天津卷将锂离子电池和锂硫电池结合起来进行考查。但由于2019年诺贝尔化学奖授予锂离子电池的发明者,故在模考题中锂离子电池前所未有的“热”了起来。锂离子电池放电时,镶嵌在石墨上的Li失去电子,进入电解液,电解液内的Li+移向Li1-xMyOz,Li1-xMyOz中的M得到电子,与Li+结合成LiMyOz,充电过程与之相反。常见的锂离子电池的电极材料及放电时电极反应式可总结如下:

电极材料电极反应正极LiMO2(M:Co、Ni、Fe)LiM2O4(M:Co、Ni、Fe)LiMPO4(M:Fe)Li(1-x)MO2+xLi++xe-LiMO2Li(1-x)M2O4+xLi++xe-LiM2O4Li(1-x)MPO4+xLi++xe-xLiMPO4负极石墨(吸附Li+)LixCn-xe-xLi++nC
下面以一道模考题为例进行说明。

( )


A.放电时,电子由铝箔沿导线流向铜箔

C.磷酸铁锂锂离子电池充放电过程通过Li+迁移实现,C、Fe、P元素化合价均不发生变化
D.用该电池电解精炼铜,若电流强度I=3.0 A,工作15分钟后得到铜0.64 g,则电流利用效率约为71.5%
【答案】C
【优化解题】根据图示及充电时阳极的电极反应式进行如下分析:

放电时总反应式LixC6+FePO4xLiFePO4+(1-x)FePO4+C6正极FePO4+xLi++xe-xLiFePO4+(1-x)FePO4负极LixC6-xe-xLi++C6

六、结束语

