例析多因素影响下的速率与平衡图表型试题
2020-11-16浙江吴朝辉
浙江 吴朝辉
一个化学反应的速率或平衡可能同时受多个外界因素,如温度、浓度、压强的影响,而且这些因素的影响因素有主有次,随着反应进行,主要的影响因素可能会变换。与单个因素影响下的问题相比,可产生更复杂、更接近实际的问题情境。因此,多因素影响下的速率与平衡问题能很好地考查学生的逻辑思维,已成为高考试题的一个热点。
图表可以隐蔽关键信息,能有效考查学生信息处理能力、提取有效信息的抗干扰能力、提取关键信息的精准性以及将陌生信息与已学知识的有效整合能力。因此图表类试题备受高考命题专家的青睐,几乎已到了“无图表不成卷”的程度,当多因素影响的速率与平衡问题和图表结合时,会产生别样的精彩。
1.温度与浓度的双重影响
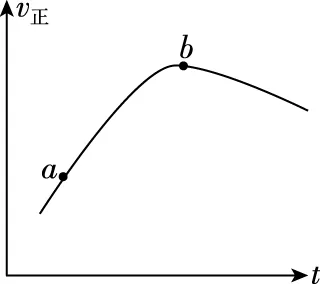

【答案】反应放热,在绝热容器中反应使温度升高,v正增加。b点后,温度上升已不明显,反应物浓度降低导致v正减小
【解析】反应启动后,反应物浓度就逐渐减小,v正逐渐减小,与b点后的曲线趋势相符,所以b点后v正逐渐减小是受反应物浓度影响所致。
那开始时v正为何会逐渐增大?影响正反应速率的因素主要有温度、压强、催化剂、接触面积等。首先,没有压缩容器,排除压强影响。其次,没有加入催化剂,故排除催化剂,另外如果是自催化反应,则速率-时间图象有其独特之处,详见本文例5。第三,反应物全部是气体,也排除接触面积的影响。所以造成反应速率增大的最可能的因素是温度,与题给的“绝热容器”呼应。由于反应放热,在绝热容器中体系温度升高,正反应速率增加。b点后,温度上升已不明显,但此时反应物浓度降低升级为矛盾的主要方面,造成b点后正反应速率减小。
【拓展】如读到“绝热容器”,一定要注意反应自身的热效应对反应速率及平衡的影响。
2.原电池效应与接触面积的双重影响
【例2】(5)为了研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验。将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间。
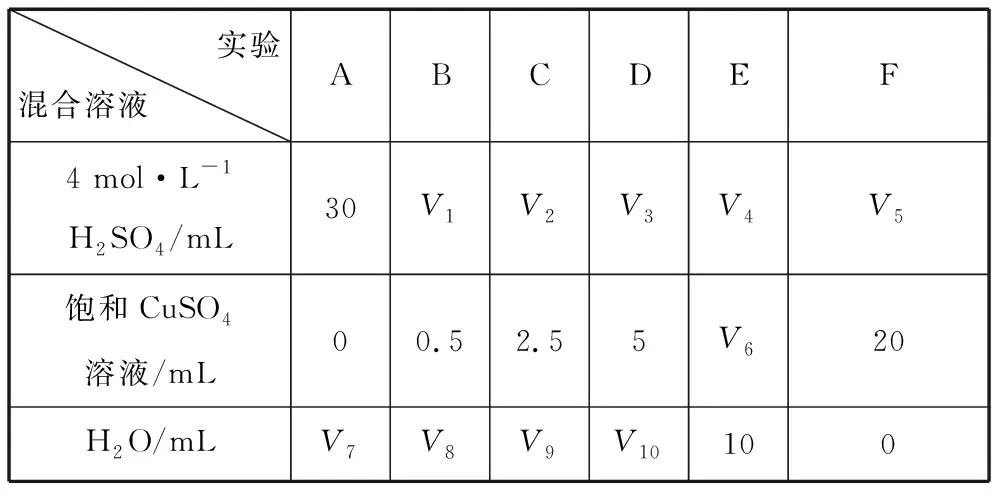
实验混合溶液 ABCDEF4 mol·L-1H2SO4/mL30V1V2V3V4V5饱和CuSO4溶液/mL00.52.55V620H2O/mLV7V8V9V10100
该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高。但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降。请分析氢气生成速率下降的主要原因:________________。
【答案】V1~V5均为30,V6=10,V7=20,V8=19.5,V9=17.5,V1=15。当加入一定量的CuSO4后,生成的Cu沉积在Zn的表面,降低了Zn与溶液的接触面积
【解析】实验探究目的是“硫酸铜的量对氢气生成速率的影响”,故硫酸铜的量应是唯一变量,所以表中的V6=10,V1~V5均为30。再用水调节液体的总体积相等。
单质Cu沉积在Zn粒表面形成原电池,原电池效应加快了氢气的生成速率。CuSO4溶液超过一定量后,氢气的生成速率为什么会降低?应该是逐渐增加的Cu将Zn粒包裹的越来越严实,降低了Zn与硫酸的接触面积,从而降低H2的生成速率。
【拓展】类似情境如石灰石与稀硫酸的反应:微溶性的CaSO4覆盖在石灰石表面,阻碍反应的顺利进行。
3.温度与副反应的双重影响
【例3】(2018·北京卷·26节选)(4)H2O2将粗磷酸中的有机碳氧化为CO2脱除,同时自身也会发生分解。相同投料比、相同反应时间,不同温度下的有机碳脱除率如图所示。80℃后脱除率变化的原因:________________。
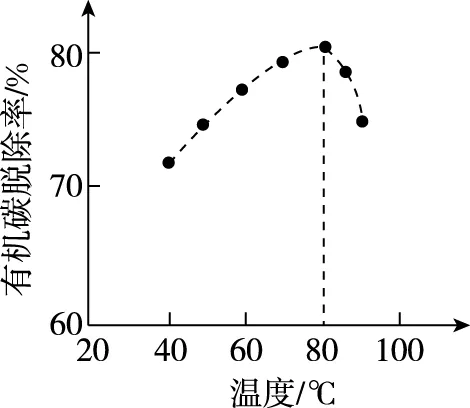
【答案】80℃后,H2O2分解速率大,浓度显著降低,造成碳脱除率下降
【解析】温度升高,H2O2与有机碳反应速率加快,相同时间内脱除的碳增多,与图中20℃~80℃时的曲线上升趋势相符。
80℃后脱除率为什么会下降?结合题给信息“自身也会发生分解”可知:80℃后,H2O2分解速率增大,自身分解由次因变成了主因,造成脱除反应速率下降,脱除率下降。
【拓展】温度升高引发潜在的副反应,类似命题情境的试题在高考中并不鲜见。主要有原料不稳定,如本题的H2O2,或原料中有气体,温度升高导致气体溶解度下降等情形。
4.浓度与催化剂活性的双重影响
【例4】(2017·全国卷Ⅱ·27节选)丁烯是一种重要的化工原料,可由丁烷催化脱氢制备。回答下列问题:

(2)丁烷和氢气的混合气体以一定流速通过填充有催化剂的反应器(氢气的作用是活化催化剂),出口气中含有丁烯、丁烷、氢气等。如图为丁烯产率与进料气中n(氢气)/n(丁烷)的关系。图中曲线呈现先升高后降低的变化趋势,其原因是________________。
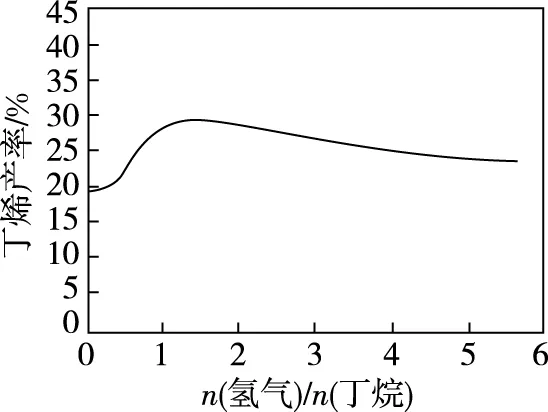
【答案】随着n(H2)/n(丁烷)增大,催化剂活性提高,反应速率增加,相同时间生成的丁烯增加。但随着n(氢气)/n(丁烷)增大,平衡逆向移动,造成丁烯产率下降。
【解析】因H2能活化催化剂,随着n(H2)/n(丁烷)增大,催化剂活性提高,反应速率增加,相同时间生成丁烯的量增加,所以丁烯产率增大,此即“丁烯产率升高”的主要原因。
曲线最高点是丁烷分解反应达到了平衡状态。此时n(H2)/n(丁烷)继续增大,H2作为生成物,其浓度对平衡的影响由次因上升成了主因,导致丁烯的产率逐渐减小。
【例5】如图表示10 mL 0.01 mol·L-1KMnO4酸性溶液与过量的0.1 mol·L-1H2C2O4溶液混合时n(Mn2+)随时间的变化,表述与示意图是否一致?
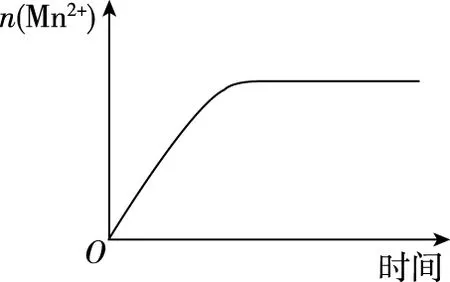
【答案】
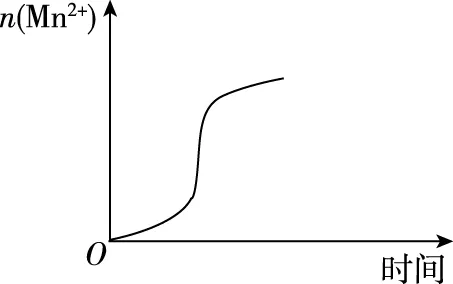
【解析】KMnO4与H2C2O4的反应是一个自催化反应,产物Mn2+对反应有催化作用。但Mn2+需累积到一定浓度才能产生催化作用。
开始时,c(Mn2+)很小,催化作用较弱,故生成Mn2+速率很小。当Mn2+积累到可起催化作用时,Mn2+生成速率迅速增大。反应后期,反应物浓度减小成为影响速率的主要因素,速率逐渐减小。所以n(Mn2+)随时间变化曲线如答案所示。
5.速率与平衡的双重影响


【答案】T1~T2区间,化学反应未达到平衡,温度越高,化学反应速率越快,所以CO2被捕获的量随温度升高而提高。T4~T5区间,化学反应已达到平衡,由于正反应是放热反应,温度升高平衡逆反应方向移动,所以不利于CO2捕获
【解析】随着温度升高,捕获CO2的平衡向左移动,CO2的平衡浓度逐渐增大,T3后的曲线与之相符。所以T4~T5区间,CO2浓度上升是因为温度升高平衡逆向移动的缘故。
在T3前CO2浓度为什么会减小?结合题给关键信息“经相同时间”,可知随着温度升高,反应速率逐渐增大,相同时间内参与反应的CO2逐渐增加,故剩余CO2逐渐减小。
【拓展】这种图象可称为“速率—平衡”型:前半段是受速率控制,后半段受平衡控制。这种题型表面上只涉及温度一个因素,但都隐含重要的时间信息——相同反应时间。前文例4也可归属此类。这种类型是考查影响因素的重要题型之一,必须重点关注。
6.生成与消耗的双重影响
【例7】(2017·北京卷·27节选)(2)②用H2模拟尾气中还原性气体研究了Ba(NO3)2的催化还原过程,该过程分两步进行,下图表示该过程相关物质浓度随时间的变化关系。第一步反应消耗的H2与Ba(NO3)2的物质的量之比是________。
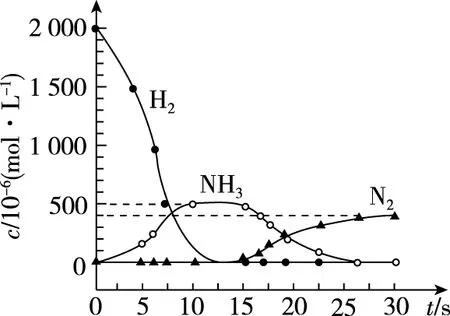
【答案】8∶1
【解析】要计算H2与Ba(NO3)2的物质的量之比,就必须确定反应产物。由图可知,H2逐渐减少时,NH3逐渐增加,且当H2为0时,NH3达到最大值。而在此过程中,N2一直保持在0,所以H2与Ba(NO3)2作用生成NH3,据电子守恒可得n(H2)∶n[Ba(NO3)2]=8∶1。
【拓展】反应中间体的含量一般先增加后减少:在前一步中生成而累积,浓度逐渐增大;在后一步反应中消耗,浓度逐渐减小。
7.多种因素的综合影响
近年高考试题又出现一种将更多因素融合在一起的命题趋势。
【例8】(2018·江苏卷·20节选)(2)②在有氧条件下,新型催化剂M能催化NH3与NOx反应生成N2。反应相同时间NOx的去除率随反应温度的变化曲线如图所示,在50~250℃范围内随着温度的升高,NOx的去除率先迅速上升后上升缓慢的主要原因是________________;
当反应温度高于380℃时,NOx的去除率迅速下降的原因可能是________________。

【答案】迅速上升段是催化剂活性随温度升高而增大,与温度升高共同使NOx去除反应速率迅速增大;上升缓慢段主要是温度升高引起的NOx去除反应速率增大,催化剂活性下降、NH3与O2反应生成了NO
【解析】50~250℃范围内,温度升高,反应速率加快,同时催化剂活性增大,反应速率也加快,双重有利因素叠加下,反应速率迅速上升。当催化剂活性达到最佳后,反应速率受温度的影响继续缓慢上升。所以NO去除率先迅速上升后缓慢上升。
高于380℃时,①催化剂活性下降;②NH3与O2可能发生副反应生成NO;③化学平衡向吸热方向移动,三因素叠加后,NOx去除率迅速下降。
8.归纳
多因素影响下的速率与平衡图表型问题,审题时要重点关注图中曲线的趋势。如果曲线不是单调上升或单调下降时,就应该注意试题可能要考查多种因素对速率与平衡的影响。
解题时,可按以下步骤确定或“明”或“暗”的影响因素。首先,根据图象横坐标找到“明”因。如果横坐标是“时间”,则“明”因一般是浓度。其次,根据平衡移动原理分析“明”因对反应的影响,确定与曲线的哪部分趋势相符。最后,根据曲线另一部分趋势,在平衡移动原理的指引下,依据题意从温度、浓度等影响因素中排查找出“暗”因。
在分析问题时,一定要十分重视温度这个影响因素。它既可以是“明”因,温度变化引起其他因素的连锁变化:温度升高,会引发副反应,可能会影响到催化剂活性,会带来速率和平衡双控制的问题等等。温度也可能是“暗”因,反应自身的热效应引起体系温度变化,与浓度一起形成双因素效应,如例1。

