非金属元素及其化合物的知识建构策略——以氮元素及其化合物的复习为例
2020-11-16河南熊建飞吴利敏
河南 熊建飞 吴利敏
在氮元素及其化合物的复习中,以氮元素化合价为中心,须贯穿氧化还原反应、物质分类两个观念,从氧化还原反应的角度分析各物质间的转化关系,从物质分类的角度,利用同类物质的共性进行类比分析,然后再同中求异,分析特殊性。
建构主义学习理论认为,学习是学生在一定的情景中,借助教师或学习伙伴的帮助,利用必要的学习资料,通过意义建构的方式获得知识的过程。教学不仅是知识的传递,也是知识的处理和转换,教师要引导学生从原有的知识经验中,生出新的知识经验。本文拟引导学生用已有的知识对非金属元素及其化合物进行知识建构,以氮元素及其化合物的复习为例,帮助学生建立起一种有效的学习方法。根据非金属元素及其化合物的特点,提出了“一中心两观念”的建构策略。
一、以化合价为中心,构建关系图
绘制类—价二维坐标图,以氮元素化合价为纵坐标,以物质类别为横坐标。引导学生在相应的位置上写出物质的化学式,根据所掌握的知识,用箭头标出各物质之间的转化关系。通过坐标图,可以清晰地看到规律:从最低价的氢化物(NH3)到最高价的含氧酸(HNO3),化合价呈逐渐上升趋势,让学生从整体上对氮元素及其化合物有一个感性的认识。
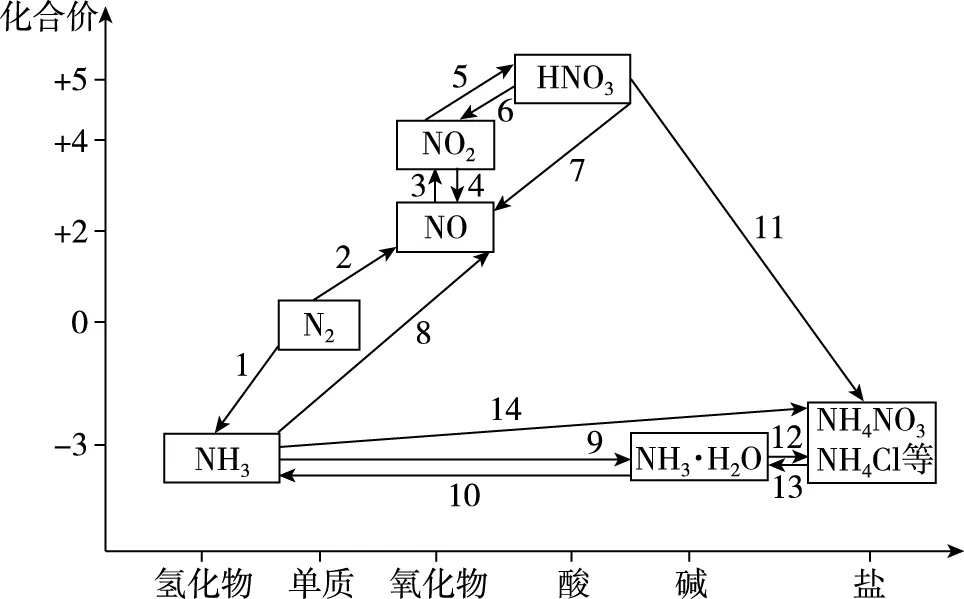
注:NH4NO3中氮元素有两种化合价,但其为铵盐,故将其放在化合价为-3的位置
二、依据氧化还反原应原理,寻找转化关系引导学生对类—价二维坐标图进行探究
驱动性问题1:从图中,能够发现哪些氧化还原反应规律?
思考交流:NH3中氮元素处于最低价,只具有还原性;HNO3中氮元素处于最高价,只具有氧化性;N2、NO、NO2中氮元素均处于中间价态,既有氧化性又有还原性。可以得出,氧化还原反应规律为最低价具有还原性,最高价具有氧化性,中间价态既有氧化性又有还原性。
驱动性问题2:根据氧化还原反应规律,用已有的知识写出类—价二维坐标图中转化关系1~7的化学方程式。
思考交流:完成化学方程式的书写,书写依据为氧化还原反应规律。
驱动性问题3:N2能反应生成NH3、NO,思考NH3、NO能生成N2吗?
思考交流:从氧化还原反应规律来看,可以。但教材中只给出N2与H2反应生成NH3是可逆反应,NH3能分解生成N2。
教师趁机引导:从氧化还原反应规律来看,NH3和NO可以反应生成N2,只不过需要特定的条件,例如在一定条件下,用氨气可将氮氧化合物转化为无毒气体。写出NH3分别与NO、NO2反应的化学方程式。
驱动性问题4:稀硝酸与铜、浓硝酸与铜反应产物有何不同,可以说明什么问题?
思考交流:化学反应与反应条件有关,当反应条件发生改变时化学反应可能发生改变。
教师趁机引导浓硝酸在常温下能使铁、铝等钝化,在加热条件下呢?此时教师可安排学生动手实验或观看实验视频,观察实验现象,得出结论,并用化学方程式表示所发生的反应,教师引导学生总结氧化还原反应方程式的书写方法,加深对反应条件对反应影响的理解。
三、依据物质分类,寻找共性,同中求异
根据物质分类,可以把氮元素及其化合物分为六个种类:氢化物、单质、氧化物、酸、碱、盐。同类物质具有相似的性质,如HNO3属于无机含氧酸,具有酸的性质;NH3·H2O属于碱,具有碱的性质。同类物质除了具有相似的性质外,每种物质还具有自己的特性,如HNO3的氧化性较强与活泼金属反应不能生成H2。因此在复习的时候,可以采用类比思想,寻找相似性,注意特殊性质。
1.氢化物——NH3
NH3在教材中占有重要的地位,无论物理性质还是化学性质都是高频考点。引导学生从物质组成、结构、性质、用途的角度梳理出以NH3为中心的思维导图。然后联系常见的氢化物H2O、H2S、HF、CH4的性质,找出相似性与特殊性质。
驱动性问题1:同学们经常听老师说“结构决定性质,性质决定用途”,到底结构是怎样决定性质,性质怎样决定用途的呢?请同学们展开丰富的联想,用已有的知识完成思维导图①~⑤空。


驱动性问题2:通过以上分析,找出氢化物的相似性,从分子极性、还原性等角度考虑寻找NH3与H2O、H2S、HF、HCl、CH4的相似性质。
思考交流:NH3与H2O、H2S、HF都是极性分子而CH4为非极性分子,NH3、H2O、HF分子间能形成氢键,沸点比同族氢化物的高;NH3、H2S、CH4及浓盐酸都具有还原性。
驱动性问题3:寻找NH3的特殊性,与其他氢化物相比有什么特殊性质?怎样利用其特殊性质检验NH3?
思考交流:NH3是中学阶段唯一的一种碱性气体。检验氨气可利用氨气的特征反应和特殊现象,氨气与浓盐酸反应产生白烟、氨气能使湿润的红色石蕊试纸变蓝。
2.单质——N2
同学们对非金属单质了解的比较多,如O2、H2、Si、S、Cl2等,以上几种单质化学性质各不相同,各有各的特殊性质。因此在复习N2时,重在了解它的特性。
驱动性问题1:从氧化还原反应的角度思考O2、H2、Si、S、Cl2、N2应具有什么样的相似性?
思考交流:因为以上几种单质化合价都为0,处于中间价态,在一定条件下既具有氧化性,又具有还原性。
驱动性问题2:比较以上几种单质,思考N2具有哪些特殊性质?
思考交流:N2的化学性质不活泼,但在一定条件下能发生某些化学反应,如与H2在催化剂加热条件下可以合成NH3,即工业合成氨;在放电或高温条件下可以与O2反应生成NO。
3.氧化物——NO、NO2
学生对非金属氧化物也比较熟悉,如CO、CO2、SO2、SO3、SiO2等。其中CO2和SO2的某些性质极为相似,如都可以使澄清的石灰水变浑浊;CO2、SO2、SO3均为酸性氧化物,都能与水反应生成相应的酸,而NO2虽然也能与水反应,但其不是酸性氧化物。SO2、NO、NO2都是空气污染物,能形成酸雨。相比较而言,学生应掌握的NO、NO2更多的是特殊性质。
驱动性问题1:氮的氧化物有哪些物理性质和化学性质,找出它们的特性。
思考交流:物理性质方面,NO为无色无味的气体,NO2在高温下为红棕色气体,常温下NO2与N2O4混合而共存;化学性质方面,NO与O2反应生成NO2,有红棕色气体生成,NO2与水反应可生成HNO3及NO。
驱动性问题2:大气污染物有哪些,对环境会产生怎样的影响?
思考交流:首先,SO2、氮氧化合物NOx(主要有NO、NO2、N2O等)可以形成酸雨。其次,氮氧化合物与碳氢化合物在紫外线作用下发生一系列光化学反应,产生一种有毒的光化学烟雾。
4.酸、碱、盐——HNO3、NH3·H2O、铵盐
HNO3、NH3·H2O、铵盐在高中化学中占有极其重要的地位。同学们对酸、碱、盐的概念了解比较多,HNO3、NH3·H2O、铵盐都具有其所属类别的性质,但它们都具有很多特殊性。
(1)HNO3硝酸
驱动性问题:对比其他酸,思考HNO3具有哪些特殊性质?
思考交流:教师从浓硫酸、浓盐酸性质的角度加以引导,与硝酸对比分析。首先,硝酸具有强氧化性,浓H2SO4、HNO3都具有强氧化性,相似点为浓硫酸、浓硝酸常温下都能使Fe、Al钝化;不同点为稀H2SO4不具有氧化性,而稀HNO3具有强氧化性,HNO3能与不活泼金属反应,而且HNO3与活泼金属反应不生成H2,氧化还原反应方程式的书写及配平是此部分知识的重难点。其次,硝酸具有不稳定性,见光易分解,而且硝酸具有挥发性。
(2)NH3·H2O
驱动性问题:对比其他碱,NH3·H2O有哪些特殊性质?

(3)铵盐

四、迁移拓展,促进知识建构
高中化学学习的非金属元素及其化合物主要有硅元素、氯元素、硫元素、氮元素。其他三种元素的知识建构方法与氮元素及其化合物相似,以化合价为中心,贯穿两个观念。在复习时注意运用分类观,找出四种元素的相似性及特殊性。在高考题中,元素及其化合物知识通常与元素周期律相结合,通过典型例题的剖析,提升知识迁移并应用的能力,反过来促进知识的建构,加深对知识的理解。以两道高考题为例,通过迁移应用完善和深化知识构建:
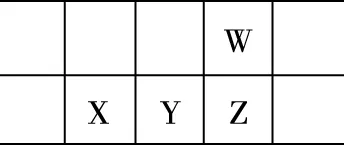
【例1】(2018·全国卷Ⅱ·10)W、X、Y和Z为原子序数依次增大的四种短周期元素。W与X可生成一种红棕色有刺激性气味的气体;Y的周期数是族序数的3倍;Z原子最外层的电子数与W的电子总数相同。下列叙述正确的是
( )
A.X与其他三种元素均可形成两种或两种以上的二元化合物
B.Y与其他三种元素分别形成的化合物中只含有离子键
C.四种元素的简单离子具有相同的电子层结构
D.W的氧化物对应的水化物均为强酸
【答案】A
【解析】根据分析可知W、X、Y和Z分别是N、O、Na、Cl。O与N、Na、Cl三种元素均可形成两种或两种以上的二元化合物,例如NO、NO2、Na2O、Na2O2、Cl2O7、ClO2等,A正确;过氧化钠中含有离子键和共价键,B错误;N、O、Na三种元素的简单离子具有相同的电子层结构,均是10电子微粒,氯离子是18电子微粒,C错误;亚硝酸为弱酸,D错误。
【例2】(2019·全国卷Ⅱ·9)今年是门捷列夫发现元素周期律150周年。下表是元素周期表的一部分,W、X、Y、Z为短周期主族元素,W与X的最高化合价之和为8。下列说法错误的是
( )
A.原子半径:W B.常温常压下,Y单质为固态 C.气态氢化物热稳定性:Z D.X的最高价氧化物的水化物是强碱 【答案】D 【解析】由“W与X的最高化合价之和为8”可知,W为N,X为Al,Y为Si,Z为P。原子半径:N 此类题的特点是将元素及其化合物与元素周期律相结合,综合性较强,在复习的时候要注意二者之间的联系,完善知识结构。借助元素周期律可以使元素及其化合物更有规律可循;根据元素周期表的递变规律,使元素及其化合物性质更容易理解和掌握。
