滴定法测定物质含量试题的解答步骤
2020-11-16宁夏王开山
宁夏 王开山
化学定量意识和定量分析能力的培养与提升是发展学生核心素养和关键能力的一个重要层面。纵观近年高考试题,通过滴定法测定物质含量的试题高频出现,成为考查学生定量意识和定量分析能力的重要题型。此类型试题素材来源广泛、情境创设有效、问题设置灵活,能很好地考查学生提取数据、处理数据的意识和能力。笔者以近三年全国卷相关试题为例,就滴定法测定物质含量试题解答步骤整理如下,与大家交流。
一、解答步骤
第一步:理清滴定类型
快速浏览滴定过程,确定待测物和滴定试剂之间是直接滴定型还是间接滴定型。
1.直接滴定型
待测物A和滴定试剂B通过电子转移守恒或原子守恒直接建立起关系式,即滴定过程涉及的反应只有一个。
2.间接滴定型
待测物A与试剂B发生反应生成中间产物C,中间产物C与又与滴定试剂D发生反应,待测物A与滴定试剂D之间的定量关系需要借助中间产物C建立,该过程涉及的反应至少有两个。
第二步:建立守恒关系
在理清滴定类型的基础上,通过原子守恒或得失电子数守恒快速建立待测物和滴定试剂之间的定量关系。根据滴定类型建立待测物和滴定试剂之间的关系式是后续顺利解答试题的核心依据。
第三步:留意单位换算
在代入数据计算时要留意所取待测物和滴定试剂物理量的不同,不同物理量之间的计算要留意单位之间的换算,如mL与L,g、kg、mg等。
第四步:关注结果表达
待测物含量结果表达是最后一步,常见的表达方式有质量分数(%)、质量体积浓度(mg/L)等。结果表达要关注待测物给定的量与滴定时实际取用的量是否一致,如给定待测物量是1 L或500 mL,滴定时取用了其中的100 mL或25 mL,后续数据的处理和最终结果的表达要与量保持一致。
二、真题赏析
【例1】(2019全国卷Ⅱ·26节选)立德粉ZnS·BaSO4(也称锌钡白),是一种常用白色颜料。回答下列问题:


【解答要点】梳理待测物和滴定试剂之间的关系可知,该题属于直接滴定型。根据所给Na2S2O3和I2之间的关系可以计算出消耗I2的量,然后根据电子转移守恒建立起S2-和I2之间的定量反应关系,最后代入数据可以计算S2-的含量。在单位换算中要注意mL和L的换算,最终结果以质量百分含量的形式来表达。

S2-~I2
1 mol 1 mol
nmolnmol
2 mol 1 mol

则样品中S2-含量为
【例2】(2018·全国卷Ⅰ·27节选)焦亚硫酸钠(Na2S2O5)在医药、橡胶、印染、食品等方面应用广泛。回答下列问题:
(4)Na2S2O5可用作食品的抗氧化剂。在测定某葡萄酒中Na2S2O5残留量时,取50.00 mL葡萄酒样品,用0.010 00 mol·L-1的碘标准液滴定至终点,消耗10.00 mL。该样品中Na2S2O5的残留量为________g·L-1(以SO2计)。
【答案】0.128
【解答要点】梳理待测物和滴定试剂之间的关系可知,该题属于直接滴定型。根据电子转移守恒可以建立SO2和I2反应的定量反应关系,然后代入数据计算样品中以SO2计的残留量。在单位换算中要注意mL和L的换算,最终终残留量的表达单位是g·L-1,即要将50.00 mL样品中的含量换算为1 L样品溶液中的含量。

【例3】(2018全国卷Ⅱ·28节选)K3[Fe(C2O4)3]·3H2O(三草酸合铁酸钾)为亮绿色晶体,可用于晒制蓝图。回答下列问题:
(3)测定三草酸合铁酸钾中铁的含量
①称量mg样品于锥形瓶中,溶解后加稀H2SO4酸化,用cmol·L-1KMnO4溶液滴定至终点。
②向上述溶液中加入过量锌粉至反应完全后,过滤、洗涤,将滤液及洗涤液全部收集到锥形瓶中。加稀H2SO4酸化,用cmol·L-1KMnO4溶液滴定至终点,消耗KMnO4溶液VmL。该晶体中铁的质量分数的表达式为________。

【解答要点】梳理待测物和滴定试剂之间的关系可知,该题属于直接滴定型。首先根据得失电子数守恒建立起Fe2+和KMnO4为5∶1的定量反应关系式,然后代入数据进行铁的质量分数的计算。在单位换算中要注意mL和L的换算,最终结果以质量百分含量的形式来表达。
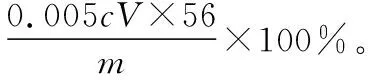

回答下列问题:
(5)取某甘氨酸(C2H5NO2)样品mg进行测定,消耗浓度为cmol·L-1的盐酸VmL,则样品中氮的质量分数为________%。

【解答要点】梳理待测物和滴定试剂之间的关系可知,该题属于间接滴定型。该题待测元素和滴定试剂之间的定量关系建立为非氧化还原反应。首先根据反应可以建立NH3和NH3·H3BO3之间的关系,然后建立NH3·H3BO3和HCl之间的定量关系,最终可以建立起氮元素和HCl之间的定量关系为:N~HCl。在单位换算中要注意mL和L的换算,最终结果以质量百分含量的形式来表达。

【例5】(2018·全国卷Ⅲ·26节选)硫代硫酸钠晶体(Na2S2O3·5H2O,M=248 g·mol-1)可用作定影剂、还原剂。回答下列问题:
(2)利用K2Cr2O7标准溶液定量测定硫代硫酸钠的纯度。测定步骤如下:
①溶液配制:称取1.200 0 g某硫代硫酸钠晶体样品,用新煮沸并冷却的蒸馏水在烧杯中溶解,完全溶解后,全部转移至100 mL的容量瓶中,加蒸馏水至刻度线。

【答案】95.0


【例6】(2017·全国卷Ⅱ·28节选)水中的溶解氧是水生生物生存不可缺少的条件。某课外小组采用碘量法测定学校周边河水中的溶解氧。实验步骤及测定原理如下:
Ⅰ.取样、氧的固定
用溶解氧瓶采集水样。记录大气压及水体温度。将水样与Mn(OH)2碱性悬浊液(含有KI)混合,反应生成MnO(OH)2,实现氧的固定。
Ⅱ.酸化、滴定

回答下列问题:
(4)取100.00 mL水样经固氧、酸化后,用amol·L-1Na2S2O3溶液滴定,以淀粉溶液作指示剂。若消耗Na2S2O3溶液的体积为bmL,则水样中溶解氧的含量为________mg·L-1。
【答案】(4)80ab
【解答要点】梳理待测物和滴定试剂之间的关系可知,该题属于间接滴定型。根据电子转移守恒可以建立O2与MnO(OH)2的定量反应关系式,以及MnO(OH)2和I2的定量反应关系式,然后根据I2和Na2S2O3的反应关系式最终建立起O2与Na2S2O3的定量反应关系式,在这个过程中MnO(OH)2和I2是建立待测物和滴定试剂的中间桥梁。在单位换算中要注意mL和L的换算,最终结果表达为的单位mg·L-1,所以要将100.00 mL水样样品中的含量换算为1 L水样样品溶液中的含量。

理清滴定类型是前提,建立守恒关系是根本,留意单位换算是保障,关注结果表达是关键。按照以上四个步骤思考、梳理滴定过程,物质含量试题的解答定会事半功倍。
