槐耳颗粒辅助西医疗法治疗原发性肝癌疗效及安全性Meta分析
2020-11-16李丽吴驻林梁彩君韩志毅彭立生
李丽,吴驻林,梁彩君,韩志毅,彭立生
槐耳颗粒辅助西医疗法治疗原发性肝癌疗效及安全性Meta分析
李丽1,吴驻林1,梁彩君1,韩志毅2,彭立生2
1.广州中医药大学第四临床医学院,广东 深圳 518033;2.深圳市中医院,广东 深圳 518033
系统评价槐耳颗粒辅助西医疗法治疗原发性肝癌的疗效和安全性。计算机检索Cochrane Library、PubMed、Embase、中国知识资源总库(CNKI)、中文科技期刊数据库(维普网)、中国生物医学文献数据库(CBM)、中国学术期刊数据库(万方数据),并行手工检索。检索范围为建库至2019年6月。收集槐耳颗粒辅助西医疗法治疗原发性肝癌(试验组)对比常规西医治疗(对照组)的临床随机对照试验(RCT),提取资料并运用Cochrane协作网偏倚风险评估工具进行质量评价,采用RevMan5.3进行Meta分析。共纳入13个RCT,涉及患者919例。Meta分析结果显示,试验组近期有效率(RR=1.40,95%CI[1.22,1.59],<0.000 01)、生活质量(RR=1.24,95%CI[1.07,1.44],=0.005)、1年生存率(RR=1.52,95%CI[1.21,1.92],=0.000 4)、甲胎蛋白变化有效率(RR=1.18,95%CI[1.04,1.33],=0.008)、降低不良反应(骨髓抑制、肝功能损害)均优于对照组,差异有统计学意义(<0.05)。试验组外周血CD4+T细胞(MD=9.79,95%CI[7.75,11.82],<0.000 01)水平明显高于对照组,差异有统计学意义(<0.05)。2组胃肠道反应(RR=0.68,95%CI[0.39,1.19],=0.18)及外周血CD8+T细胞水平(MD=-1.66,95%CI[-9.51,6.20],=0.68)比较差异无统计学意义。槐耳颗粒辅助西医疗法治疗原发性肝癌疗效和安全性优于对照组,但需更多高质量RCT进行验证。
槐耳颗粒;原发性肝癌;疗效;安全性;Meta分析
原发性肝癌(primary hepatocellular carcinoma,PHC)的发病率呈上升之势,为第3位肿瘤致死性病因[1]。由于起病隐匿,早期诊断率低,大部分PHC患者诊断时已为中晚期,生存期短且预后差。目前国内相关治疗以中西医结合为主,包括外科手术、经导管肝动脉化学栓塞(TACE)、射频消融术、放疗、化疗及中医药治疗[2]。槐耳是一种寄生于老龄中国槐的高等真菌子实体,由多种有机成分及10余种矿物质组成。槐耳颗粒以其为原料,具有扶正固本、破血消瘤之功[3],目前主要用于治疗PHC[4]、肺癌[5]、乳腺癌[6]等恶性肿瘤,研究表明其具有抑制肿瘤生长和转移的作用[7]。临床上,槐耳颗粒可与手术、放化疗及介入治疗联合应用于PHC,有抑癌、提高癌症患者免疫力等作用[8]。笔者基于Meta分析对槐耳颗粒辅助西医疗法治疗PHC的疗效和安全性进行系统评价,以期为临床应用和进一步研究提供参考。
1 资料与方法
1.1 数据来源
计算机检索Cochrane Library、PubMed、Embase、中国知识资源总库(CNKI)、中文科技期刊数据库(维普网)、中国生物医学文献数据库(CBM)、中国学术期刊数据库(万方数据),并行手工检索,检索范围为建库至2019年6月。语言、发表状态及类型不限。中文检索词:槐耳颗粒、金克、原发性肝癌、原发性肝脏恶性肿瘤、随机对照试验;英文检索词:Huaier Granule、Jin Ke、Primary hepatocellular carcinoma、Liver cancer、Randomized controlled trial(RCT)。
1.2 纳入标准
研究对象为符合国内外PHC诊断标准者,年龄、性别不限。研究类型为国内外公开发表的临床随机对照试验(RCT),无论是否使用盲法。干预措施:对照组为西医常规治疗,包括单纯化疗、放疗、手术或介入治疗;试验组在对照组基础上同时使用槐耳颗粒。结局指标至少包括以下1项:①近期有效率。根据世界卫生组织(WHO)实体瘤疗效评定标准[9]及实体瘤疗效评价标准(RECIST)[10]分别进行评价,分为完全缓解(CR)、部分缓解(PR)、稳定(SD)、疾病进展(PD),有效率(%)=(CR例数+PR例数)÷总例数×100%。②生活质量[11]。以Karnofsky(KPS)评分标准进行评定,改善率(%)=KPS评分提高例数÷总例数×100%。③1年生存率[12]。④甲胎蛋白(AFP)变化有效率[13]。AFP是PHC特异度及灵敏度较高的肿瘤标志物,比较患者治疗前后血清AFP水平,下降≥25%属下降,升高>25%属升高,下降或升高<25%属稳定,下降及稳定为AFP变化有效。⑤安全性指标[12]。按WHO抗癌药物毒性反应标准评价,包括骨髓抑制、胃肠道反应(如恶心呕吐、腹泻)、肝功能损伤。⑥免疫功能指标[14],包括CD4+T淋巴细胞、CD8+T淋巴细胞。
1.3 资料提取
采取主题词与自由词结合的检索方式。由2名研究者独立检索文献,纳入符合标准文献,再独立对文献基线情况、干预措施、评价指标进行提取及质量评价,并交叉核对,如遇分歧则由第3名评价者讨论解决[15]。课题组协商制作信息提取表,包括一般资料、干预与对照方案、疗效观察指标、研究结果和不良反应。
1.4 偏倚风险评估
由2名研究者独立采用Cochrane协作网偏倚评估工具评价方法学质量[16],交叉检查结果,如遇不一致讨论解决。
1.5 统计学方法
采用Cochrane协作网RevMan5.3进行Meta分析,二分类资料使用相对危险度(RR),连续变量资料使用加权均数差(MD),两类指标均以95%置信区间(CI)表示。采用卡方检验评估研究间异质性,2<50%为各研究间异质性较低,采用固定效应模型进行Meta分析;2≥50%为异质性存在或较高,先分析原因,再确定采用随机模型或只进行描述性分析。<0.05表明差异有统计学意义。研究数≥10的结局指标以倒漏斗图对称程度表示发表偏倚。
1.6 文献质量评价
采用Cochrane协作网推荐的证据质量评估工具GRADE profiler3.6.1[17]对Meta分析结果进行证据质量评价,包含随机方法、分配隐藏、患者及实施者施盲、结局评价者施盲、数据完整性、选择性报告、其他偏倚风险7个方面。根据评价标准,将结局指标证据分为高、中、低3个级别[18]。
2 结果
2.1 文献检索结果
共检索213篇相关文献,最终纳入13篇,涉及患者919例,其中试验组467例,对照组452例。筛选流程见图1。
2.2 文献基本特征及质量评价
13篇文献[19-31]中2组一般资料比较差异无统计学意义(>0.05),具有可比性。纳入文献肝癌分期主要采用巴塞罗那分期、TNM分期,部分文献未说明具体分期标准。对照组采用西医常规治疗,包括局部射频消融技术(RFA)、TACE及各类FolFox化疗方案[12]。试验组在对照组基础上加用槐耳颗粒,20 g/次,3次/d,口服。纳入研究基本特征见表1。13项研究为RCT,所有研究均提及分组为随机产生,仅1项研究[19]描述了具体随机方法(随机数字表法),其余研究随机化隐藏及盲法不清楚,6项研究[20-21,26,29-31]未见不完整结果数据,除1项研究[27]外,其余均未见选择性报告。纳入研究偏倚风险评价见表2、图2。
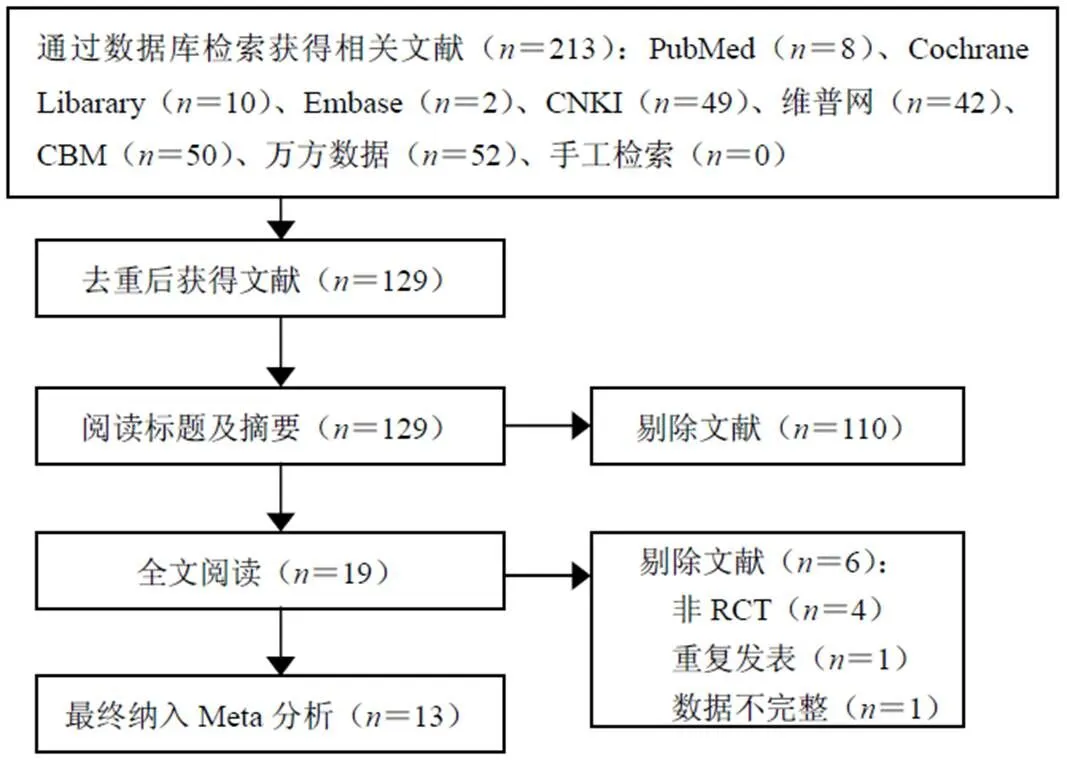
图1 纳入文献筛选流程图
表1 纳入文献基本特征
研究者例数疾病分期治疗方案试验组治疗周期结局指标 试验组对照组试验组对照组 何超雄[19]4040中晚期介入+放疗+槐耳颗粒介入+放疗槐耳颗粒,20 g/次,3次/d,30 d①③④⑤ 朱琳[20]3030中晚期改良FolFox+槐耳颗粒改良FolFox槐耳颗粒,20 g/次,3次/d,30 d①②④ 夏念信[21]2828未提及FolFox4+槐耳颗粒FolFox4槐耳颗粒,20 g/次,3次/d,30 d①②④ 米彩锋[22]6452中晚期放疗+槐耳颗粒放疗槐耳颗粒,20 g/次,3次/d,30 d①③④ 席玮[23]3333中晚期介入+槐耳颗粒介入槐耳颗粒,20 g/次,3次/d,30 d①③ 吴晖[24]4848Ⅱ、Ⅲ介入+槐耳颗粒介入槐耳颗粒,20 g/次,3次/d,90 d①⑤⑥ 李敬东[25]2525Ⅱ、Ⅲ介入+槐耳颗粒介入槐耳颗粒,20 g/次,3次/d,30 d① 李馨刚[26]1919Ⅲ介入+槐耳颗粒介入槐耳颗粒,20 g/次,3次/d,60 d⑥ 王天昌[27]6665Ⅱ~Ⅳ介入+槐耳颗粒介入槐耳颗粒,20 g/次,3次/d,30 d①②③ 刘也夫[28]3130未提及RFA+槐耳颗粒RFA槐耳颗粒,20 g/次,3次/d,30 d⑤ 阙劲松[29]1919未提及介入+槐耳颗粒介入槐耳颗粒,20 g/次,3次/d,30 d① 郭添胜[30]3333Ⅲ介入+槐耳颗粒介入槐耳颗粒,20 g/次,3次/d,30 d①⑤ 赵化荣[31]3130未提及介入+槐耳颗粒介入槐耳颗粒,20 g/次,3次/d,30 d①⑤
注:①近期有效率;②生活质量;③1年生存率;④AFP变化有效率;⑤安全性指标;⑥免疫功能指标
表2 纳入文献方法学质量评价
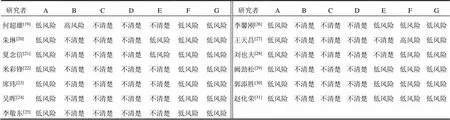
研究者ABCDEFG 研究者ABCDEFG 何超雄[19]低风险高风险不清楚不清楚不清楚低风险低风险 李馨刚[26]低风险不清楚不清楚不清楚低风险低风险低风险 朱琳[20]低风险不清楚不清楚不清楚低风险低风险低风险 王天昌[27]低风险不清楚不清楚不清楚不清楚高风险低风险 夏念信[21]低风险不清楚不清楚不清楚低风险低风险低风险 刘也夫[28]低风险不清楚不清楚不清楚不清楚低风险低风险 米彩锋[22]低风险不清楚不清楚不清楚不清楚低风险低风险 阙劲松[29]低风险不清楚不清楚不清楚低风险低风险低风险 席玮[23]低风险不清楚不清楚不清楚不清楚低风险低风险 郭添胜[30]低风险不清楚不清楚不清楚低风险低风险低风险 吴晖[24]低风险不清楚不清楚不清楚不清楚低风险低风险 赵化荣[31]低风险不清楚不清楚不清楚低风险低风险低风险 李敬东[25]低风险不清楚不清楚不清楚不清楚低风险低风险
注:A.随机方法;B.分配隐藏;C.患者及实施者施盲;D.结局评价者施盲;E.数据完整性;F.选择性报告;G.其他偏倚风险

图2 纳入文献偏倚风险评价
2.3 Meta分析结果
2.3.1 近期有效率
11项研究[19-25,27,29-31]报告了槐耳颗粒治疗肝癌的有效率,涉及患者820例。各研究间无统计学异质性(2=0%),采用固定效应模型进行合并。Meta分析结果显示,试验组近期有效率更佳(RR=1.40,95%CI[1.22,1.59],<0.000 01)。详见图3。

图3 槐耳颗粒辅助西医疗法治疗PHC近期有效率森林图
2.3.2 生活质量
3项研究[20-21,27]采用二分类变量描述生活质量改善程度,涉及患者247例。3项研究具有同质性(2=0%),采用固定效应模型进行分析。Meta分析结果显示,试验组可明显改善患者生活质量(RR=1.24,95%CI[1.07,1.44],=0.005)。详见图4。
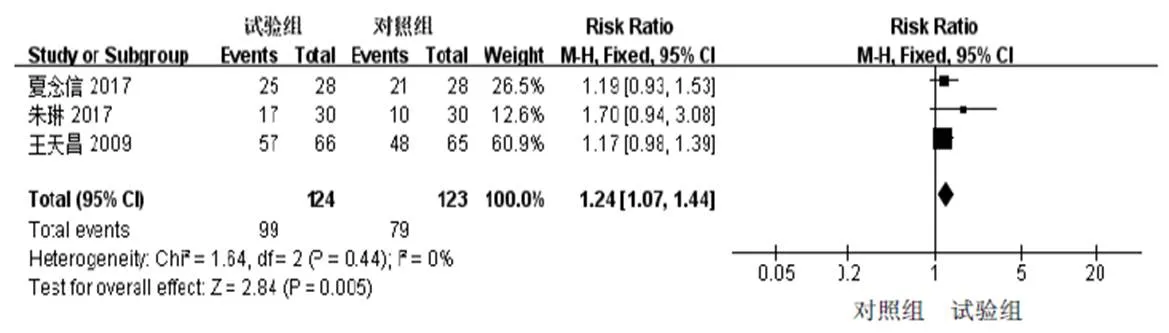
图4 槐耳颗粒辅助西医疗法治疗PHC生活质量森林图
2.3.3 1年生存率
4项研究[19,22-23,27]报告了1年生存率,涉及患者393例。各研究间具有同质性(2=0%),采用固定效应模型进行合并。Meta分析结果显示,试验组可明显提高患者1年生存率(RR=1.52,95%CI[1.21,1.92],=0.000 4)。详见图5。

图5 槐耳颗粒辅助西医疗法治疗PHC 1年生存率森林图
2.3.4 甲胎蛋白变化有效率
4项研究[19-22]报告了血清AFP水平,均为二分类变量描述,涉及患者312例。各研究间具有同质性(2=0%),采用固定效应模型进行分析合并。Meta分析结果显示,试验组可明显改善或稳定患者血清AFP值(RR=1.18,95%CI[1.04,1.33],=0.008)。详见图6。

图6 槐耳颗粒辅助西医疗法治疗PHC AFP变化有效率森林图
2.3.5 不良反应
5项研究[19,24,28,30-31]报告了骨髓抑制发生率,涉及患者364例;2项研究[19,24]报告了胃肠道反应发生率,涉及患者176例;3项研究[19,24,30]报告了肝功能损害发生率,涉及患者242例。将以上不良反应分别合并计算。试验组骨髓抑制和肝功能异常发生率显著低于对照组,差异有统计学意义(<0.000 01)。2项研究[19,24]报告了胃肠道反应,根据异质性检验(2=0%),采用固定效应模型合并统计量。Meta分析结果显示,试验组胃肠道反应发生率与对照组比较,差异无统计学意义(=0.18)。表明试验组总体安全性较好,尤其体现在减少放化疗后骨髓抑制和肝功能异常方面。详见表3。
表3 槐耳颗粒辅助西医疗法治疗PHC不良反应Meta分析
不良反应试验组对照组异质性检验RR95%CIP值 P值I2/% 骨髓抑制 32/183 73/1810.99 00.440.31,0.61<0.000 01 肝功能损伤 33/121 76/1210.25270.440.33,0.58<0.000 01 胃肠道反应 15/88 22/880.32 00.680.39,1.190.18
2.3.6 外周血CD4+T淋巴细胞
2项研究[24,26]报告了外周血CD4+T淋巴细胞水平,涉及患者134例。根据异质性检验(2=32%),采用固定效应模型进行合并。Meta分析结果显示,试验组可明显提高外周血CD4+T淋巴细胞水平(MD=9.79,95%CI[7.75,11.82],<0.000 01)。详见图7。

图7 槐耳颗粒辅助西医疗法治疗PHC外周血CD4+T细胞水平森林图
2.3.7 外周血CD8+T淋巴细胞
2项研究[24,26]报告了外周血CD8+T淋巴细胞水平,涉及患者134例。根据异质性检验(2=93%),采用随机效应模型进行合并。Meta分析结果显示,试验组外周血CD8+T淋巴细胞水平与对照组比较差异无统计学意义(MD=-1.66,95%CI[-9.51,6.20],=0.68)。详见图8。

图8 槐耳颗粒辅助西医疗法治疗PHC外周血CD8+T细胞水平森林图
2.4 发表偏倚分析
对11项[19-25,27,29-31]报告了槐耳颗粒治疗PHC近期有效率的研究进行倒漏斗图分析,见图9,研究散点均在漏斗内,对称性欠佳。通过R3.4.4软件的Harbord test程序包[32]进行直线回归检验(=0.976 2),结果显示本研究不存在发表偏倚。通过剪补法得出漏斗图见图10,添加2项研究图像即可对称,提示可能有阴性结果研究尚未发表。
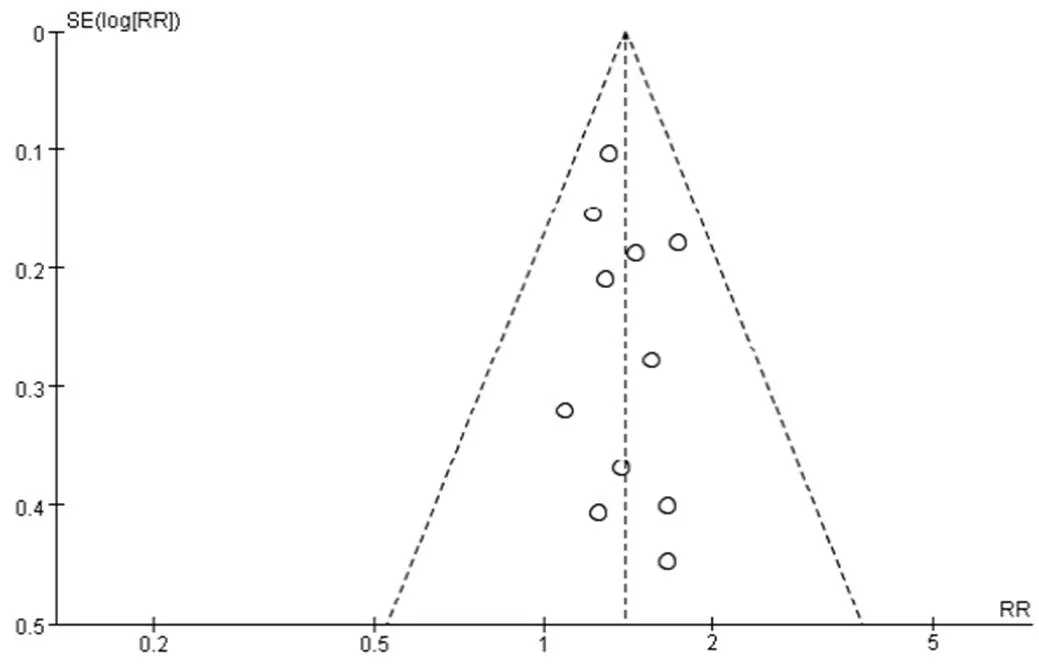
图9 疗效评价倒漏斗图
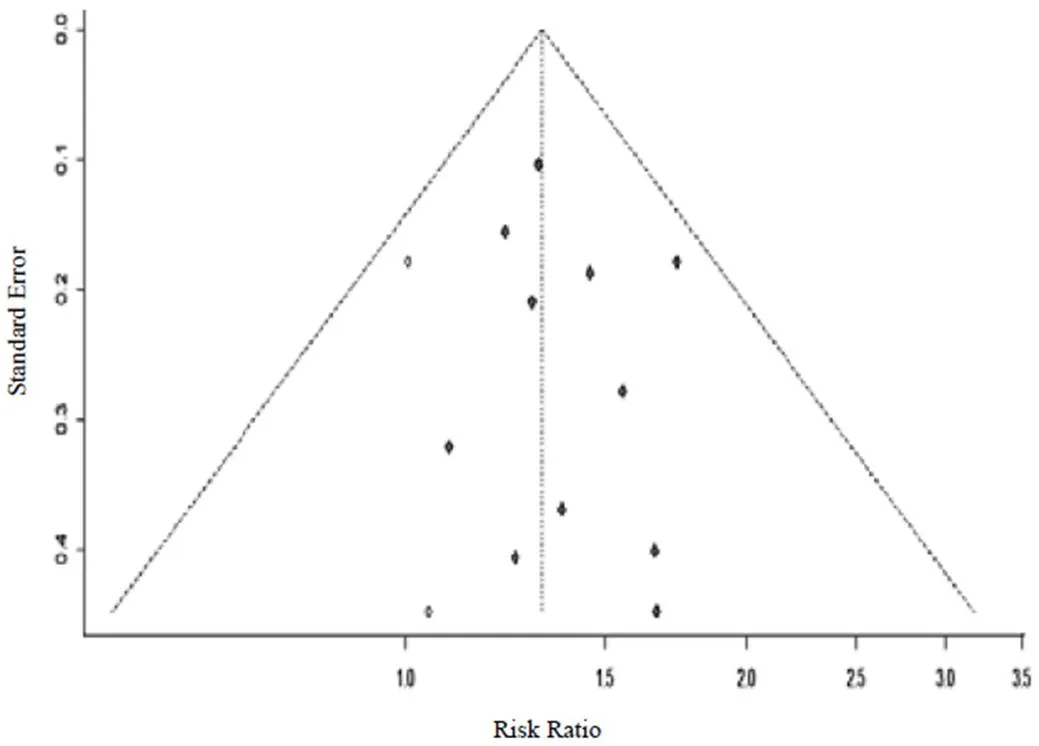
图10 疗效评价倒漏斗图(剪补法)
2.5 证据质量评价
5个结局指标评价结果均为中等证据质量,主要结论的证据质量见表4。
表4 主要结局指标的证据质量评价
结局指标试验组vs对照组RCT数量偏倚风险不一致性间接性不精确性发表偏倚GRADE质量 近期有效率槐耳颗粒+西医治疗vs西医治疗11严重(-1)a无无无无b中等 生活质量槐耳颗粒+西医治疗vs西医治疗 3无无无严重(-1)c无b中等 1年生存率槐耳颗粒+西医治疗vs西医治疗 4严重(-1)a无无无无b中等 AFP变化有效率槐耳颗粒+西医治疗vs西医治疗 4严重(-1)a无无无无b中等 免疫功能槐耳颗粒+西医治疗vs西医治疗 4无无无严重(-1)c无b中等
注:a.1项研究随机方法高风险,对患者分配隐藏及施盲均不清楚;b.检索3个以上数据库、2种语言;c.样本量<300
3 讨论
PHC具有起病隐蔽、潜伏期长、进展迅速、易转移等特点,预后较差,严重影响患者的生存质量[2],属中医学“积聚”“臌胀”“黄疸”“胁痛”等范畴。肝癌的病机主要为外邪入侵、情志失调、饮食所伤后导致肝脾受损、气机失调、痰瘀内结,日久凝结成肿块,发为肝癌,当属本虚标实。槐耳味苦辛,性平无毒,有治风、益力、破血之功,主治五痔、心痛等[33]。槐耳颗粒是以高等真菌子实体为原料制成的中药制剂,具有扶正固本、破血化瘀之功。由于肿瘤生长和转移都依赖于血管生成,体外研究表明槐耳对血管内皮细胞体外构建新生血管具有抑制作用,进而产生显著的抑瘤作用,可广泛应用于肿瘤治疗,但其确切机制尚未完全清楚[34]。药理实验亦显示,槐耳对巨噬细胞吞噬功能有显著促进作用,可改善机体免疫功能[35]。
本研究共纳入13项RCT,涉及患者919例。Meta分析结果显示,槐耳颗粒辅助西医疗法治疗PHC在提高肝癌近期疗效、改善患者生活质量、提高1年生存率、降低血清AFP含量、降低不良反应(骨髓抑制、肝功能损害)方面,较对照组差异均有统计学意义(<0.05)。同时,槐耳颗粒能通过提高外周血CD4+T淋巴细胞水平而改善患者免疫功能,差异有统计学意义(<0.05)。但在2组胃肠道不良反应及提高外周血CD8+T淋巴细胞水平的系统评价上,差异无统计学意义(>0.1)。
当然,本研究尚存在一定局限性:①采用Cochrane协作网偏倚风险评估工具对文献质量进行评价,大多未提及具体随机方法及分配隐藏,施盲情况不清楚,纳入原始研究质量不高;②纳入文献数目较少,患者例数不多,GRADE证据质量级别强度不高;③纳入文献均未提及或忽视槐耳颗粒单独使用可能存在的不良反应,随访情况不明,其安全性有待进一步研究及远期随访;④以近期有效率为指标的11项研究的倒漏斗图散点分布对称性欠佳,结合线性回归检验结果,提示阴性试验结果未发表可能性大;⑤纳入文献均未对患者进行辨证分型。
综上所述,槐耳颗粒辅助西医治疗可提高PHC患者近期疗效、1年生存率,进一步改善患者生活质量及免疫功能,降低不良反应发生率。结合GRADE证据质量评价考虑,临床尚需开展更多高质量的RCT以进一步验证,并应严格按照试验报告统一标准CONSORT[36]进行报告。
[1] FORNER A, REIG M, BRUIX J. Hepatocellular carcinoma[J]. Lancet, 2018,391(10127):1301-1314.
[2] 王斌.中西医结合治疗原发性肝癌研究进展[J].临床医药文献电子杂志,2017,4(96):19003.
[3] 庄毅.真菌抗癌药物槐耳颗粒的研制[J].中国肿瘤,1999,8(12):540- 543.
[4] 蒋梅,周岱翰.槐耳冲剂治疗中晚期原发性肝癌98例[J].上海中医药杂志,2004,38(6):21-22.
[5] 高平,陆依珊,吴兰,等.槐耳颗粒治疗原发性支气管肺癌的临床疗效[J].辽宁中医杂志,2016,43(5):994-997.
[6] 单昌友,刁岩,黄珊,等.槐耳颗粒联合新辅助化疗对乳腺癌的疗效及对P53 Ki-67 MMP-2 MMP-9水平的影响[J].河北医学,2018,24(4):579- 583.
[7] ZOU Y, XIONG H, XIONG H, et al. A polysaccharide from mushroom Huaier retards human hepatocellular carcinoma growth, angiogenesis, and metastasis in nude mice[J]. Tumour Biology:the Journal of the International Society for Onco Developmental Biology and Medicine,2015,36(4):2929-2936.
[8] 李思维,邹立勇,尹宜发.槐耳颗粒在肿瘤临床中的应用[J].中国肿瘤,2005,14(10):698-700.
[9] WHO. WHO handbook for reporting results of cancer treatment[M]. Offset Publication No.48. Geneva (Switzerland):World Health Organization,1979:22-25.
[10] DUFFAUD F, THERASSE P. New guidelines to evaluate the response to treatment in solid tumors[J]. Bull Cancer,2000,87(12):881- 886.
[11] GEHAN E A, TEFFT M C. Will there be resistance to the RECIST (Response Evaluation Criteria in Solid Tumors)?[J]. J Natl Cancer Inst,2000,92(3):179-181.
[12] 中华人民共和国国家卫生和计划生育委员会.原发性肝癌诊疗规范(2017年版)[J].临床肝胆病杂志,2017,33(8):1419-1431.
[13] GAO F, ZHU H K, ZHU Y B, et al. Predictive value of tumor markers in patients with recurrent hepatocellular carcinoma in different vascular invasion pattern[J]. Hepatobiliary & Pancreatic Diseases International,2016,15(4):371-377.
[14] 刘尚梅,赵建军,杨晓洁,等.肝细胞肝癌对机体细胞免疫的影响[J]. 实用癌症杂志,2005,20(1):68-70.
[15] 吴驻林,谭婉君,连宝涛,等.复方苦参注射液联合含奥沙利铂化疗方案治疗大肠癌疗效与安全性的系统评价[J].中国药房,2017,28(3):369-373.
[16] HIGGINS J P, ALTMAN D G, GOTZSCHE P C, et al. The Cochrane collaboration's tool for assessing risk of bias in randomised trials[J]. BMJ,2011,DOI:10.1136/bmj.d5928.
[17] GUYATT G H, OXMAN A D, VIST G E, et al. GRADE:an emerging consensus on rating quality of evidence and strength of recommendations[J]. BMJ,2008,336(7650):924-926.
[18] 王慧敏,李慧,谢润生,等.针刺治疗脑卒中后尿潴留系统评价[J].中国中医药信息杂志,2019,26(6):92-96.
[19] 何超雄,冯惠岗,翁裕.TACE联合放射性125I粒子及槐耳颗粒治疗中晚期肝癌的临床研究[J].中国医学创新,2018,15(6):13-16.
[20] 朱琳,黄英.槐耳颗粒联合改良FOLFOX方案治疗中晚期肝癌的临床疗效观察[J].中国医药指南,2017,15(3):188.
[21] 夏念信,邱宝安,王敬晗,等.化疗联合槐耳颗粒对原发性肝癌术后复发/转移患者预后影响研究[J].临床军医杂志,2017,45(9):887-890.
[22] 米彩锋.槐耳颗粒联合125I放射性粒子植入术治疗中晚期肝癌的疗效分析[J].中国实用医刊,2016,43(12):75-77.
[23]席玮,徐清宇,陆游,等.槐耳颗粒联合TACE治疗中晚期原发性肝癌的安全性及疗效观察[C]//中国中药杂志2015专集:基层医疗机构从业人员科技论文写作培训会议论文集.中国中药杂志社,2016:383,385.
[24] 吴晖.槐耳颗粒联合化疗栓塞术治疗原发性肝癌96例[J].中国药业, 2014,23(3):16-18.
[25] 李敬东,彭勇,戴毅,等,槐耳颗粒联合肝动脉灌注化疗栓塞治疗晚期肝癌的临床研究[J].西部医学,2010,22(3):418-420.
[26] 李馨刚,许炎.槐耳颗粒口服联合介入疗法治疗原发性肝癌的细胞免疫变化[J].中国民康医学,2009,21(18):2196-2230.
[27] 王天昌,蒋明,崔菲.槐耳颗粒联合介入治疗原发性肝癌的疗效观察[J].中国实用医刊,2009,36(14):79-80.
[28] 刘也夫.金克槐耳颗粒联合射频消融治疗原发性肝癌的近期疗效观察[J].中华中医药学刊,2008,26(6):1194-1195.
[29] 阙劲松,高世洪.槐耳颗粒联合介入疗法治疗原发性肝癌的疗效观察[J].临床和实验医学杂志,2007,6(5):151.
[30] 郭添胜,黄福喜,曹小龙.槐耳颗粒联合介入治疗原发性肝癌的疗效观察[J].实用医学杂志,2005,21(16):1846-1847.
[31] 赵化荣,买尼沙,包永星.金克槐耳颗粒联合介入治疗原发性肝癌近期疗效观察[J].新疆中医药,2004,22(5):27-28.
[32] HARBORD R M, EGGER M, STERNE J A. A modified test for small-study effects in meta-analyses of controlled trials with binary endpoints[J]. Stat Med,2006,25(20):3443-3457.
[33] 赵国平,戴慎,陈仁寿,等.中药大辞典[M].2版.上海:上海科学技术出版社,2006:873.
[34] 许戈良,荚卫东,马金良,等.槐耳清膏体外抑制血管生成的实验研究[J].中国药理学通报,2003,19(12):1410-1412.
[35] 施红申,茅冬梅.金克槐耳冲剂药理初析[J].上海中医药杂志,1995, 29(1):9.
[36] MOHER D, SCHULZ K F, ALTMAN D. The CONSORT statement:revised recommendations for improving the quality of reports of parallel-group randomized trials[J]. JAMA,2001,285(15):1987- 1991.
Meta-analysis on Efficacy and Safety ofGranules Assisted with Western Medicine in Treatment of Primary Hepatocellular Carcinoma
LI Li1, WU Zhulin1, LIANG Caijun1, HAN Zhiyi2, PENG Lisheng2
To evaluate the efficacy and safety ofGranules assisted with Western medicine in the treatment of primary hepatocellular carcinoma (PHC).Cochrane Library, PubMed, Embase, CNKI, VIP, CBM, and Wanfang database and relevant journals were searched for randomized controlled trials (RCTs) aboutGranules assisted with Western medicine for PHC (test group) versus routine Western medicine treatment of PHC (control group) from establishment to June 2019. All included researches were assessed using the Cochrane Collaboration Risk Bias Evaluation Tool and meta-analysis was conducted using RevMan5.3.Totally 13 RCTs were included, involving 919 patients. Results of meta-analysis showed that treatment group could improve the efficiency of treatment (RR=1.40, 95%CI [1.22, 1.59],<0.000 01), the quality of life (RR=1.24, 95%CI [1.07, 1.44],=0.005), 1-year survival rate (RR=1.52, 95%CI [1.21, 1.92],=0.000 4), and Alpha-fetoprotein change efficiency (RR=1.18, 95%CI [1.04, 1.33],=0.008), and side effects such as bone marrow suppression and liver function damage lower than that of the control group, with statistical significance (<0.05).Peripheral blood CD4+T cell levels in treatment group showed higher than that in the control group (MD=9.79,95%CI [7.75, 11.82],<0.000 01). Gastrointestinal response in two groups (RR=0.68, 95%CI [0.39, 1.19],=0.18) and peripheral blood CD8+T cell levels (MD=-1.66, 95%CI [-9.51, 6.20],=0.68) showed no statistically significant difference.Granules assisted with Western medicine show better efficacy and safety in the treatment of PHC than the control group; however, higher quality RCTs are needed to verify.
Granules; primary hepatocellular carcinoma; efficacy; safety; meta-analysis

R2-05;R273.57
A
1005-5304(2020)10-0103-07
10.19879/j.cnki.1005-5304.201909098
深圳市科技计划(JCYJ20180302173542393)
彭立生,E-mail:szpengls@163.com
(2019-09-07)
(2020-09-30;编辑:季巍巍)
