布鲁氏杆菌在巨噬细胞内可以长期存在的原因
2020-11-14耿慧娟
耿慧娟
(保定市人民医院,河北 保定 071000)
细胞的自噬过程是一种细胞基于自我消化与降解的高度保守行为,多是由于真核细胞生物体内为维持机体的环境稳定所进行的一种过程[1]。同时自噬行为的发生往往也是机体内部固有的免疫应答重要标志,在进行自噬的过程中,会对于机体内部细胞中存在的病原体进行有效的清除,同时也能够在抗原的提呈过程中起到一定的作用[2]。但是近年来有一些文献指出[3],自噬虽然能够有效的对于外来入侵的病原体与微生物进行有效的杀灭与清除,但是部分胞内寄生菌与病毒往往能够通过自身或者机体对于自噬作用进行一定的改变或者逃避,甚至进而在机体内借助大量增殖,引发相关疾病。本次研究中的布鲁氏菌就是一种主要寄生与巨噬细胞与胎盘滋养层细胞内部的包内寄生革兰氏阴性菌种,此类菌种能够通过其表面的O-链LPS对于巨噬细胞表面脂伐产生一定作用,进而进入巨噬细胞内部,改变内部pH值的同时,使自身大量繁殖[4]。但是对于自噬细胞遭受相关感染的原因与在感染过程中是否存在一定的抑制布鲁氏菌增长的作用一直未曾明晰。本次研究中巨噬细胞进行分组,并分别采用抑制剂3-MA与自噬激活剂雷帕霉素对于巨噬细胞进行处理,并预留一组不做处理,观察分析布鲁氏杆菌对巨噬细胞容易感染原因,现报告如下。
1 资料与方法
1.1 一般资料
本次研究选取的重组猪种布鲁氏菌与小鼠巨噬细胞等实验材料均来源于外院实验室采购保存,研究中所采用的相关实验材料有:LC3-II抗体试剂、3-MA抑制剂、自噬诱导剂Ra、LC3-IIELISA检测试剂盒。
1.2 实验方法
具体实验方法如下:①首先进行重组猪种布鲁氏菌与布鲁氏菌的培养,均按照1%的比例于培养基中接种,随后37℃培养24 h,培养完成后进行收获并置于冰箱内保存与菌落计数;②随后将巨噬细胞进行常规传代培养并置于96孔细胞培养板中,2×106个/孔,直至细胞长至单层,随后选择终浓度为10nM的Ra与10nM的3-MA进行作用,作用2h后弃细胞液并加入培养基,单孔100uL/孔;③将培养好的布鲁氏菌以1∶500的比例接种于96孔细胞培养板中,并分为巨噬细胞组、3-MA组与雷帕霉素组,随后进行培养在2 h、6 h、12 h、24 h四个时间段加入蛋白酶抑制剂,并随后进行3此低温冻融;④对于标本进行离心5 min并取上清液,进行LC3-II含量测定。
1.3 观察指标
对比三组两种细胞数量变化与细胞内LC3-II的含量变化。
2 结 果
2.1 检测结果一览
在出现布鲁氏菌感染后,巨噬细胞发生了一定的自噬作用,雷帕霉素组巨噬细胞内的LC3-II的含量明显上升且高于其他组;同时雷帕霉素组内的布鲁氏菌数量明显高于另外两组;而在2 h、6 h、12 h、24 h四个时间段内对比我们发现,各组的布鲁氏菌数量均出现上涨的情况,且随着时间的推移巨噬细胞内的LC3-II的含量明显增加,见表1、2。
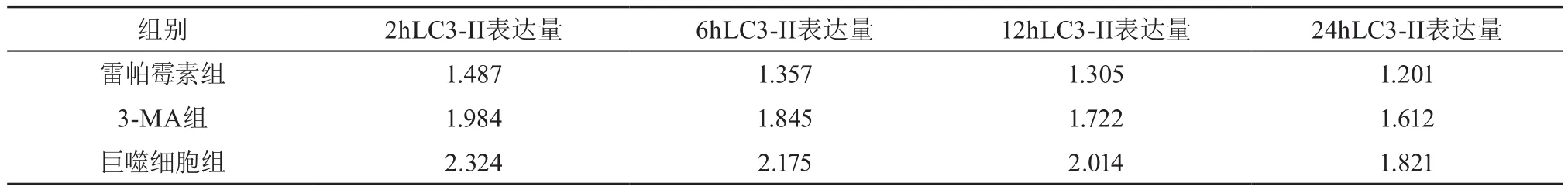
表1 各组LC3-II表达量不同时间段变化

表2 各组鲁氏菌测定值不同时间段变化
3 讨 论
本次研究中所提及的布鲁氏菌能够通过一系列的策略逃避免疫监视,从而改善巨噬细胞内部的环境,从而使得其内部有利于其自身的复制与增殖。国内有研究认为胞内病原微生物主要能够通过抑制自噬小体的形成或者抑制吞噬小体与溶酶体的融合来干扰机体内部自噬作用的发生,本次研究中采用了3-MA与雷帕霉素对于巨噬细胞的自噬能力进行了放大或者降调,且并为对于巨噬细胞的活力造成影响,同时基于自噬能力的大小对于布鲁氏菌生长的影响进行了对比,发现了两者之间的关联性[5]。
同时本次研究中对于细胞内LC3-II的表达量进行了一定的测定,此类指标的含量往往是反映细胞内部自噬作用能力的重要指标,通过对于此指标的测定能够有效的测定自噬作用与布鲁氏菌的关联性[6]。我们发现,布鲁氏菌感染后巨噬细胞内LC3-II的表达量明显增加,并对于巨噬细胞的自噬能力进行了有效的增强,同时也导致了布鲁氏菌在巨噬细胞内部的增殖,随着实验时间的推进我们不难发现,随着细胞内LC3-II的表达量下降,细胞内部的布鲁氏菌数量却一直在增加,主要是由于在细胞数量有限的情况下,当布鲁氏菌的数量饱和后,自噬细胞虽然启动了自噬作用,LC3-II为溶酶体降解,并使得布鲁氏菌被部分杀灭,但是存留的布鲁氏菌已然在其内部大量增殖,这也解释了布鲁氏杆菌对巨噬细胞容易感染的原因所在。
综上所述,在布鲁氏菌感染巨噬细胞的过程中,巨噬细胞体内的LC3-II的含量会出现明显上升,提示自噬作用的发生,但是随着时间的推移,此种自噬作用虽然能够杀灭部分布鲁氏菌,但是也会使得布鲁氏菌在巨噬细胞内部出现增殖的情况,当达到感染数量饱和时,巨噬细胞将无法抑制布鲁氏菌的大量增殖。
