浓凝胶转换法制备纳米SAPO-34及其CH4/N2吸附分离性能研究
2020-11-13刘佳奇吴罗钢杨江峰李立博李晋平
刘佳奇,唐 轩,吴罗钢,杨江峰,2,李立博,2,李晋平,2
(1.太原理工大学化学化工学院精细化工研究所,太原030024;2.气体能源高效清洁利用山西省重点实验室,太原030024)
SAPO-34分子筛是一种具有CHA拓扑结构的硅铝磷酸盐分子筛,由美国UCC公司于1982年首次合成[1,2].其具有的八元环孔口(0.38 nm×0.38 nm)为择形催化和气体筛分提供了绝佳的场所,因此对甲醇制烯烃(MTO)催化反应和CO2/CH4吸附分离展现出优良的性能,是目前催化和吸附研究领域最受关注的分子筛之一[3~6].然而其狭小的孔道也限制了客体分子在晶体内部的传递,导致孔道积碳、催化剂寿命短和吸附量低等问题[7,8].Chen等[9]通过研究SAPO-34的晶粒尺寸对其在MTO反应中积碳速率和失活的影响,发现晶粒尺寸小于500 nm的SAPO-34可提升反应物在分子筛内部的传质速率,显著抑制积碳的生成,延长催化剂的使用寿命.Van等[10]通过微波法合成了粒径为100nm的立方形纳米SAPO-34分子筛,并通过87 K下的氩气吸附研究了粒径尺寸对其吸附性能的影响,结果表明,相比于尺寸为1 μm的常规SAPO-34,纳米SAPO-34分子筛具有更高的孔隙度,其氩气吸附量也提升了125 cm3/g.这些报道表明,合成纳米SAPO-34是提高其吸附和催化性能的有效手段.
合成纳米沸石分子筛最常用的方法是水热合成法[11],可通过调控反应物种类、晶化温度和晶化时间来控制产物的形貌和晶体大小.然而,在传统的水热条件下很难合成粒径小于800 nm的SAPO-34颗粒[12],而且在合成过程中还会产生大量的有机胺废水,对环境造成极大的污染[13].另一种被广泛应用的合成方法是干凝胶转化法(DGC):将初始凝胶在搅拌下加热到一定的温度,以形成干凝胶,然后将其放入高压反应釜中,底部放入少量水(不与干凝胶直接接触),在加热的条件下,干凝胶与水蒸气接触并结晶[14].Hirota等[12]以四乙基氢氧化铵(TEAOH)为模板剂,采用干凝胶转化法合成了平均晶粒尺寸为75 nm的SAPO-34,而使用相同模板剂采用水热法制备的SAPO-34的晶粒尺寸为6.5 μm.近年来,超声预处理和微波法等方法也被应用于制备纳米分子筛,并取得了良好的效果.Lin等[15]采用微波辅助水热处理,通过改变硅源、H2O/Al2O3摩尔比、晶化时间和老化时间等合成因素,合成了尺寸为60~80 nm的SAPO-34晶体颗粒;Askari等[16]采用超声预处理前驱凝胶的方法,以TEAOH为结构导向剂,在473 K下仅需1.5 h就合成了粒径为50 nm的SAPO-34颗粒.然而这些合成方法所需的设备复杂且昂贵,无法应用于大规模生产,因此寻找一种更加简单和绿色的纳米SAPO-34分子筛合成方法一直是研究的热点与难点[17].浓凝胶转换法与干凝胶法类似,都是采用极少量的水,但是凝胶与液相并不分离,这使其反应容器利用率得到提高,操作也更加简便.Corma团队[18]在合成Beta分子筛过程中,首次通过添加极少量的水(H2O/SiO2<10)形成了浓凝胶体系,实现了浓凝胶转化法合成Beta分子筛.Zhang等[19]通过浓凝胶法合成了纳米ZSM-5分子筛,并认为浓凝胶中晶核数量的大量增加是最终导致纳米沸石生成的原因.
本文通过浓凝胶转化法合成了纳米片状SAPO-34,并对制备的样品进行了表征,在此基础上考察了合成的纳米SAPO-34对CH4/N2混合气体的吸附分离能力.
1 实验部分
1.1 试剂与仪器
硅溶胶(质量分数30%),Alfa Aesar试剂公司;磷酸(质量分数85%)和四乙基氢氧化铵(质量分数25%),Aladdin试剂公司;吗啡啉(Mor,化学纯)和异丙醇铝(化学纯),国药集团化学试剂有限公司;蒸馏水,自制.
粉末X射线衍射(XRD)测试在德国Bruker公司D8 Advance型X射线衍射仪上进行,测试条件为CuKα(λ=0.154178 nm)辐射源,工作电压40 kV,工作电流40 mA,步长0.02°,扫描时间0.25 s/step,扫描范围2θ=5°~40°;扫描电子显微镜(SEM)表征采用日本日立公司Hitachi SU8000型场发射扫描电子显微镜,操作电压为15.0 kV,在测试之前经过喷金预处理;硅、铝和磷元素含量利用PerkinElmer Avio 200 ICP-OES电感耦合等离子体发射光谱仪(ICP-OES)测定,样品溶液由WX-6000微波消解仪器(屹尧科技公司)进行消解处理;吸附等温线(N2@77 K,CH4@298 K和N2@298 K)均使用Micromeritics ASAP2460分析仪测试,在测试之前,将每个样品使用脱气站(VacPre 061)于473 K真空脱气5 h,使用的N2气纯度为99.999%,CH4的纯度为99.99%.混合气体穿透装置为自制,整个系统由进气系统、吸附柱和气相色谱仪3部分组成,吸附柱为不锈钢材质(内径9 mm,长150 mm),用GC-2014C型气相色谱仪(日本岛津公司)监测吸附柱出口处的气体浓度.样品经压片造粒成40~60目的颗粒,装填于吸附柱中,然后在473 K下真空活化5 h,随后用载气(He气,纯度≥99.999%)以20 mL/min的速度吹扫吸附柱1 h,在床温降至298 K之后,将流速为5 mL/min的混合气引入吸附柱中,每隔一段时间从出气口取样注入到色谱仪中进行分析,最后得出气体穿透曲线.
1.2 实验过程
按照n(Al2O3)∶n(SiO2)∶n(TEAOH)∶n(Mor)∶n(P2O5)∶n(H2O)=1∶0.3∶1.0∶1.0∶1.0∶30的比例,采用浓凝胶转化法合成纳米SAPO-34.具体操作步骤如下:
(1)将2.04 g异丙醇铝缓慢加入2.70 mL蒸馏水中并搅拌,待水解完全后加入2.82 mL TEAOH溶液和0.42 mL Mor溶液并搅拌0.5 h;加入0.68 mL磷酸溶液,继续搅拌0.5 h;加入0.22 mL硅溶胶并搅拌1 h,形成凝胶,待用.
(2)将所得凝胶置于烧杯中,在363 K水浴中分别加热搅拌0,0.5,1.0,1.5,2和2.5 h,通过浓缩初始凝胶得到不同溶剂(包括水和异丙醇)含量的浓凝胶.
(3)将浓凝胶转移到带有聚四氟乙烯内衬的高压反应釜中,在453 K下晶化反应12 h.将所得样品充分洗涤,高速离心后置于353 K烘箱中干燥12 h.
(4)将干燥后的样品置于马弗炉中,于823 K焙烧5 h得到最终产物,命名为C-X(C代表浓缩;X代表加热搅拌时间,即浓缩时间).将在363 K下真空干燥24 h的凝胶认为是完全干燥的凝胶,则不同浓缩时间后浓凝胶中溶剂含量的计算公式为(mConcentratedgel-mDrygel)/mConcentratedgel×100%,具体反应条件见表1.

Table 1 Synthetic conditions of different samples
2 结果与讨论
2.1 溶剂含量对分子筛晶相的影响
通过对初始凝胶进行不同时间的浓缩,考察了其对SAPO-34分子筛晶相、元素组成及相对结晶度的影响.相对结晶度的计算方法如下:将每个样品XRD谱图中2θ=9.45°,12.83°,15.93°,20.49°及30.49°5个特征峰的峰面积进行积分计算后相加,以C-0为参比样品,即C-0的相对结晶度为100%,其它样品的相对结晶度为其特征峰面积和与参比样品的特征峰面积和之比.由图1中XRD谱图可知,样品C-0~C-1.5的峰形与模拟结果高度吻合,证明合成的样品为SAPO-34.随着浓缩时间的延长,晶体的相对结晶度降低(表2),当浓缩时间达到2.0 h时,特征峰强度明显降低(相对结晶度为45%),且在2θ=20°和21.3°处出现了AEI结构的特征峰,说明更浓的体系(溶剂含量48.68%)不适合SAPO-34分子筛的生长而适合AEI型分子筛的生长.继续延长凝胶浓缩时间至2.5 h(溶剂含量38.65%),发现XRD谱呈现无定形物质的峰形,说明溶剂含量过低则无法合成SAPO-34.
在SAPO类分子筛的生长过程中,Si原子可能通过2种取代机制进入AlPO4,其中一种是1个Si原子取代1个P原子形成Si(4Al),从而产生带负电荷的骨架和相对弱的Brønsted酸中心(即SM2);另一种则是相邻的Al和P原子被2个Si原子双取代形成Si(nAl)(n=3~0)结构,导致形成更强的Brønsted酸中心(SM3)[20].从合成样品的元素组成(表2)来看,样品的(Si+P)/Al均大于1,表明SM2和SM3两种取代机制在SAPO-34的合成过程中都可能发生[21].

Fig.1 XRD patterns of samples C⁃0—C⁃2.5 and S⁃58.25 and the simulated one
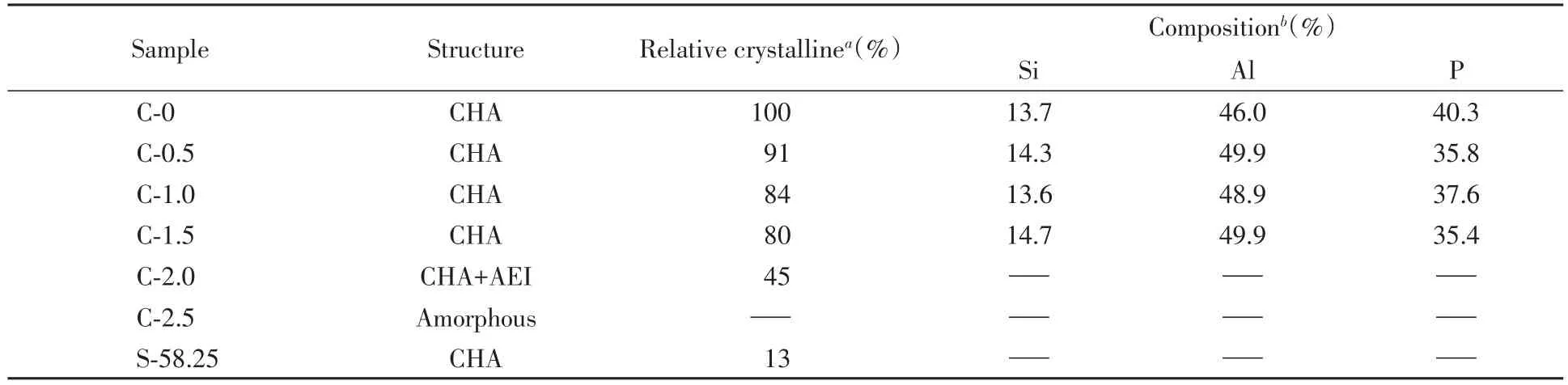
Table 2 Structure,crystalline and Si/Al/P molar ratio of the samples
2.2 溶剂含量对分子筛晶体形貌的影响
图2示出了SAPO-34晶体形貌随浓缩时间的延长而变化的过程.使用未经过浓缩的凝胶合成的SAPO-34呈现出粒径约为2 μm的立方体形貌[图2(A)],而当凝胶经过0.5 h浓缩再晶化后,产物晶体明显减小,呈粒径约800 nm的立方体[图2(B)].继续延长浓缩时间,产物晶体开始转变为长方体,其长、宽约为400 nm,厚度约为200 nm;当浓缩时间达到1.5 h时,浓凝胶中溶剂含量为58.25%,此时晶体继续减小,转变为厚度约为50 nm,大小约为200 nm的纳米片.从SEM照片中可以看出,产物中除了存在少量分散的纳米片,大部分是以数片纳米薄片堆叠在一起的聚集态存在的.由于继续延长浓缩时间后,生成的晶体结晶度很低(45%)且存在较多AEI型分子筛杂相,故在此不再研究其形貌特征.值得注意的是,为了更简单地获得C-1.5形貌的SAPO-34样品,我们尝试在配制前驱凝胶时,通过控制加入水的量而使其溶剂含量保持在58.25%,合成样品S-58.25.令人遗憾的是,采用该方法合成的SAPO-34相对结晶度只有13%(图1),这可能是由于在配制凝胶过程中,水量过少使得反应物无法形成均匀凝胶,最终使得反应不够彻底而存在大量无定形物质.

Fig.2 SEM images of samples C⁃0—C⁃1.5 with low magnification(A—D)and high magnification(A′—D′)
上述C-0到C-1.5形貌的变化说明,通过改变凝胶中溶剂的含量改变了分子筛的晶体形貌,并最终使用溶剂含量为58.25%的浓凝胶制备出了纳米片状SAPO-34.我们推断晶体尺寸的变化主要是由两方面因素决定的:一方面是在成核诱导期,浓凝胶中晶体生长的“营养物质”浓度较高,提高了无机合成原料和模板剂的碰撞频率,增强了其相互作用,使其快速产生了大量的晶核;另一方面,在随后的晶体生长阶段,由于缺乏液相,营养物质传输困难,导致晶体生长速度变慢,最终生成了纳米尺寸的分子筛[22,23].其晶体形貌的变化主要是由于浓凝胶体系下限制了晶体某一取向的生长,导致形成片状的晶体.
2.3 不同形貌晶体的吸附性能
为研究不同晶体形貌和颗粒大小对样品吸附性能的影响,对样品进行了氮气(77 K)吸附测试,并得出了比表面积、孔容和孔径分布等参数(图3和表3).C-0~C-1.5样品的吸附等温线均在低压区出现吸附量急剧上升的现象,属于典型的Ⅰ型吸附等温线,证明该样品中富含微孔,且微孔孔径分布均集中在0.375 nm[图3(B)].与C-0和C-0.5不同,C-1.0和C-1.5这2个样品的在高压区出现吸附曲线上扬和H3型滞后环,这是由于小颗粒晶体松散堆积形成了狭缝型介孔[24].图3(C)显示其介孔孔径分布在100~250 nm之间,证明形成的介孔并不规整,并且随着晶体颗粒的减小,其介孔含量也随之增加,C-1.5样品中介孔含量最大,达到0.21 cm3/g,占总孔容的36%[图3(D)].此外,浓凝胶体系转化有利于提高SAPO-34的微孔孔道的完善程度,从而导致微孔比表面的提升,同时晶粒尺寸的减小使其暴露出更多的外表面,最终使样品的比表面积(包括微孔比表面积和外比表面积)随着溶剂的减少而逐渐增加.C-1.5具有最大的微孔比表面积和外比表面积,分别为737.59 m2/g和80.46 m2/g,高于C-0(609.43 m2/g和24.06 m2/g),C-0.5(640.99 m2/g和36.75 m2/g)和C-1.0(645.74 m2/g和65.43 m2/g).
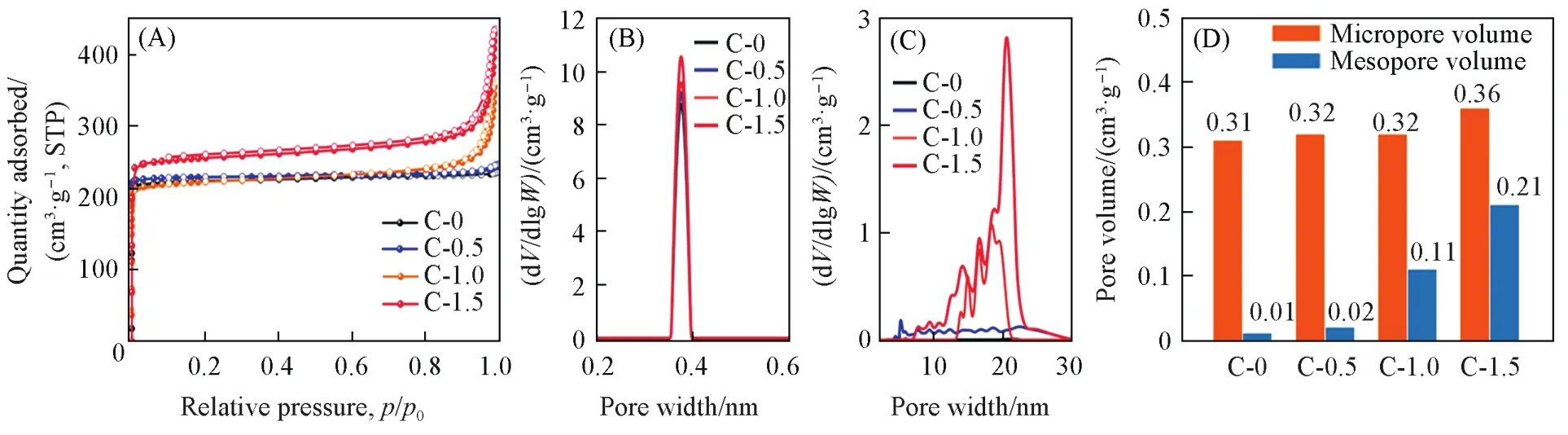
Fig.3 N2adsorption⁃desorption isotherms and pore distributions of C⁃0—C⁃1.5

Table 3 Specific surface area of different samples
上述表征结果说明纳米片状SAPO-34(C-1.5)比微米级的SAPO-34(C-0)具有更大的比表面积和孔容,预示着其在气体吸附领域具有较大的应用潜力.
2.4 纳米SAPO⁃34的CH4/N2吸附分离性能
煤层气作为储量丰富的非常规天然气,被认为是常规天然气的有效补充,因此备受关注.但由于抽采时混入空气导致其中存在大量的N2,降低了其燃烧热值,因此从N2中分离捕集CH4具有重要意义[25,26].CHA型分子筛的孔径为0.38 nm×0.38 nm,非常接近于CH4(0.38 nm)和N2(0.36 nm)的动力学直径,是分离CH4/N2的理想分子筛[27,28].Maple等[28]研究了SAPO-34对甲烷和氮气的分离作用,发现SAPO-34对CH4/N2的吸附比为3.2,在理论上具有良好的分离效果.
如图4(A)所示,从C-0到C-1.5,其CH4和N2的吸附量逐渐提高,这与比表面积和孔容的变化规律一致,因此推测吸附量的增加主要是由于分子筛晶粒尺寸减小后,其比表面积和孔容增加,为CH4和N2提供了更多的有效吸附空间.在298 K,101 kPa条件下,C-1.5具有最高的CH4吸附量(25.74 cm3/g),是C-0(15.87 cm3/g)的1.6倍,并且高于绝大多数分子筛吸附剂[29],这预示着C-1.5在变压吸附分离气体过程中对气体具有更大处理量,更具工业应用价值.
吸附热可表征吸附剂对气体的吸附能力的强弱.为了更好地研究气体在SAPO-34上的吸附行为,通过克劳修斯-克拉佩龙方程[式(1)]计算了CH4和N2在C-1.5和C-0上的吸附热[图4(B)].

式中:Qst代表吸附热(kJ/mol);R为气体常数;T为温度(K);p为压力(kPa);q为吸附量(mmol/g).C-1.5的CH4和N2的吸附热分别为20.99 kJ/mol和16.11 kJ/mol,略高于C-0的19.10 kJ/mol和13.72 kJ/mol,说明C-1.5对气体有更强的结合能力,这也与其具有更高比表面积和更多吸附位相符.
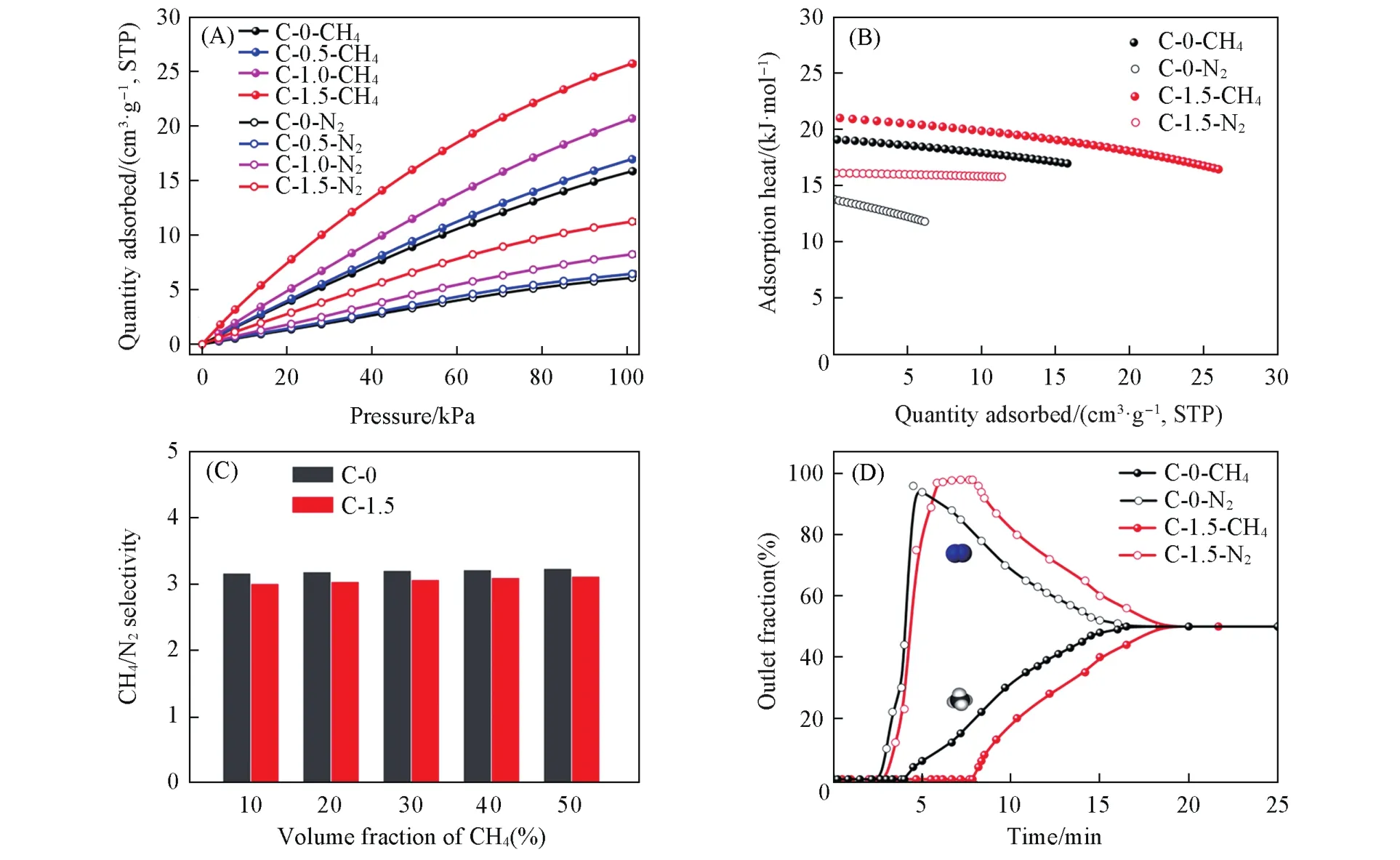
Fig.4 CH4/N2separation performance of C⁃0—C⁃1.5
为了评估样品对CH4/N2的选择性,基于测得的单组分吸附曲线,利用理想吸附溶液理论(IAST)对其不同CH4浓度下的选择性进行了计算.首先对单组分气体吸附曲线利用Langmuir方程进行拟合,方程如下:

选择性的计算方程如下:

式中,q代表吸附量(cm3/g);qm为饱和吸附量(cm3/g);p为吸附压力(Pa);b为Langmuir平衡常数;S为选择性;q1和q2为各组分在吸附质中的吸附量(cm3/g);p1和p2为其所对应的气体分压(Pa),具体拟合参数见表4.如图4(C)所示,不同CH4浓度(体积分数)时样品对CH4/N2的选择性基本保持不变,而在CH4浓度为50%时,C-1.5对CH4/N2的选择性为3.1,略低于C-0的3.2,但也达到了商用CH4/N2分离吸附剂的标准[30].

Table 4 Langmuir fitting parameters for CH4and N2at 298 K on C-0 and C-1.5
为了进一步检测样品对CH4/N2的分离能力,对其进行了混合气体穿透实验(CH4/N2体积比1∶1,298 K).如图4(D)所示,两种吸附剂上N2的穿出时间均早于CH4,说明在CH4和N2共吸附的状态下,竞争吸附更有利于CH4,即CH4的吸附量大于N2,使CH4/N2可以被有效分开,这一结果也与上文中的吸附等温线、IAST选择性和吸附热结果吻合.显而易见,保留时间(N2与CH4的穿透时间之差)越长,吸附柱中所吸附的CH4的含量越高,脱附出的产品气中CH4的浓度也越高,因此保留时间是衡量吸附剂分离效果的重要指标.C-1.5的保留时间为4.7 min,几乎是C-0的2倍,说明前者具有更好的CH4/N2分离效果(表5).通过穿透曲线计算了吸附剂的产品气纯度和气体处理能力,其计算方法如下:
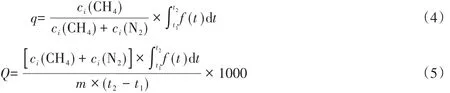
式中,q代表脱附气中CH4浓度(体积分数,%);Q代表吸附剂气体处理能力(L·kg-1·min-1);ci是吸附质在混合气体吸附相中的浓度(%);f(t)为穿透曲线;t2-t1为穿透进行时间(min);m代表吸附质质量(kg).计算结果表明,纳米SAPO-34经过一次穿透能将CH4含量50%的混合气体提纯到62.65%,高于常规的SAPO-34(59.35%). 而且C-1.5还具有更高的气体处理能力(0.35 L·kg-1·min-1),高于C-0的0.30 L·kg-1·min-1,这说明在单位质量和单位时间下纳米SAPO-34能够处理更多的原料气体,更有利于实际应用.
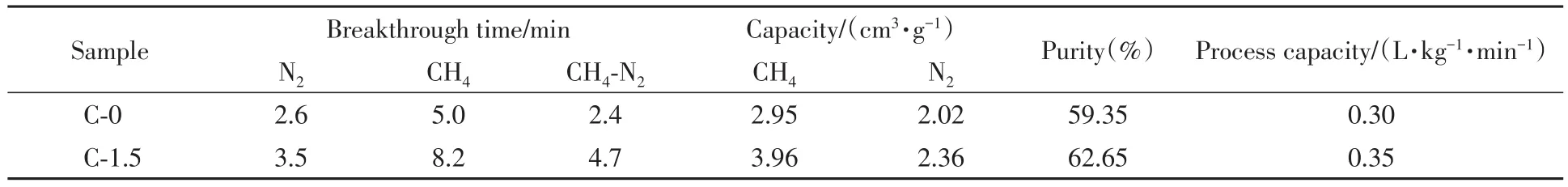
Table 5 Mix gas breakthrough parameters for C-0 and C-1.5
3 结 论
采用浓凝胶转换法合成了形貌均一、厚度约为50 nm的纳米片状SAPO-34分子筛,并通过改变前驱凝胶中溶剂的含量实现了对分子筛晶体成核与生长过程的调节.相比常规的微米级SAPO-34,该方法制备的纳米SAPO-34具有更高的比表面积和孔容,分别为818.68 m2/g和0.57 cm3/g,其CH4吸附量达到了25.74 cm3/g,CH4/N2选择性为3.1,是一种具有高选择性和气体处理能力的CH4/N2分离吸附剂.该合成策略为纳米SAPO-34分子筛的制备提供了新思路,可为其在CH4/N2吸附分离领域的应用提供参考.
