原位冷冻电子断层扫描的发展及在生物研究方面的应用
2020-11-13赵关芳邹天一程思航王慧利王宏达
赵关芳,邹天一,程思航,于 洋,王慧利,王宏达
(1.中国科学院长春应用化学研究所,电分析化学国家重点实验室,长春130022;2.中国科学技术大学,合肥230026)
对生物大分子结构的研究对于全面了解其生物学功能至关重要,尤其是对结构的可视化对于其功能的理解很关键.而传统研究生物大分子通常采用“还原论”或“分而治之”的方法:将生物大分子进行分离纯化,并通过结构生物学的方法研究纯化的成分[1].X射线晶体学(X-ray crystallography)[2]、核磁共振(NMR)[3]以及可原位成像生物样品的单分子成像技术[如原子力显微镜(AFM)和单分子荧光显微镜(SMFM)][4,5]成为20世纪研究生物大分子的主要技术.其中,X射线晶体学常被用来确定生物分子的高分辨率结构,通过该方法已经得到了多种蛋白和核酸的原子模型[6,7].但是,该技术只能确定可以结晶的生物分子的结构,不能用来确定无法结晶或者难以结晶的样品的结构.单分子成像显微镜可以在原位生理环境中对生物样品进行成像,如本课题组[8,9]通过AFM从细胞膜两侧系统地分析了原位细胞膜结构,提出了新的细胞膜模型,为研究细胞膜的结构和功能提供了新的见解.而通过SMFM能以很高的信噪比可视化样品中目标分子的分布,同时保留了目标分子在生理环境中的关键特征.如通过SMFM原位表征活细胞中细胞膜上的单个蛋白等生物分子的分布特征[10,11].然而,由于单分子成像显微镜的分辨率较低,虽然可以通过该方法对生物分子进行原位成像,但无法可视化生物分子的三维结构.对于生物系统来说,大多数的生理功能是多种不同生物分子相互作用的结果[12].而且生物分子的结构形态和生理功能的执行严格依赖其所处的生理环境,在保持生物分子结构完整性的情况下不可能将其从所处生理环境中分离纯化出来.因此,以高分辨率表征生物分子在其原位环境中的三维结构特征对于了解其功能具有重要的生理学意义.
冷冻电子断层扫描(cryo-ET)[13]适用于冷却至低温并嵌入玻璃态冰中的样品而不需要使样品结晶,是唯一能够在原位生理环境中直接以多种构象可视化生物分子三维结构的成像技术[14].电子断层扫描(ET)是获取样品三维结构常用的方法,即通过以一个固定的角度间隔将样品倾转一定的角度(通常为—60°~+60°),用电子显微镜(EM)获取样品的投影图像.在cryo-ET中,通过旋转样品可以得到不同角度的二维投影图并对其进一步重构处理生成三维的断层图.该断层图就是包埋有样品的玻璃态的冰.然后,可通过识别并分割该断层图中感兴趣的目标样品,或通过提取并平均多个同种目标样品以获得该样品的中高分辨率的结构[15].近年来,随着硬件技术的进步(电子检测器技术、相位板、能量过滤器等)与样品制备技术的改进,cryo-ET才逐渐得到了广泛应用[16~18].此外,cryo-ET也是一种强大的无需标记的成像技术,依靠生物样品固有的质量密度,可以得到生物结构的全面电子密度图像,因此可对原位的细胞或者细胞内部以纳米级分辨率进行成像,从而保留每个生物结构的构象以及其与其它生物分子相互作用的完整信息.而样品制备技术的改进使得cryo-ET可对多种生物样品进行成像.目前已经利用cryo-ET研究了一系列的生物样品,例如分离的细胞器[19,20]、病毒[21]、细菌[22]、真核细胞[23]和组织切片[24]等.自动化数据收集软件的发展(serial EM)显著提高了cryo-ET数据的收集效率.强大的数据处理工具的出现和计算方法的改进将目标样品结构的分辨率极限提高到了亚纳米水平,如模板匹配(template matching)[25]、衬度传递函数(CTF)校正[26]、子断层图平均(sub-tomogram averaging)和分类[27,28].这使获得的目标样品的结构能够准确反应出其原位环境中的生理构象.
本文从样品制备和数据采集处理与分析等方面综述了与cryo-ET相关技术和方法的进展,总结了cryo-ET在生物研究中的应用并讨论了cryo-ET的主要挑战及最新进展.
1 Cryo-ET成像流程
1.1 样品制备
一直以来,用于EM成像的生物样品必须进行化学固定、脱水和染色.虽然这些步骤对于稳定生物样品的状态并提供较好的样品衬度是必要的,但会严重破坏并改变生物样品的超微结构和分子组织.因此,近几十年来EM一直无法达到X射线晶体学或NMR的分辨率.然而,随着快速冷冻样品保存方法的出现,这种情况发生了改变,即蛋白质水溶液或整个细胞经过快速冷冻可生成非晶冰而不是结晶冰[29,30],再通过cryo-ET即可以高分辨率观察近生理环境中冷冻水合状态的生物样品.目前用于制备cryo-ET冷冻样品的方法有3种:快速冷冻(PF)[图1(A)][31,32]、喷射冷冻(JF)[33]和高压冷冻(HPF)[图1(B)][34].其中,PF是最常用的技术,因为它不仅与蛋白质复合物、分离的细胞组分以及整个细胞都兼容,而且可以完全自动化[35,36].HPF则适用于一些较厚或较大的样品,如多细胞生物或组织,可以使厚度为200 μm的样品形成玻璃态[37].
Cryo-ET成像的一个主要限制因素是样品厚度.受限于电子的透过能力,cryo-ET对生物样品进行成像的厚度极限为0.5~1 μm,太厚的样品很难获得高分辨率数据[38].因此,最严格意义上的原位cryo-ET,即完整生理环境中的冷冻电子断层扫描,仅限于足够薄的生物样品,如原核生物或真核细胞的外围部分等.此外,在cryo-ET成像过程中,随着样品倾转角度的增大,样品厚度会明显增加,这进一步限制了cryo-ET成像的分辨率.因此,在大多数情况下,需要将生物样品削薄以满足cryo-ET对样品进行高分辨率成像的要求.
通过机械切片来减薄冷冻样品早在1950年代即已奠定了基础,但是很久以后才实现了更多的常规应用.基于玻璃体切片的冷冻电子切片(CEMOVIS)技术的发展使cryo-ET首次观察到了近似处于天然状态的细胞.但是,该技术对操作人员的手动操作能力要求较高,而且通过该技术得到的样品质量也较差(如外力导致的截面弯曲、划痕和样品压缩)[39,40].这些因素导致CEMOVIS在cryo-ET高分辨率成像上的应用受到了限制[39][图1(C)].为了克服这些问题,可以采用聚焦离子束(FIB)铣削这种来自材料科学的方法,制备适用于cryo-ET成像的样品[41~43][图1(D)].FIB铣削在配备用于成像的扫描电子束和用于烧蚀材料的离子束(例如氦、镓)的双束显微镜上进行.当FIB铣削配备有氮气温度下运行的专用平台时,可以利用这些系统的高精度来制备适用于cryo-ET高分辨成像的生物样品.使用FIB铣削,可以制备具有不同几何形状(“楔形”或“薄片”)和厚度(<200 nm)的无变形的样品[44].此外,双光束SEM的精确成像特性可对细胞的组分进行相关成像并精确定位与生物学问题相关的目标区域,从而提高样品通量.FIB铣削不仅可制备分离的细胞薄片,还可制备组织和多细胞生物的薄片[45~47].
1.2 数据采集处理与分析
样品制备技术的改进极大地促进了cryo-ET的应用,EM硬件的改进可将ET的分辨率提升到亚纳米水平.单颗粒分析(SPA)和cryo-ET密切相关,因此有许多共同的概念.最近的“分辨率革命”[50]将SPA的分辨率提升到X射线晶体学和NMR水平,其本质上是仪器硬件领域的一场革命.这包括能显著改善显微镜的稳定性的硬件设备(如透镜、样品架)以及能去除非弹性散射电子的能量过滤器[图2(A)],这些电子对高分辨率信息没有帮助.然而,更重要的是,直接电子检测器(DED)[51]的出现显著提高了数据质量.与传统的电荷耦合检测器(CCD)相比,DED的灵敏度显著提高.此外,DED还具有更快的帧读取速度,可以在图像采集过程中校正电子束引起的样品移动[52].同时,DED灵敏度的提高可以降低每个角度投影的电子剂量,从而可以总体降低整个倾转系列中的电子累积量.通常,SPA采集数据的每个位置曝光的电子总剂量为20~60 e/Å2(1Å2=0.01 nm2);但在cryo-ET中,通过绕轴旋转(通常以固定步长从±60°到∓60°)[图2(B)]来获得样品在每个角度上的投影图[图2(C)]. 因此,需要在整个倾转系列上合理分配样品可以承受的电子剂量,以避免辐射损伤.为了在整个倾转系列上合理分配样品可承受的电子剂量,根据对数据要求的不同,研究者提出了几种不同的样品台倾转方式(单向旋转、双向旋转和对称旋转).因此,相比于SPA成像收集的数据,cryo-ET成像收集的数据中每个角度的图像承受的电子剂量更低,衬度更低,信噪比(SNR)较差.若样品不经过染色等过程会导致其在cryo-ET成像过程中SNR较差,因此需要通过调整散焦值来提高样品的SNR,但是调整散焦值会降低cryo-ET收集数据的分辨率,并且需要通过CTF校正散焦对cryo-ET图像的影响[53].因此,为了提高cryo-ET图像的SNR,可在cryo-ET成像过程中插入相位板[54],尤其是电压相位板(VPP),在成像过程中会显著提高样品的衬度和SNR,在SPA成像和cryo-ET成像领域均显示出巨大的潜力.通过相位板增强样品的衬度和SNR对于cryo-ET成像尤为重要,因为它不仅可以用来确定小分子(<100 kDa)的结构,而且无需校正调整散焦值对图像带来的混杂效应[55].
随着计算机算法的快速发展,研究人员研发了各种算法和程序用来重构和处理cryo-ET数据(如IMOD和TOM等)[57~59].在cryo-ET数据的重构过程中,首先需要对倾转系列中每个角度的投影图进行对齐.通常是追踪在样品快速冷冻前吸附在样品上的高密度基准标记(如金纳米颗粒)来对齐倾转系列中各个角度的投影图.但是这些高密度基准标记不仅无法应用在FIB切割的薄片上[46],而且可能会降低样品的质量或损害样品的完整性.因此,在此情况下可以使用碎片追踪的方法来对倾转系列中的图像进行对齐,该方法将倾转系列中的图像分割成碎片,然后计算不同图像中碎片的互相关性以校正图像间的相对位置来进行对齐.因此,这种方法通常不如基准标记追踪精确,尤其是在倾转系列中倾转角较高或图像的SNR太低的情况下,碎片追踪可能容易出错,这会严重影响重构后图像的分辨率.倾转系列中的图像对齐后,可以使用直接傅里叶反演来重构生成断层图像.除了傅里叶合成外,还有几种用于重构的迭代算法,如同时迭代重建技术(SIRT)或同步代数重构技术(SART)[60,61].但是,cryo-ET数据重构最常用的算法是非迭代加权反投影(WBP),因为它可以最大程度地保留样品的高分辨率信息[图2(D)].通过WBP重构得到的三维的断层图非常精细,可以手动或半自动标记断层图中较大的感兴趣的目标结构(如膜或细胞器).

Fig.2 Principles of data collection and processing in cryo⁃ET[14,56]
在对cryo-ET数据进行三维重构生成断层图后,需要对断层图中目标结构进行识别和挑选.对于较大的分子复合物(如核糖体和蛋白酶体)来说,在断层图中很容易被识别,可手动识别并标注其位置.但是这种方法不适用于较大的数据集,因此,为了批量处理较大的数据集,研究人员研发了一些功能强大的全自动图像处理算法,这些算法可根据目标分子的结构特征和大小自动识别和定位断层图中的目标分子.对于通过cryo-ET成像的纯化大分子,可使用模板匹配的算法快速识别定位断层图中目标分子(如pytom)[图3(A)][62,63]. 模板匹配是在断层图中搜索定位目标分子复合物的计算方法[64],使用目标分子的已知结构信息(如晶体结构、分子的粗糙形态或已知的结合分子的结构)通过低通滤波来创建用于自动识别并拾取粒子的模板.此外,也可通过断层图直接生成模板.模板匹配算法是将创建或生成的目标结构的模板与断层图中的每个位置进行比较,该算法通过运行互相关计算会生成模板与断层图中每个位置的一个互相关值,因此断层图中的每个像素点都会得到一个对应的相似度得分.然后,可从断层图中提取与高相似度分值相对应的子断层图,并在进一步分析前手动对这些子断层图进行筛选,以消除明显的假阳性结果[63].然而,对这些子断层图进行分类比较困难.尽管模板匹配的算法可以手动清除明显的假阳性的子断层图,但在处理尺寸较小、特征比较差的异质性颗粒数据集时结果通常不理想.对于这种更复杂的断层图,可以使用基于卷积神经网络(CNN)[图3(B)][65]的断层图标记工具来识别目标结构特征(如EMAN2)[66].这种神经网络只需很少的人为训练即可学习各种可能的目标结构特征类型,且其本身的结构是固定的.一旦对CNN进行了训练以识别某个特征,就可以将其用在通过相似的成像条件得到的断层图中以识别标记相同的特征而无需额外的训练.因此,这种神经网络可以轻易区分结构的细微差异,如线粒体的双层膜与其它细胞器的单层膜.该算法主要应用在延伸的细丝(如微管蛋白或肌动蛋白)、膜(弯曲/平面)和呈周期排列的或孤立的大分子等类型的断层图中.随后,可从每个断层图中提取CNN识别标记的特定特征的子断层图.近年来,深度学习神经网络因其强大的功能而得到广泛应用[67].但是,对于膜蛋白等很多与膜相关的处在原位的生物分子,由于它们之间存在相互作用且处在较复杂的的生理环境中,故对这些生物分子在生理环境中的检测和精确定位变得更加困难.对于这种样品,可以使用一种无模板的图像处理软件(Pyseg)[图3(C)][68]来识别定位断层图中的目标分子,它改编并扩展了基于离散摩尔斯理论(discrete Morse theory)的现有分割方法,能精确追踪断层图中电子密度的复杂网络并自动检测和定位生物分子的位置;且该软件中的算法还可以定位原位环境中尺寸比较小的生物分子,这些小分子的尺寸远远小于模板匹配的极限.此外,由于没有模板,该软件还可以识别并定位异质性或处在不同组成和构象状态的分子复合物.而基于随机采样选点或深度学习的无模板采样方法仅适用于比较大的分子复合物,且在模拟和真实数据集上均无法达到该软件所能达到的分辨率.综上所述,对于不同的数据可以采用不同的软件和方法在断层图识别和定位感兴趣的目标分子,并将这些目标分子所对应的子断层图提取出来[图2(E)].随后就可以通过角度搜索[63,69,70]或快速旋转匹配(FRM)[71]等方法对这些子断层图进行迭代对齐. 每次迭代过程都会对子断层图中的目标分子进行平均,从而相对于各个子断层图提高目标分子的SNR.
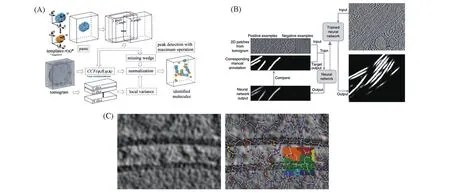
Fig.3 Procedures to identify structures of interest in tomograms
通过子断层图的对齐和平均生成高分辨率分子结构的方式有2种:传统的子断层图对齐和平均[72,73]以及每个目标分子和每个倾转角度的精确细化.传统的方式利用的是现有的子断层图对齐和平均的算法.对齐的算法采用的是一种可以很好地适应颗粒尺寸变化的非常有效的分级分层的方法.整个分子结构细化的过程采用类似于SPA中的“gold-standard”算法[74],并使用傅里叶壳相关(FSC)评估得到的分子结构的分辨率和测量迭代过程间的收敛程度.这些算法已经运用在了Relion中.而另一种方式则不使用子断层图,而是使用子倾转系列.当整个倾转系列对齐时,我们假设每个倾转角度的图像都是刚体的投影.考虑到电子束引起的样品移动、电荷和辐射损伤所带来的影响,要使样品在1 μm的跨度内保持整体刚度一致是非常困难的,而且最大可接受的样品移动偏差要<1 nm.对于生物样品来说,局部移动偏差很常见,并且这些移动偏差很可能会导致研究对象在各个倾转角度的图像内未对齐.为了消除这种影响因素,研究者们开发了一种对每个倾转角度中每个目标分子进行细化的算法,其中对每个倾转角度中的每个目标分子的对齐都进行了单独的细化并对每个目标分子的质量进行评估.实际上,这种方法是子断层图平均与传统SPA的相结合的产物,其中的一些技术已经运用在了EMClarity中[75].
通常,SPA处理的样品非常均一,而原位的cryo-ET由于具有更大程度的可变性和更复杂的背景干扰,可能更具有挑战性.由于目标分子处在原位环境中,因此cryo-ET在成像过程中可能会检测到目标分子大量不同的构象或状态,所以需要将目标分子分成更多的类.自动对焦的三维分类[63]可以无差别的对断层图中的目标分子进行分类,并可分辨目标分子中不同功能或组装状态的细微结构差异.目前,已经开发了一些软件包,这些软件包集成并简化了模板匹配、子图平均和分类等流程.
尽管取得了上述进步,但cryo-ET成像的分辨率通常比SPA低.目前,只有少数原位cryo-ET对样品的成像能够达到亚纳米水平.但是,通过为每个检测到的目标分子提供其在原位环境中的信息,可以弥补这种较低的分辨率带来的不足.由于cryo-ET成像技术的分辨率跨越了很大的空间数量级范围,因此可以与低分辨率的成像技术结合使用(如荧光显微镜).综上所述,随着有关cryo-ET数据处理的算法和软件的发展,cryo-ET不仅可以表征目标分子在其原位环境中的分布状态和特征,而且可以获得目标分子在其原位环境中的高分辨率的三维结构.
2 Cryo-ET在生物学上的应用
Cryo-ET特别适合以分子分辨率研究天然可变或高度复杂的生物分子结构,特别是表征某些异质性的超分子组装体、多型病毒、细胞器和细胞组分,或表征完整的细胞和组织.
SPA可以用于研究纯化的生物分子,使其达到亚纳米级的分辨率.但是,该方法需要成千上万个相同生物分子的平均,因此不能应用于具有独特结构的大分子.在此情况下,cryo-ET是一种可选择的技术,因为它能以几纳米的分辨率直接提供单个大分子的三维图像.如,通过cryo-ET研究进化趋异的生物和人类患者中与疾病相关的内质网转运蛋白相关蛋白(TRAP)复合物突变的纤维细胞中的天然转座子的结构,揭示了中心易位子组分的分子结构,增加了我们对膜蛋白的了解,并阐明了TRAP在人类先天性糖基化疾病中的作用[76].此外,已有报道[77]通过cryo-ET研究分离的轴突提出了正常的和引起原发性睫状运动障碍的RSPH1突变型人类呼吸道纤毛的天然三维结构,并揭示了RSPH1突变型纤毛中先前未知的初级缺陷和异质次级缺陷.这极大地加深了对纤毛和鞭毛运动以及动力蛋白在此过程中作用机理的了解.纯化制剂与全细胞断层成像的结合特别有效,通过cryo-ET成像和模板匹配的方法来表征70S核糖体揭示了分离的核糖体、休眠核糖体的二聚体和活性多核糖体的空间组织以及在细胞中的精确定位[78][图4(A)].
Cryo-ET已被广泛应用于多型病毒的研究,如对包膜病毒(例如牛痘、单纯疱疹、流感或人类免疫缺陷病毒)的结构与功能的研究.大量的工作揭示了病毒外壳的结构特征及糖蛋白峰、病毒包膜、基质和核糖蛋白之间的相互作用.如通过cryo-ET成像和子断层图平均确定了完整病毒和重组核衣壳样装配体内的埃博拉病毒核衣壳的结构[79];而且还通过cryo-ET和CTF校正的子断层图平均研究了组装的未成熟的HIV病毒的主要蛋白Gag晶格的结构.子断层图平均在该领域具有广泛的应用,将cryo-ET的分辨率降低至了2 nm以下[80][图4(B)].此外,cryo-ET快速成像提出了一种新的病毒与宿主膜融合的模型,直接成像了血凝素的结构中间体及其在膜融合过程中与膜相互作用的过程,以及伴随膜融合过程中的病毒的超微结构变化,揭示了病毒体的内在化,并阐明了如何通过cryo-ET快速成像研究动态膜过程[81].
Fig.4 Some biological applications of cryo⁃ET
虽然大多数真核细胞很厚以至于无法通过cryo-ET进行完全研究,但是,从细胞或组织中纯化出来的真核细胞器通常足够薄可以直接进行cryo-ET成像.如利用cryo-ET直接研究来自李氏综合征患者和正常人的培养成纤维细胞中的线粒体.通过对患者和正常人的线粒体的cryo-ET成像对照分析,发现ATP合成酶二聚体的损失会导致线粒体cr超微结构的严重紊乱,揭示了ATP合成酶在调节线粒体cr结构中起到的关键作用[20].此外,还通过cryo-ET成像技术与其它技术的结合获得了迄今为止人类核孔复合体最完善的三维模型[82].
诸如突触小体(保留大部分功能特征的神经末梢)之类的细胞部分也可以在快速冷冻后直接通过cryo-ET进行研究.突触小体的cryo-ET成像分析揭示了突触间隙中存在的复杂的复合物,并揭示了突触前细胞基质的结构及其在神经递质释放中的作用[83].对通过进一步分离突触小体获得的突触小泡进行cryo-ET成像,揭示了新的内吞突触小泡的网格蛋白皮层的拓扑结构以及皮层与小泡之间的相互作用.此外,由于神经元细胞可以吸附在多孔碳膜支撑的金网上并铺展开来,样品厚度满足cryo-ET成像的要求,所以将cryo-ET与荧光显微镜联用研究了海马神经元完整的兴奋性和抑制性突触,并直接观察了处于原位状态的突触和大分子的三维结构,提出了兴奋性和抑制性突触超微结构的更新的观点[84][图4(C)].
某些黏附的真核细胞外围的厚度也满足cryo-ET成像的要求,如可以详细分析片状脂蛋白和丝状伪足中的肌动蛋白的骨架组织,并研究其在细胞黏附中的作用[85,86].此外,还通过CEMOVIS对诸如肝脏、大脑或皮肤等哺乳动物组织进行了研究,但是与该技术有关的困难和外力造成的伪像使其无法广泛应用于组织样品.
Cryo-ET可以相对容易地应用于原核细胞.许多细菌都足够薄,可以在快速冷冻后通过cryo-ET直接成像.大量研究已经提供了有关细菌膜组织、内部隔室、化学受体阵列或鞭毛运动的详细结构解析.如通过cryo-ET和子断层图平均得到了新月形芽孢杆菌的表层蛋白的结构,并达到了0.74 nm的分辨率,该结构与通过X射线晶体学得到的结构一致.这项研究将X射线晶体学与cryo-ET以及亚纳米分辨率的子断层图平均相结合,跨越了从原子到细胞的不同空间尺度[87].此外,cryo-ET还可与定量质谱结合用于检测、计数和定位人类病原体钩端螺旋体细胞质内特定的蛋白质复合物,描述了视觉蛋白质组学的一种新颖的评分功能,并在实际条件下评估了这种评分功能的性能和准确性,为鉴定和定位完整细菌内部的大分子提供了验证标准[图4(D)][88].
3 总结与展望
以往,降低样品复杂性可能是获得大分子复合物高分辨结构的必要步骤,但样品制备、数据处理以及硬件方面的最新改进使原位cryo-ET得以广泛应用,致使我们在成像过程中会获得更多关于样品细节的信息.此外,由于采用了更先进的样品制备技术(如FIB铣削),样品的纯化和分级分离已不再是必要的步骤.因此,可以在同一原位生理环境中以高分辨率对不同的生物分子及其相互作用的整个网络进行建模.尽管目前已经取得了以上进步,但cryo-ET仍有进一步的改进空间.
由于DED相机的发展在很大程度上提高了成像的分辨率,因此对其进一步的改进似乎更为重要.更高的相机像素密度、灵敏度及更快的帧读取速度,将会进一步减少样品的辐射损伤进而保留样品的更多高分辨率信息.同时,硬件仪器的进步将需要对控制显微镜和执行图像处理的软件进行改进.最近,Hagen等[89]提出了新的样品台倾转方案,该方案可在低倾转角附近对称地分配电子剂量,这进一步减少了电子束对样品的损坏,并可显著改善所得断层图的数据质量和分辨率.但是,对于子断层图平均,限制分辨率的主要因素仍然是图像对齐.为了进一步提高分辨率的极限,需要提出对齐倾转系列图像的新方案,例如可引入渗透进入细胞的纳米颗粒作为基准标记的物理方案,或研发可用于单个倾转角度图像降噪的软件.随着软件和硬件的不断进步,原位cryo-ET的使用范围将更广泛,并将在接近原位的条件下提供更完整的细胞整体图像.
