三峡库区2种马尾松混交林土壤团聚体酶活性分布特征
2020-11-13肖文发曾立雄黄志霖简尊吉倪妍妍
雷 蕾,肖文发,曾立雄,*,黄志霖,简尊吉,倪妍妍,李 晖
1 中国林业科学研究院森林生态环境与保护研究所 国家林业和草原局森林生态环境重点实验室,北京 100091 2 南京林业大学南方现代林业协同创新中心,南京 210037 3 三峡植物园管理处,宜昌 443631
土壤酶作为有机质分解、周转和矿化的主要生物催化剂[1],是土壤中碳、氮、磷等养分循环的重要参与者[2]。不同的土壤酶参与不同的生态化学过程,如广泛研究的β-葡糖苷酶(β- glucosidase,BG)主要参与碳循环,水解纤维素,释放葡萄糖[3],N-乙酰-葡糖苷酶(N-acetyl-glucosaminidase,NAG)主要参与氮循环,分解几丁质[4],酸性磷酸酶(Acid phosphatase,AP)则主要影响无机磷的产生,催化水解有机磷转化为无机磷[5]。土壤酶受多种因素的影响[1,6-7],且对生态环境系统的变化非常敏感,其活性的改变可直接引起土壤群落代谢过程和可利用养分的变化[8-9],进而影响养分循环和植物生长,是评价土壤地力变化的重要指标[4,10]。而土壤团聚体是土壤结构的基本单元,通过控制不同粒径团聚体有机质的可接触性、微生物群落组成、水分等因素直接影响着土壤酶的活性[11-12]。团聚体分布及其土壤酶活性的高低能够较未进行土壤团聚体分级的混合土壤更为有效、快速的反映土壤养分循环的变化[12- 14]。因此,了解团聚体酶活性变化特征,对掌握土壤养分变化和地力维持能力具有重要的指示作用。
马尾松(Pinusmassoniana)是我国人工林排名第3位的优势树种,主要分布在南方15个省(区),面积达220万hm2[15],也是三峡库区分布面积最大的森林类型[16]。缘于三峡库区复杂的地形及其所导致的自然气候特征的巨大空间分异性,以及强烈人为干扰和长期相对落后的经济社会发展水平,本区域马尾松林经营粗放,林分结构较差,低产林大面积存在,如何有效提高马尾松地力和生产力对于本区域森林经营十分重要。鉴于土壤团聚体酶活性对于环境变化、植被组成的敏感性[11-12,14],从土壤团聚体微生境分析不同马尾松森林类型酶活性特征,对于深入探索不同马尾松林地力和生产力差异具有重要意义。然而,目前本区域马尾松林的研究多集中于混合土壤养分及其酶活性[15]、土壤碳排放[17-18]、凋落物分解[19]等方面,土壤团聚体分布及其酶活性变化特征仍待解答。本研究以三峡库区分布面积最广的马尾松杉木混交林和马尾松杉木栎类混交林为研究对象,分析不同马尾松混交林类型表层土壤(0—10 cm)团聚体分布特征及其酶活性的分布特征,以期为深入认识不同马尾松混交林地力差异和制定营林措施提供科学依据和基础数据。
1 研究区概况
研究地点位于湖北省秭归县(30°38′14"— 31°11′31"N,110°00′14"—111°18′41"E),海拔156—2030.6 m,年均气温16.9℃,年降水量1000—1250 mm,多集中于4—9月,属于亚热带大陆性季风气候。土壤类型以黄壤、黄棕壤为主[15]。选取本区域典型马尾松杉木混交林(MS)和马尾松杉木栎类混交林(MH)为研究对象(其中MH混交林中栎类树种主要为短柄枹栎(Quercusserratavar.brevipetiolat)、栓皮栎(Quercusvariabilis)),分别设置3个20 m×20 m样地进行调查,共设置样地6个,样地基本情况见表1。调查样地内灌木主要有火棘(Pyracanthafortuneana)、胡枝子(Lespedezabicolor)、微毛柃(EuryahebecladosLing)等,草本主要有狗脊(Woodwardiajaponica)、鱼腥草(HouttuyniacordataThunb.)、苔草(Carextristachya)等。
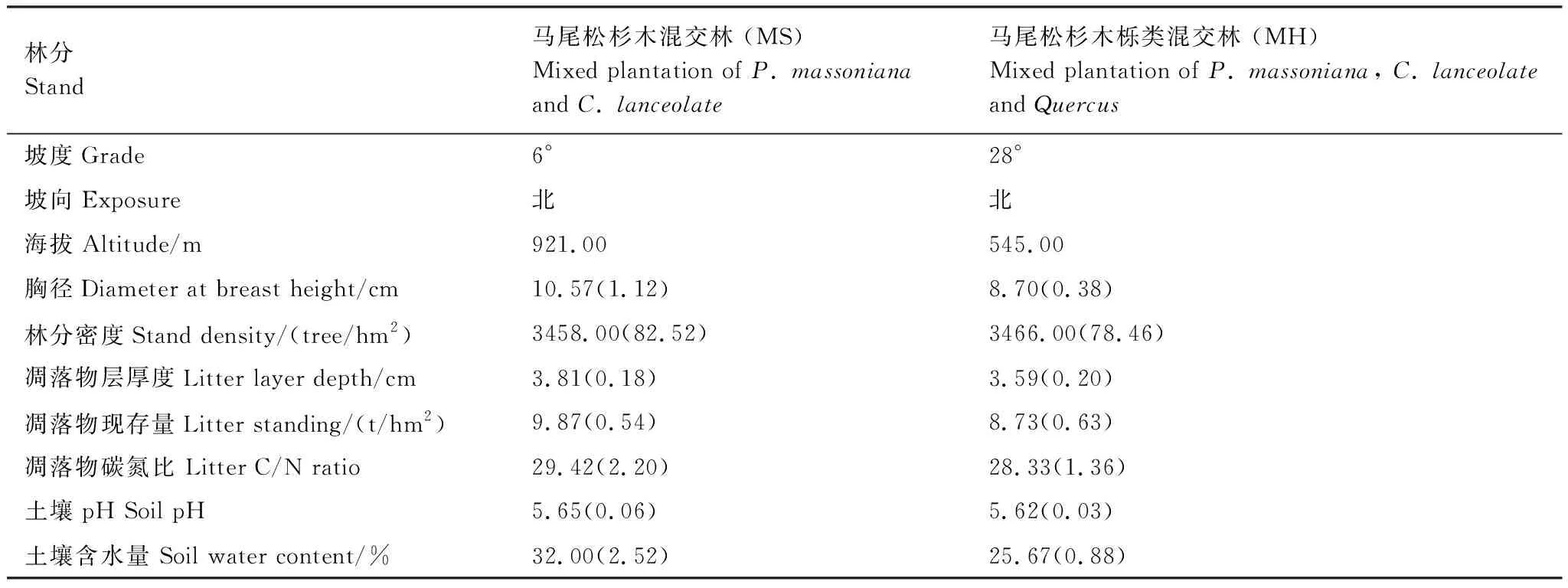
表1 样地概况
2 研究方法
2.1 土壤样品采集与土壤团聚体筛分
2017年8月,在2种马尾松混交林的每个固定样地内(每种林型3个固定样地,共计6个固定样地)按照“S”形随机设置9个1 m×1 m的观测小区使用直径6 cm的PVC管对观测小区内0—10 cm土壤采取5个原状土。采样后12h内带回实验室,按照土壤纹理轻柔掰开,去除可见的根系和石砾,过8 mm筛并将同一样地样品混合。为减少对土壤酶活性的影响,采用Dornodnikov等[20]改良的干筛法进行土壤团聚体的筛分。将过8 mm的鲜土,每次称量500 g,采用AS200震筛仪(德国莱迟公司)2 mm,0.25 mm土壤筛以振幅1.5 mm震动3min,根据筛分粒径,将土壤团聚体从大到小分为大团聚体(>2 mm),中团聚体(0.25—2 mm)与微团聚体(<0.25 mm)3个等级[20],并对各级团聚体进行称重,用于计算各等级分布。
2.2 土壤有机碳、全氮与酶活性测定
筛分后的各团聚体土壤一部分风干后通过重铬酸钾外加热法测定土壤有机碳(Soil organic carbon,SOC)[21],凯氏定氮法测定全氮(Total nitrogen,TN)[22];一部分存于4℃冰箱,于两周内进行土壤酶活性的测定。土壤酶活性测定方法:把相当于1 g干土的土壤样品加入至125 mL醋酸钠缓冲液(50 mmol/L,pH=5.5)中,在搅拌机中处理1min制成均质土壤悬液[23- 25],加入不同酶底物进行培养测定,底物、测定波长等信息详见表2。本研究共测定了7种参与碳氮磷循环的酶活性,5种水解酶活性采用荧光微孔板方法,25 ℃暗中培养3 h后采用酶标仪(PerkinElmer Enspire,USA)进行测定[23-24];2种氧化还原酶活性采用比色法,其中,过氧化物酶通过添加底物L- 3,4-二羟基苯丙氨酸(L- 3,4-dihydroxyphenylalanine,DOPA)和过氧化氢(浓度:3%)测定[1],氧化还原酶均室温震荡暗中培养1h后,采用酶标仪进行测定[24- 25]。土壤酶活性的几何平均数[26-27](Geometric mean,GMea)可用来综合评价土壤酶活性指标,计算公式为:
式中:EBG为β-葡糖苷酶;ECB为纤维二糖水解酶;ENAG为N-乙酰-葡糖苷酶;ELAP为亮氨基酸氨基肽酶;EAP为酸性磷酸酶;EPOX为酚氧化物酶;EPER为过氧化物酶。

表2 测定土壤酶种类、功能以及相应的测定底物
2.3 数据统计分析
利用单因素方差分析(one-way ANOVA)检验不同等级土壤团聚体酶活性、有机碳、全氮的差异(P<0.05),利用独立样本t检验对比不同马尾松混交林同等级团聚体土壤酶活性以及土壤有机碳、全氮的差异,利用Pearson分析团聚体有机碳、全氮与土壤酶活性的相关性。所有分析处理在SPSS 19.0中进行,用SigmaPlot 14.0软件作图。
3 结果与分析
3.1 各等级土壤团聚体分布以及碳氮含量
MS与MH各等级土壤团聚体分布均呈现显著差异(P<0.05),不同等级团聚体所占比例均值由大到小为:大团聚体(>2 mm,59%±2.18%)>中团聚体(0.25—2 mm,35.89%±1.65%)>微团聚体(<0.25 mm,2.56%±0.22%)。不同混交林土壤大团聚体与微团聚体分布并无显著差异,而MS的中团聚体分布比例(39.53%±1.65%)显著高于MH的中团聚体(32.24%±2.51%)(图1)。
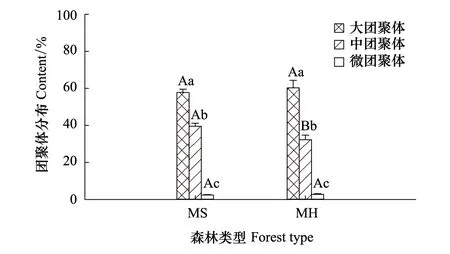
图1 2种马尾松混交林各粒径土壤团聚体分布 Fig.1 The distribution of soil aggregate-size classes in two different Pinus massoniana mixed plantationsMS:马尾松杉木混交林 Mixed plantation of P. massoniana and C. lanceolate;MH:马尾松杉木栎类混交林 Mixed plantation of P. massoniana,C. lanceolate and Quercus;大写字母表示同等级团聚体不同混交林之间的显著差异;小写字母表示同种混交林类型不同等级团聚体之间的显著差异
2种马尾松混交林土壤团聚体有机碳、全氮、全磷均随着团聚体等级的降低而呈现增加的趋势,且微团聚体的有机碳、全氮含量差异高于大团聚体(P<0.05)。不同混交林同等级团聚体的有机碳并无显著差异,而MH大团聚体与微团聚体的全氮显著高于MS,MH大团聚体全磷也显著高于MS,MS各团聚体土壤碳氮比显著高于MH(图2)。
3.2 不同马尾松混交林土壤团聚体酶活性
团聚体分级以及马尾松混交林类型对2种氧化还原酶活性并无显著影响。MS不同粒径团聚体的7种土壤酶活性均无显著差异。MH微团聚体N-乙酰-葡糖苷酶(NAG,(3276.04±160.63) nmol g-1h-1)显著高于中团聚体((2214.92±395.56)nmol g-1h-1),微团聚体的亮氨基酸氨基肽酶(Leucine aminopeptidase,LAP,(21.76±0.47) nmol g-1h-1)显著高于大团聚体((4.33±0.95)nmol g-1h-1)和中团聚体((7.16±2.45)nmol g-1h-1),其余不同等级团聚体的酶活性均无显著差异。2种马尾松混交林的中团聚体土壤酶活性均无显著差异,MH的大团聚体和微团聚体纤维二糖水解酶(Cellobiohydrolase,CB)和LAP均显著高于MS,同时,MH大团聚体的β-葡糖苷酶(BG)和NAG也显著高于MS(图3)。
由表3可知,除酸性磷酸酶(AP)外,MS各团聚体水解酶均值低于MH,而其氧化还原酶均值则高于MH。MS的大团聚体、微团聚体的土壤酶活性几何平均数显著高于MH,分别是MH的1.98倍和1.49倍。MS各等级团聚体的土壤酶活性几何平均数无显著差异,MH的微团聚体土壤酶活性几何平均数显著高于大、中团聚体(表4)。
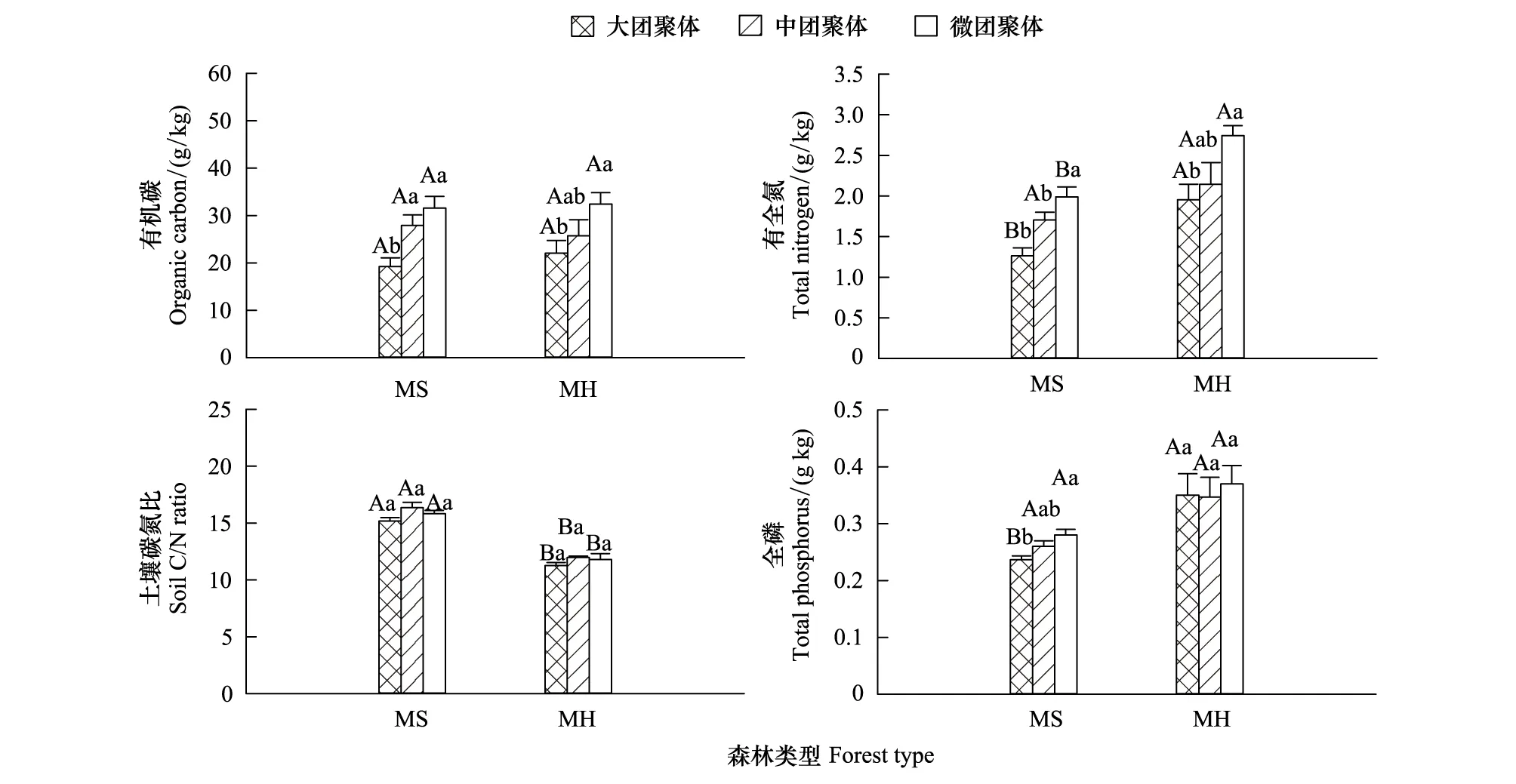
图2 马尾松混交林土壤团聚体养分含量Fig.2 Nutrient content of soil aggregates in two different Pinus massoniana mixed plantations大写字母表示同等级团聚体不同混交林之间的显著差异;小写字母表示同种混交林类型不同等级团聚体之间的显著差异
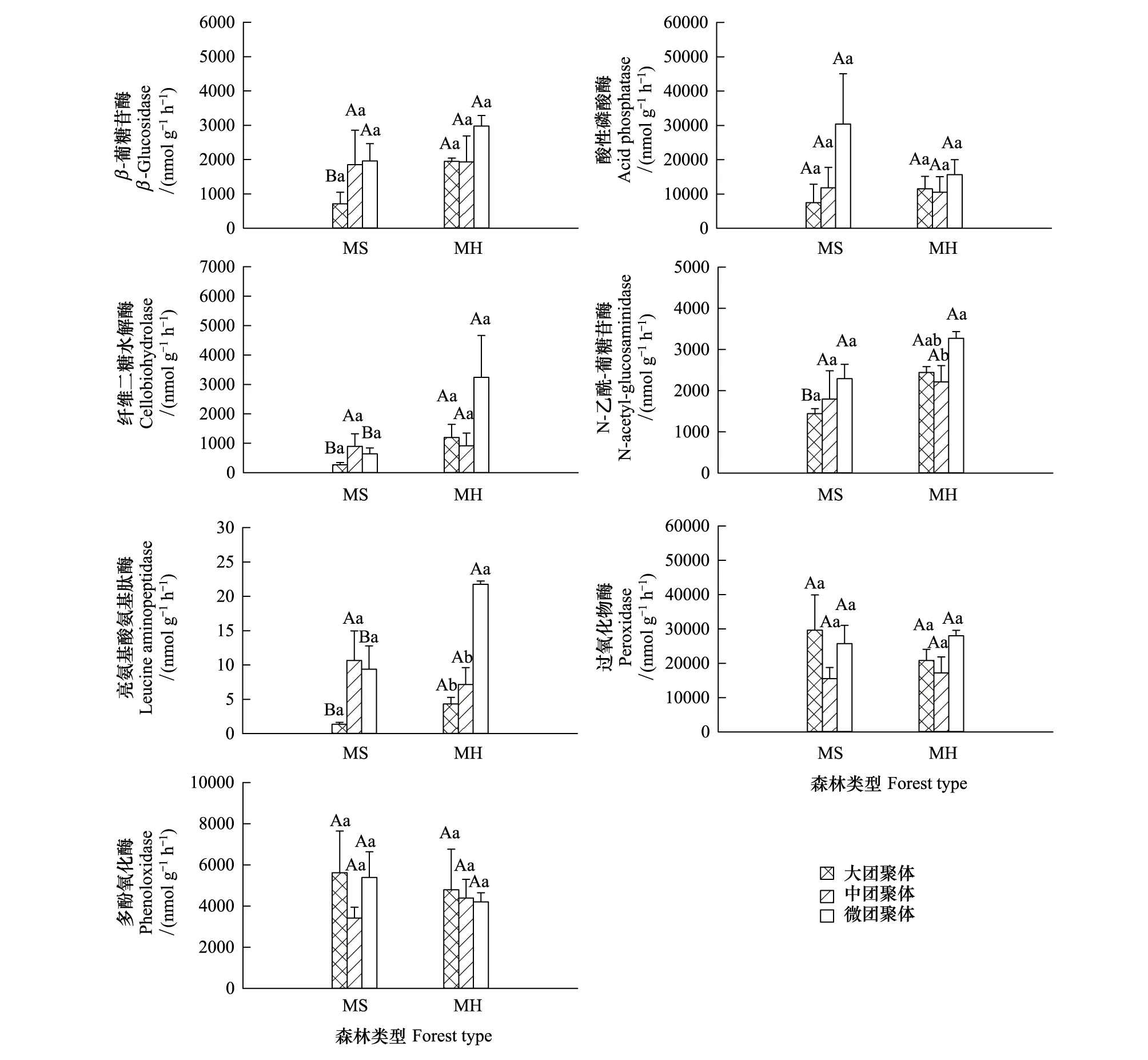
图3 马尾松混交林土壤团聚体土壤酶活性Fig.3 Enzyme activities of soil aggregates in two different Pinus massoniana mixed plantations大写字母表示同等级团聚体不同混交林之间的显著差异;小写字母表示同种混交林类型不同等级团聚体之间的显著差异
3.3 土壤团聚体土壤养分与酶活性相关性
测定的2种土壤氧化还原酶活性、以及水解酶AP与土壤团聚体的有机碳、全氮、全磷含量均无显著相关性。土壤全氮含量与其余4种水解酶呈现显著的正相关关系。土壤有机碳含量仅与NAG、LAP呈现显著的正相关关系。土壤全磷与CB和NAG呈现显著的正相关关系。土壤酶活性几何平均数随着有机碳、全氮、全磷的增加而呈现显著的增加。土壤碳氮比与测定的酶活性以及土壤酶活性几何平均数均无显著相关性(表5)。
4 讨论
不同等级团聚体通过控制水分、温度、空气以及有机质的可接触性影响土壤酶活性[11,29],各粒径团聚体的分布对于酶活性影响显著。本研究中,森林植被类型的不同并未造成各等级团聚体分布的显著差异,2种马尾松混交林团聚体分布比例均随着团聚体等级的增加而显著增加,大团聚体最高,占据土壤60%左右,这与相关研究结果一致[12,30],如Fang等对3种亚热带森林类型的土壤团聚体等级分布研究结果表明各等级团聚体分布差异显著,大团聚体(58.5%±2.6%)>中团聚体(35.6%±3.0%)>微团聚体(6.0%±0.7%)[12]。而马尾松杉木混交林的中团聚体分布显著高于马尾松杉木栎类混交林,可能是由于地上植被组成的影响,阔叶林真菌生物量高于针叶林[31],且其根系的高分子黏质高,根系分布广,能够促进较小等级团聚体胶结成大团聚体[32],因此,马尾松杉木栎类混交林的大团聚体分布比例高于马尾松杉木混交林,而中团聚体则低于马尾松杉木混交林。
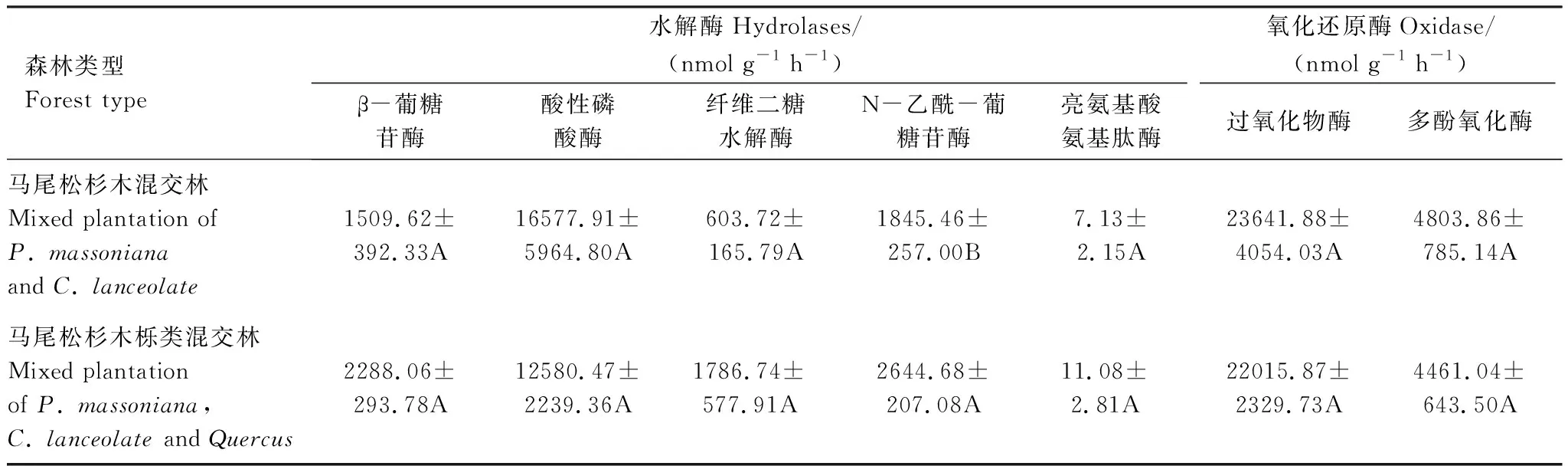
表3 马尾松混交林土壤团聚体酶活性均值

表4 马尾松混交林土壤团聚体土壤酶几何平均数
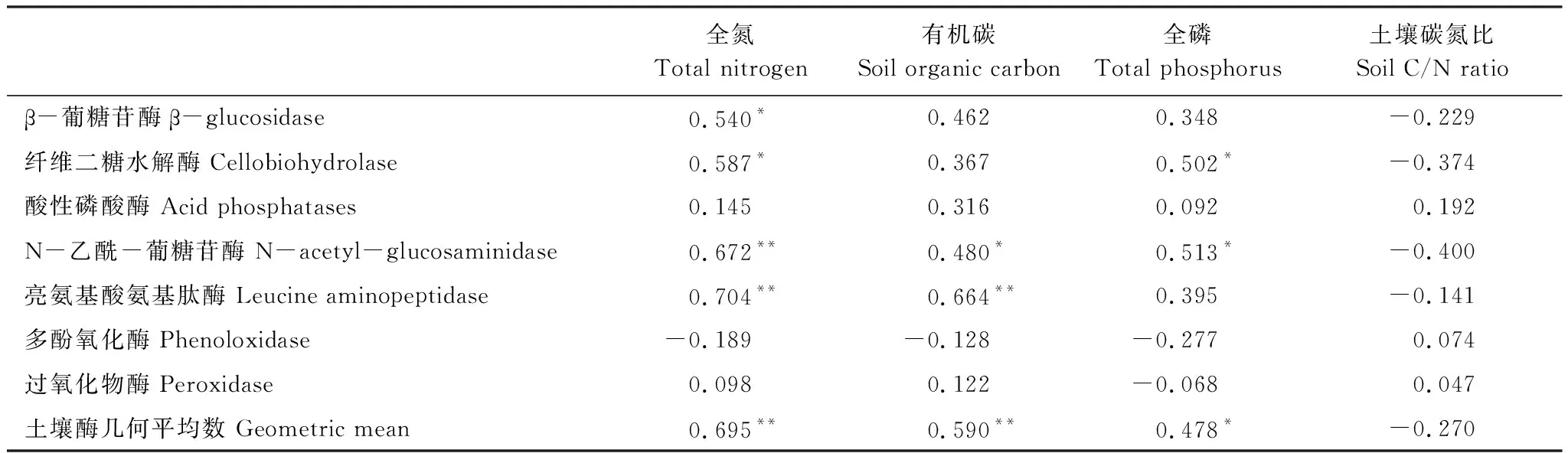
表5 团聚体酶活性与养分含量相关性
本研究发现,2种马尾松混交林土壤微团聚体的5种水解酶活性均高于大团聚体,其中,马尾松杉木栎类混交林的微团聚体亮氨基酸氨基肽酶活性显著高于大团聚体(P<0.05,图3)。由于研究区域、土壤类型、植被类型以及土壤团聚体筛分方法的差异,土壤酶活性在团聚体中的分布特征并无定论[10,12,33]。本研究微团聚体酶活性高于大团聚体可能主要源于团聚体物理结构越差异的影响,因为团聚体粒径小,水分和养分通过扩散作用进入的速度越快[34],能够为酶促反应提供更多利用的物质[35],酶活性越高;而大团聚体孔径大,稳定性低,土壤酶活性易受环境影响[36]。此外,本区域2种马尾松混交林的土壤质地是黏壤土,该土壤质地吸附力大,较小粒径的团聚体具有较高的比表面积,会吸附更多的土壤有机质[37- 38],能够为酶活性提供充足的养分。与水解酶不同的是,氧化还原酶主要是由真菌产生[39],而真菌因其菌丝无法穿透土壤微团聚体的气孔,主要存在于大团聚体中[40],因此本研究中大团聚体的2种氧化还原酶活性最高(图3)。
对比2种混交林团聚体土壤酶活性发现,马尾松杉木栎类混交林的大团聚体β-葡糖苷酶、纤维二糖水解酶、N-乙酰-葡糖苷酶、亮氨基酸氨基肽酶活性显著高于马尾松杉木混交林,同时其微团聚体纤维二糖水解酶、亮氨基酸氨基肽酶活性也显著高于马尾松杉木混交林(图3)。这4种酶活性主要参与土壤碳氮循环[3,4,24]。然而,究竟是较高的碳循环酶活性(氮循环酶活性)造成了土壤有机碳(或氮)含量的增加,还是较大的土壤有机质库为土壤酶活性提供了充足的底物从而促进了酶活性的提高并无定论[6]。目前多数学者认为,土壤酶活性同时受到土壤关键理化性质、土壤微生物量、土壤有机质含量的共同影响[4,41]。本研究中,所测得的β-葡糖苷酶、纤维二糖水解酶、N-乙酰-葡糖苷酶、亮氨基酸氨基肽酶活性均与土壤全氮呈极显著的相关性(表5),马尾松杉木混交林与马尾松杉木栎类混交林的大团聚体与微团聚体全氮的显著差异可能是造成上述土壤酶活性差异的主要原因(图2)。而与上述4种水解酶不同的是,团聚体水解酶酸性磷酸酶与土壤碳氮磷关系并不显著,这主要是因为相较于养分的影响,团聚体酸性磷酸酶更易受到土壤水分的影响[42]。2种马尾松混交林土壤水分相近(表1),所以其酸性磷酸酶活性并无显著差异。同时,本研究也发现马尾松杉木栎类混交林各团聚体土壤C/N比显著低于马尾松杉木混交林(图2),而低C/N比更适宜主要产生水解酶的细菌生存[39,43-44],高C/N比则利于主要产生氧化还原酶的真菌生存[39,43- 44],虽然土壤C/N比与各土壤酶活性并无显著相关关系(表5),但其通过影响微生物进而调节土壤酶活性的变化[44],所以马尾松杉木混交林的各团聚体氧化还原酶均值略高于马尾松杉木栎类混交林,而其水解酶活性(除酸性磷酸酶外)则低于马尾松杉木栎类混交林。
多酚氧化酶与过氧化物酶这两种氧化酶活性比水解酶变异性更强[4],主要影响土壤惰性碳的形成,分解木质素以及芳香类复合物,形成腐殖质[1]。多酚氧化酶与过氧化物酶活性与土壤有机碳、全氮无显著的相关性[4],而是随着pH的增加而呈现增加的趋势[4],本研究也发现,团聚体多酚氧化酶与过氧化物酶与有机碳、全氮并无显著的相关性(表4)。由于马尾松杉木混交林与马尾松杉木栎类混交林的土壤pH分别为5.65±0.06和5.62±0.03(表1),所以各团聚体的2种氧化还原酶酶活性相近(图3)。
土壤酶活性几何平均数GMea是基于所测的5种水解酶和2种氧化还原酶活性计算得出的,作为反应土壤质量的综合指标[26- 27],GMea能够反应整体酶活性的变化以及微生物活性变化[45-46]。相较于马尾松杉木针叶混交林,马尾松杉木栎类针阔叶混交林的凋落物C/N比低(表1),分解快[47],能够为土壤微生物提供丰富的营养,同时不同树种的根系相互作用,根系的代谢也能直接影土壤酶活性[48-49],这可能是造成马尾松杉木栎类混交林土壤大团聚体和微团聚体酶活性综合指数GMea显著高于马尾松杉木混交林的主要原因(表4)。此外,土壤酶活性一般随着温度的增加而增加[2],相较于马尾松杉木混交林,马尾松杉木栎类混交林海拔低,土壤温度较高(根据2019年8月表层土壤温度连续监测结果),从而增加了土壤酶活性综合指数GMea(表4)。而为何2种混交林土壤中团聚体酶活性无显著差异仍需进一步对其微生物等指标进行分析。
5 结论
林型对土壤团聚体分布、团聚体氧化还原酶、酸性磷酸酶活性并没有显著影响,而马尾松杉木栎类混交林大团聚体的β-葡糖苷酶、纤维二糖水解酶、N-乙酰-葡糖苷酶、亮氨基酸氨基肽酶显著高于马尾松杉木混交林,同时其微团聚体纤维二糖水解酶、亮氨基酸氨基肽酶也显著高于马尾松杉木混交林。2种马尾松混交林团聚体全氮是造成上述4种酶活性不同的主要原因。马尾松杉木混交林大团聚体和微团土壤酶活性几何平均数GMea显著低于马尾松杉木栎类混交林,栎类阔叶树种的增加显著增加了土壤团聚体酶活性,有利于土壤养分质量的提高。
致谢:感谢湖北秭归三峡库区森林生态系统国家定位观测研究站对本研究的帮助。
