全氟辛基碘烷的毒性效应及对长链非编码RNA MALAT-1的调节作用
2020-11-13杨雪宋飞彭蕾户业丽程波丁强
杨雪,宋飞,彭蕾,户业丽,程波,*,丁强
1. 武汉工程大学环境生态与生物工程学院,武汉 430205 2. 宜昌三峡制药有限公司,宜昌443005
半个多世纪以来,全氟化合物(PFCs)作为合成化学品,由于其独特的性质如疏水性和疏油性在商业和工业领域得到了广泛的应用[1-2]。但由于它们在人类和野生动物中的生物蓄积性和环境中的持久性,在生物体内和环境中都有检出,这使得PFCs引起了科学界和公众的广泛关注[3-4]。越来越多的证据表明,一些PFCs可能具有内分泌干扰效应[5],同时扰乱甲状腺系统和神经内分泌功能,激活过氧化物酶体增殖物激活受体α(PPAR-α)和雌激素受体(ERs),并诱导啮齿动物的发育毒性[6]。研究较多的PFCs有全氟辛烷磺酸(PFOS),其可调节下丘脑-垂体-甲状腺(HPT)轴中某些基因的表达水平,并导致斑马鱼幼鱼中甲状腺激素(TH)水平的变化,直接反映出对TH稳态的破坏[7]。据报道,在动物实验中,PFOS暴露会引起中枢神经系统功能的改变,包括神经内分泌紊乱和神经发育迟缓[8-9]。全氟辛酸(PFOA)作为一种在工业中广泛使用的PFCs,其毒理效应研究主要集中在水生生态毒性,比如对藻类[10]、斑马鱼[11]、黑头软口鲦(Pimephalespromelas)[12]、稀有鮈鲫(Gobiocyprisrarus)[13]、多刺裸腹溞(Moinamacrocopa)和大型蚤(Daphniamagna)的毒性[14]。其中,斑马鱼胚胎模型的研究表明,PFOA能够干扰ER和睾酮受体(TR)的合成。在人肾上腺皮质瘤细胞H295R细胞中,PFOA可以增加雌二醇(E2)的合成并降低睾酮(T)的合成,改变了主要的类固醇基因和调节因子SF-1的表达,表明了PFOA潜在的内分泌干扰作用[11]。
PFCs前体物的毒性效应研究相对于PFCs较少,特别是对于最近报道的一些新的前体物,如全氟碘烷烃(FIAs)。FIAs是一端含有碘原子的全氟化烷基链的化学品,是工业合成氟代调聚物醇(FTOH)和全氟辛酸铵(APFO)等调聚物的重要中间体[15]。全氟辛基碘烷(PFOI)就是其中一种重要的中间体,其衍生物的广泛应用使得其具有较高的商业价值。然而,对这种化学物质的毒性效应研究甚少,仅有的研究报道了PFOI暴露对雄性青鳉的影响,雄性青鳉体内卵黄蛋白原(VTG Ⅰ和VTG Ⅱ)等雌激素相关基因的表达水平随PFOI剂量的增加而上调,且表现出明显的剂量-效应关系[16]。VTG被证明是理想的类雌激素暴露的生物标志物[17],上述结果表明,PFOI是一种潜在的具有雌激素效应的类雌激素化合物,但是对PFOI其他毒性效应的研究仍是空白。
表观遗传学是毒性效应研究中不可忽略的一个重要研究方向,因为,它是环境化学品影响人类健康和导致疾病的重要机制[18]。已有研究提出,内分泌干扰效应有可能是通过干扰表观遗传途径,进而导致不利的发育效应[19]。目前有研究表明,长链非编码RNA(lncRNA)在表观遗传机制的调控中扮演了越来越重要的角色[20]。有趣的是,近几年的新证据表明,lncRNA的调节受到各种环境化学物质的影响,如多环芳烃、苯、镉、甲基毒死蜱、双酚A、邻苯二甲酸盐、苯酚和胆汁酸[21]。这些环境化学物质在表观遗传水平调控基因的表达,从而影响生物体内的信号传递和重要的生物学功能[22],最终产生致毒效应。有研究表明,相对于正常乳腺组织,lncRNA肺腺癌转移相关转录本-1(metastasis associated lung adenocarcinoma transcript-1, MALAT-1)在原发性乳腺癌和淋巴结转移中高表达[23]。据报道,阿魏酸(一种用于治疗妇科疾病的中草药主要成分之一,具有植物雌激素效应)可诱导MCF-7细胞中雌激素受体α(ERα)调控MALAT-1的表达,并且阿魏酸可提高MCF-7细胞活力、增殖、成瘤、迁移和侵袭的能力,且表现出明显的浓度依赖性关系[24]。此外,MALAT-1被证明在神经元中表达并调节与树突和突触发育相关的一系列基因[25-26],且MALAT-1在酗酒者的小脑、海马和脑干中显著上调[27]。以上研究表明,MALAT-1既会与雌激素受体相互作用,也会参与神经调节,但是MALAT-1在PFOI暴露下的调节作用尚不明确。
生物信息学分析结果表明,MALAT-1在人、斑马鱼和老鼠之间具有一定同源性,主要表现在3’端有一段长约60 bp的高度相似序列[28]。故本研究以人乳腺癌细胞(MCF-7)为离体模型,研究PFOI暴露对MCF-7细胞迁移能力的影响,以及对MALAT-1的调节作用;以斑马鱼胚胎为活体模型研究PFOI暴露对斑马鱼胚胎的胚胎毒性及对MALAT-1的调节作用。初步了解PFOI环境暴露对乳腺癌患者的危害,以及对水生生物的生态毒性。
1 材料与方法(Materials and methods)
1.1 实验试剂
PFOI纯度≥99%,购于北京百灵威科技有限公司,二甲基亚砜(DMSO)纯度≥99%,购于Amresco公司(美国);RPMI 1640细胞培养液购于Invitrogen公司(美国);胎牛血清(FBS)、100 U·mL-1链霉素-青霉素和谷氨酰胺均购于Gibco公司(美国);活性炭-葡聚糖处理的胎牛血清(CDT-FBS)购于Cellgro公司(美国)。将PFOI溶于DMSO中,PFOI母液浓度为50 mmol·L-1(置于-20 ℃冰箱避光保存)。原位杂交所用去离子水出自Mini-Q超纯水机(Miliipore公司,美国)。
1.2 细胞培养与暴露
液氮中取MCF-7乳腺癌细胞株,在解冻仪下37 ℃解冻1 min。培养基配方:基础培养基RPM1640+10% FBS+1%谷氨酰胺+1%链霉素-青霉素。在37 ℃、5% CO2条件下的培养箱中连续培养3 d,第4天传代培养。传代2次后饥饿培养细胞12 h。之后暴露实验中,将细胞培养基中10% FBS换为10% CDT-FBS。MCF-7细胞暴露在浓度分别为10 μmol·L-1和50 μmol·L-1的PFOI溶液中,空白对照组为0.1% DMSO。
1.3 细胞迁移实验
细胞迁移实验是一项癌细胞功能监测实验,用于分析细胞迁移能力。用胰酶消化细胞后计数,置于6孔板,每个孔细胞浓度为1×105~1×106个·mL-1。培养过夜,第2天换不含FBS的培养基饥饿处理12 h之后,在6孔板底部划线,再用无菌枪头沿划线处除去中央所有细胞。用磷酸盐缓冲液(PBS)轻轻洗去刮掉的细胞,用培养基稀释暴露药物至工作液浓度,暴露24 h,其中,分别在0、12和24 h拍摄细胞迁移状况。迁移能力的大小用伤口未愈合百分比(% of wound open)表示,未愈合百分比越小表明迁移能力越大。
1.4 PFOI对lncRNA MALAT-1的调节
对暴露后的细胞和斑马鱼胚胎进行实时荧光定量PCR测定,细胞总RNA用Trizol试剂(Invitrogen公司,美国)提取,用Thermo nanodrop 2000核酸测定仪(Thermo Fisher公司,美国)测定所提取的总RNA浓度,A260/A280的比值在1.8~2.0之间。使用iScriptTMcDNA合成试剂盒(Bio-Rad Laboratories, Inc.,美国)按照说明书进行cDNA的合成。由生工生物工程(上海)股份有限公司合成引物,并且使用SYBR Green Supermix试剂盒进行实时定量PCR,正向和反向引物序列如表1所示。每个反应3个重复样品。使用2-ΔΔCT方法[29]计算相对表达水平的倍数变化。在离体细胞水平上,以GAPDH的表达量进行标准化来分析MALAT-1的表达水平。在活体模式生物斑马鱼体胚胎体内,以β-肌动蛋白(β-actin)的表达量进行标准化来分析MALAT-1的表达水平。
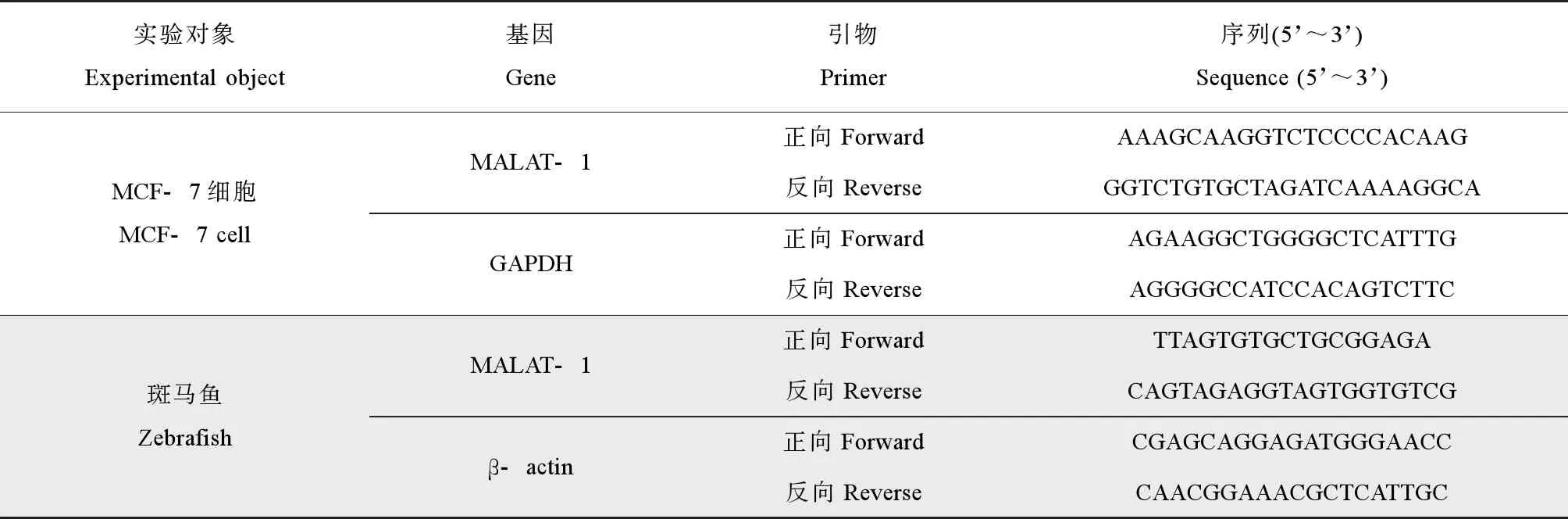
表1 用于实时荧光定量聚合酶链式反应(RT-PCR)的引物序列Table 1 Primer sequences used for real-time polymerase chain reaction (RT-PCR)
1.5 斑马鱼暴露实验
1.5.1 斑马鱼暴露与形态观察
斑马鱼(Daniorerio),AB野生型,购于中国科学院水生生物研究所,饲养于流水养殖系统(武汉汉科实验设备研制有限公司),最适水温范围(28±0.5) ℃,光周期为14 h光照周期和10 h暗周期。所有实验均在野生型AB株(3个月龄)孵化的斑马鱼胚胎上进行。收集的胚胎由2条雌鱼和2条雄鱼配对产生,并在收集胚胎前一天的晚上用隔板分离。第2天拿开隔板自由配对产卵。之后挑取发育时期一致,质量较好的胚胎于6孔板中,每个孔约30枚胚胎暴露于PFOI溶液中。暴露液浓度分别为0、10、50、100、500和1 000 μmol·L-1。斑马鱼胚胎受精2 h后(2 hpf)暴露至120 hpf,暴露时间内每天更换约1/2新鲜配制的暴露液(暴露液由养鱼水稀释配成,养鱼水以约0.06 g海盐加入1 L的自来水中配制而成,充分溶解后曝气)。每个暴露组有3个重复,对照组和实验组的DMSO含量不超过0.007%。在暴露过程中,观察胚胎的形态发育,记录不同阶段的死亡率、孵化率和畸形率。
1.5.2 斑马鱼胚胎自发运动行为的测定
对胚胎的早期自发运动的检测在28~29 hpf进行(斑马鱼胚胎早期自发运动于17 hpf最为活跃),此时,中枢神经系统的发育已经开始抑制胚胎的早期自发运动,因而,这一阶段的运动频率较为稳定,利于观测。残余的自发运动被认为是引起孵化的原因之一[30]。斑马鱼胚胎暴露于含不同浓度PFOI(0、10、50、100和500 μmol·L-1)环境中至32 hpf时(未出膜),于32 hpf时通过斑马鱼微视行为分析系统(DanioScope),分析PFOI暴露对斑马鱼胚胎自发运动行为的毒性效应。观察20枚胚胎,通过徕卡显微镜(DMi8, Leica, Mannheim, Germany)使用每秒24帧速度对胚胎进行视频拍摄,之后通过DanioScope软件对视频文件进行多枚斑马鱼胚胎的活动分析,每个处理组有3个重复。该系统可以自动识别胚胎,选择胚胎绒毛膜内作为感兴趣区域,并自动测定胚胎活动。分析指标为斑马鱼胚胎的活跃性,用胚胎运动的时间百分比(占总测量时间的百分比)来表征。
1.5.3 整体原位杂交
(1) 胚胎前处理
用PFOI暴露之后,分别收集暴露至72 hpf的胚胎,用4%多聚甲醛固定4 ℃过夜,之后用PBS稀释的甲醇(0、25%、50%、75%和100%)梯度溶液脱水,每个浓度一次,每次5 min,最后置于甲醇溶液中于-20 ℃保存并透化约一周。
(2) 探针制备
阳性对照引物序列上游引物为5’GATGTCGCCCTGTGGAGT3’,下游引物为5’TAATACGACTCACTATAGGGGGGATGCACGATTAGCAG3’。其中,下游引物前20个碱基属于T7聚合酶基因序列。提取斑马鱼幼鱼(120 hpf)的总RNA,通过逆转录合成cDNA,再根据体外转录程序来合成反义RNA作为探针。
(3) 原位杂交
第1天进行杂交实验:用含甲醇的PBS溶液(100%、75%、50%、25%和0)梯度复水,每个浓度一次,每次5 min,复水完之后用含0.1% Tween20的PBS即PBT洗4次,每次5 min。蛋白酶K消化与4%多聚甲醛固定之后,加预杂交液,70 ℃水浴4 h进行预杂交,之后再加含有探针的杂交液于70 ℃杂交过夜。
第2天进行抗体孵育:用杂交液与氯化钠和柠檬酸三钠溶液(SSC)的混合液梯度漂洗,然后加封闭液(PBT中加入2%羊血清和2 mg·mL-1牛血清白蛋白(BSA))在室温低速摇床上封闭反应4 h。最后加酶连地高辛抗体(Anti-dig-AP)于4 ℃摇床上低速反应过夜。
第3天进行显色实验:弃抗体反应液,PBT快速漂洗6次,每次5 min,然后用碱性Tris缓冲液快速漂洗3次,每次5 min。最后用显色液(20 μL NBT-BCIP/1 mL碱性Tris缓冲液)进行显色反应。显色反应时严格避光。每30分钟观察一次胚胎显色情况,直到显色成功后,及时吸去显色液,之后加入1 mL终止液(PBS的pH为5.5,含EDTA 1 mmol·L-1),洗3次。最后将胚胎转移至100%甘油中室温过夜,增加胚胎的光透性。
第4天进行MALAT-1基因的原位观察:在显微镜下将杂交好的胚胎置于白底板下观察MALAT-1基因的原位表达情况。

图1 在全氟辛基碘烷(PFOI)暴露下MCF-7细胞随时间变化的迁移情况注:(a)、(b)和(c)分别为0、10和50 μmol·L-1的PFOI暴露组;1、2和3分别表示暴露时间为0、12和24 h;黄色线条标记的中间区域面积能够反映MCF-7细胞迁移愈合能力,黄色区域面积越小,表明迁移能力越强。Fig. 1 Cellular migration with time of MCF-7 cells after exposure to 1-iodoperfluorooctane (PFOI)Note: (a), (b) and (c) represent 0, 10 and 50 μmol·L-1 of PFOI exposure group, respectively; 1, 2 and 3 represent 0, 12 and 24 h after exposure, respectively; the area of the middle area marked by the yellow line is negatively correlated with the migration ability of MCF-7 cells, which means the smaller the area of the yellow area, the stronger the migration ability.
1.6 数据统计与分析
使用GraphPad Prism 7(Graphpad Software,La Jolla,CA,美国)和SPSS 22.0(IBM Corp.,Armonk,NY,美国)进行统计学分析,用Image J对细胞迁移实验中伤口未愈合面积进行灰度分析。实验结果表示为平均值±标准偏差(SD)或平均值±平均值的标准误差(SEM)。使用单因素方差分析评估多个处理组(包括伤口未愈合百分比、基因表达和孵化率)。采用ANOVA与Dunnett’s post-test进行统计学分析,P<0.05被认为在统计学上具有显著性。
2 结果(Results)
2.1 PFOI影响乳腺癌细胞的迁移能力
实验结果表明,MCF-7细胞在PFOI暴露后,其迁移能力显著增强,尤其是在高浓度的PFOI下。PFOI暴露组中MCF-7的迁移能力相对于对照组显著性增高(图1)。通过细胞的表观观察可知,在PFOI暴露处理12 h时,相对于对照组,MCF-7细胞迁移能力显著性提高。通过Image J软件对伤口面积进行定量分析可知,对照组与实验组有显著性差异。在暴露至12 h时,相对于对照组,10 μmol·L-1和50 μmol·L-1的PFOI暴露组中,细胞迁移能力分别提高了13%和39%(图2)。

图2 在PFOI暴露下MCF-7细胞迁移伤口未愈合百分比的定量分析注:数据表示为平均值±平均值的标准误差;**** P<0.0001表示暴露组与对照组之间的显著差异。Fig. 2 A quantitative analysis of wound open percentage of cell migration of MCF-7 cells over time after exposure to PFOINote: Data are expressed as mean ± SEM; **** P<0.0001 indicates a significant difference between the exposed group and the control group.
2.2 PFOI对MCF-7细胞中MALAT-1的调节作用
对MALAT-1的表达量进行了定量分析,结果表明,于PFOI暴露24 h后,MCF-7细胞中MALAT-1的表达量显著性增高。由图3可知,与对照组相比,10 μmol·L-1和50 μmol·L-1的PFOI暴露组细胞中MALAT-1的表达量分别提高了7.1倍和9.2倍。

图3 PFOI暴露24 h后MCF-7细胞MALAT-1的相对表达量注:数据表示为平均值±平均值的标准误差;**** P<0.0001表示暴露组与对照组之间的显著差异。Fig. 3 Relative expression of MALAT-1 after exposure to PFOI for 24 h in MCF-7 cellsNote: Data are expressed as mean ± SEM; **** P<0.0001 indicates a significant difference between the exposed group and the control group.
2.3 PFOI诱导斑马鱼的胚胎毒性效应
对PFOI暴露下的斑马鱼胚胎毒性进行了研究,结果表明,在0~1 000 μmol·L-1浓度范围内,在发育前期(<48 hpf),斑马鱼胚胎的死亡率和畸形率虽无显著性变化,但有显著性的发育迟缓现象。形态学观察发现,在斑马鱼胚胎色素形成窗口期(约32 hpf),POFI暴露组中,有较多斑马鱼胚胎表现出色素生成迟缓(图4)。继续暴露至72 hpf,500 μmol·L-1和1 000 μmol·L-1POFI暴露组的幼鱼孵化率显著性降低(表2),继续培养至96 hpf,幼鱼由于不能及时出膜而死亡。

表2 斑马鱼幼鱼暴露于PFOI的孵化率统计Table 2 Statistical hatching rate of zebrafish larvae exposed to PFOI
2.4 PFOI对斑马鱼幼鱼自发运动的影响
在斑马鱼发育早期(约32 hpf),通过测定斑马鱼胚胎的自发运动能力来评估PFOI对斑马鱼胚胎早期自发神经活动的毒性效应,结果表明,暴露浓度在50 μmol·L-1和100 μmol·L-1时,自发运动活力百分比相对于对照组分别显著增加了1.01倍和1.1倍(P<0.05)(图5)。结果表明,PFOI暴露导致斑马鱼胚胎早期发育的自发活动不受神经调节的控制而产生焦虑行为。

图5 PFOI暴露至32 hpf时斑马鱼胚胎自发运动行为活力百分比注:数据表示为平均值±平均值的标准误差;* P<0.05表示暴露与对照组之间的显著差异。Fig. 5 The percentage of burst activity for zebrafish embryos after exposure to PFOI until 32 hpfNote: Data are expressed as mean ± SEM; * P<0.05 indicates a significant difference between the exposed group and the control group.
2.5 PFOI对斑马鱼幼鱼体内MALAT-1的调节作用
在PFOI的刺激下,斑马鱼幼鱼体内MALAT-1表达量的定量分析结果表明,MALAT-1的表达量显著性增高(图6)。由实验结果可知,相对于对照组,高浓度PFOI暴露组(100、500和1 000 μmol·L-1)中MALAT-1的表达分别增高了16倍、21倍和26倍。
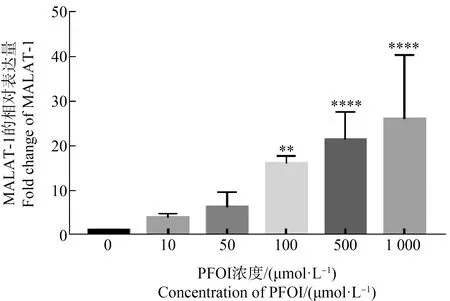
图6 PFOI暴露至120 hpf时斑马鱼胚胎MALAT-1的相对表达量注:数据表示为平均值±平均值的标准误差;**** P<0.0001、***P<0.001、** P<0.01表示暴露组与对照组之间的显著差异。Fig. 6 Relative expression of MALAT-1 in zebrafish embryos after exposure to PFOI until 120 hpfNote: Data are expressed as mean ± SEM; **** P<0.0001, *** P<0.001 and ** P<0.01 indicate a significant difference between the exposed group and the control group.
2.6 MALAT-1在斑马鱼幼鱼中的原位表达
原位杂交结果表明,斑马鱼幼鱼在PFOI(0、100、500和1 000 μmol·L-1)暴露至72 hpf,MALAT-1的表达水平以PFOI剂量依赖关系显著上调(图7(c)、7(d)、7(e)和7(f)),且MALAT-1主要集中在斑马鱼胚胎的脑部表达(图7(a)和图7(b))。原位杂交的结果与实时荧光定量PCR结果相一致。

图7 PFOI暴露至72 hpf时MALAT-1在斑马鱼胚胎的整体原位杂交注:(a)和(b)分别表示空白对照组与PFOI处理组暴露至72 hpf,斑马鱼胚胎的整体原位杂交成像,箭头所指表示MALAT-1空间表达位置,比例尺为250 mm;(c)、(d)、(e)和(f)分别表示0、100、500和1 000 μmol·L-1 PFOI处理组的幼鱼经过原位杂交后的成像,其中箭头所指表示MALAT-1空间表达位置,比例尺为800 μm。Fig. 7 The MALAT-1 spatial expression in whole in situ hybridization of zebrafish embryos after exposure to PFOI until 72 hpfNote: (a) and (b) represent the whole in situ hybridization imaging of the zebrafish embryos in the control group and the PFOI treatment group until 72 hpf; the arrow indicates that the spatial expression position of MALAT-1 is mainly concentrated in the brain, and the scale is 250 mm; (c), (d), (e) and (f) represent the imaging of 0, 100, 500, and 1 000 μmol·L-1 PFOI-treated juveniles after in situ hybridization, where the arrow indicates that the MALAT-1 spatial expression position is mainly concentrated in the brain, and its expression is PFOI dose-dependent and has a scale of 800 μm.
3 讨论(Discussion)
PFOI作为有机氟化物合成的重要中间体,具有较高的商业价值,但对其毒性效应的研究仅限于PFOI暴露可促进MCF-7细胞的增殖以及可诱导雄性青鳉鱼体内VTG Ⅰ和VTG Ⅱ上调,表明PFOI具有雌激素效应[16]。本研究结合离体模型MCF-7细胞与活体动物模型斑马鱼胚胎来研究POFI急性暴露的毒性效应及对表观遗传修饰中lncRNA MALAT-1的调节作用。
离体模型研究结果表明,PFOI暴露加快了MCF-7细胞的迁移,同时诱导MALAT-1表达上调。对于细胞迁移与MALAT-1的调节之间的相关性,已有研究报道了MALAT-1通过竞争性结合miR-1作用于细胞分裂周期42蛋白(cell division cycle 42, cdc42),进而诱导MCF-7的迁移和侵袭[31]。这说明,POFI暴露诱导MCF-7细胞中MALAT-1的上调,对加快癌细胞迁移有一定贡献。此外,临床数据表明,MALAT-1与雌激素受体相互作用,致使乳腺癌患者存活率降低[32],笔者的研究也证实了PFOI环境暴露对乳腺癌的诱发和恶化具有一定的潜在影响。
斑马鱼胚胎活体模型的研究结果表明,PFOI的急性暴露具有一定的胚胎毒性,虽然,在胚胎发育早期(约32 hpf)没有较为显著的死亡和畸形现象,但在72 hpf(未出膜)时,胚胎死亡率显著增高。早期发育所能观察到的形态学毒性效应包括胚胎发育延迟、胚胎自发运动不受控制以及胚胎出膜率低。由于运动行为的成熟可能是基于发育过程中自发运动的神经性调控,当中枢神经系统受到影响时,自发运动变得不可控制,随着时间的推移,残余的自发运动活力越来越微弱,同时由神经支配自主运动受到阻碍,推测以上原因导致了斑马鱼在72 hpf时的孵化率显著性降低,其实际致毒机理还需通过正反交实验进行验证。除此之外,笔者还在分子水平上测定了PFOI暴露对斑马鱼胚胎的毒性效应,通过qRT-PCR对PFOI暴露后的斑马鱼胚胎体内的MALAT-1相对表达量进行了测定,同时采用整体原位杂交技术观测了MALAT-1的原位表达情况。结果表明,MALAT-1的相对表达量相对于对照组显著性上调,且主要集中在脑部表达,少数在脊柱上表达。Ulitsky等[33]的研究表明,MALAT-1在各种组织中高表达,但主要在脑中富集,并调节与突触和树突发育相关的多个基因[34],在突触形成中起重要作用[35]。以上研究表明,MALAT-1的异常表达,对中枢神经系统正常调节具有一定的干扰作用。笔者的研究表明,在PFOI暴露下斑马鱼胚胎体内MALAT-1表达显著性上调,结合自发运动研究结果,可以推测PFOI在活体里的形态学毒性效应可能与MALAL-1的调节有一定的相关性,并且表明PFOI可能具有潜在的神经毒性效应。
综上所述,笔者首次通过联合离体与活体实验模型研究了PFOI的细胞毒性和胚胎毒性,发现PFOI可能是通过MALAT-1的调节作用诱导癌细胞迁移和自发运动过度活跃等毒性效应。
◆
