日粮中添加沙棘果渣对肉羊肌内脂肪沉积及其关键基因和酶活力的影响
2020-11-12邓步皓秦旭泽张建新赵俊星
邓步皓,秦旭泽,张 婷,张建新,赵俊星
(山西农业大学动物科学学院,太谷 030801)
沙棘(Hippophae rhamnoidesL.)是广泛分布于大西洋沿岸、蒙古以及我国西北部的落叶灌木,拥有较好的药用价值和相关疾病的治疗潜力[1]。由于含有酚类、黄酮类、维生素、矿物质、氨基酸、脂肪酸和植物甾醇等生物活性物质,沙棘汁、沙棘果酱和沙棘油等均拥有很好的消炎、抗癌、抗氧化和抗动脉粥样硬化等生物学功能[2]。沙棘果渣(sea buckthorn pomace,SBP)是沙棘汁饮料生产中产生的副产品,含有浓度较大的多种天然生物活性化合物[3]。Kaushal等[4]的研究结果证实,沙棘果实和种子等均被广泛应用于畜牧业生产中。育肥猪日粮中添加SBP有效提高了动物的生长性能、肉品质,影响了肌肉中脂肪酸的分布[5]。肉鸡日粮中添加沙棘黄酮可影响脂质代谢,提高生长性能和改善脂肪沉积[6]。蛋鸡摄入SBP后提高了产蛋量,改善了蛋黄颜色[7]。这些研究表明了SBP具有改善家畜的生理功能及生产性能的作用。
肌内脂肪(intramuscular fat,IMF)是影响肉品质和风味儿的关键因素之一,其含量受到了遗传、营养与饲养管理等诸多因素的影响[8]。现已证实,肌内脂肪细胞的分化能力主要受过氧化物酶增殖激活受体(peroxisome proliferator-activated receptor gamma,PPARγ)、CCAAT增强子结合蛋α(CCAAT-enhancer-binding protein alpha,C/EBPα)、CCAAT增强子结合蛋白β(CCAAT-enhancer-binding protein beta,C/EBPβ)、脂肪酸结合蛋白4(fatty acid binding protein 4,FABP4)、固醇调节元件结合蛋白1(sterol regulatory element-binding protein 1,SREBP1)、锌指蛋白423(zinc finger protein 423,ZNF423)等关键相关转录因子的调控[9]。同时,脂肪酸合成酶(fatty acid synthetase,FAS)、乙酰辅酶A羧化酶(acetyl CoA carboxylase,ACC)、苹果酸脱氢酶(malate dehydrogenase,MDH)、激素敏感脂肪酶(hormone-sensitive triglayceride lipase,HSL)和脂蛋白脂酶(lipoprteinlipase,LPL)等脂肪酸合成与降解相关酶的活性也与 IMF含量相关[10]。
集约化肉羊生产方式下提高瘦肉率和饲料转化率的措施可能导致肉羊肌内脂肪沉积能力下降,肉品质降低[11]。因此,在不影响肉羊生长速度的前提下,适当提高IMF含量是当前肉羊生产过程中亟待解决的问题之一。鉴于沙棘活性物质与脂质代谢的关系[12],日粮中添加SBP可能影响肉羊肌内脂肪细胞分化及脂质代谢。本试验旨在研究日粮中添加不同比例的SBP对肉羊IMF沉积的影响及其作用机制,为合理利用SBP提供理论依据。
1 材料和方法
1.1 试验设计及动物饲养管理
试验采用完全随机设计。随机选取4月龄、体重相近(22.2±0.9)kg的杜泊(♂)×小尾寒羊(♀)杂交公羊30只,平均分为3组,单栏饲养。试验开始前,受试动物按体重0.2 mg/kg的剂量注射伊维菌素,消除寄生虫。试验各组肉羊分别饲喂含不同水平SBP的饲料:0%SBP(对照组)、7.8%SBP(7.8SBP组)和16.0%SBP(16SBP组)。预试期10 d,正式试验70 d,每天08:00和16:00进行饲喂,自由采食和饮水。试验结束时,取背最长肌(longissimus muscle,LD)样品,分别置于4℃冰箱、多聚甲醛(paraformaldehyde,PFA)及液氮中保存。试验日粮组成及营养水平见参考文献[13]。
1.2 试验方法
1.2.1 剪切力测定
取厚度约2.54 cm的LD样品,放置于沸水浴中处理,当样品中心温度达到70℃时立即取出样品冷却至室温,并于1℃条件下保存24 h。之后,使用钻孔机取上述6块圆柱形样品(直径为1.27 cm),剪切力测定仪(Mecmesin,West Sussex,英国)测定Warner-Bratzler剪切力(Warner-Bratzler shear force,WBSF)。
1.2.2 IMF 含量测定
采用索氏提取法测定LD中IMF含量[14]。将LD真空冷冻干燥至恒重,在索氏提取器中利用乙醚进行粗脂肪分离。8 h后,将样品取出、真空干燥并重新称重。IMF含量由以下公式计算:
IMF%=[干燥前重量(g)-干燥后重量(g)]/[干燥前重量(g)]×100% 。
1.2.3 马森(Masson)三色染色
经4%的PFA(pH7.4)固定的LD样品用于Masson三色染色分析。固定后的样品连续经过酒精脱水(70% 酒精,30 min ;80% 酒精,30 min ;95% 酒精,30 min,3次;100% 酒精,30 min,3次)、二甲苯透明(20 min,3次)、石蜡浸蜡(2 h,3次)后包埋,并用切片机(Leica RM 2265,德国)进行石蜡切片。样品(7μm)经二甲苯脱蜡,梯度酒精复水后进行三色染色。样品置于显微镜下拍照(Leica DMi8,德国),其中每一样品均随机选取10个视野。
1.2.4 RNA提取和real time qPCR分析
LD样品中的总RNA依据Trizol试剂(Sigma,Saint Louis,MO,美国)说明提取,总RNA浓度和完整性由 NanoDrop(NanoDrop Instruments,Delaware,美国)和琼脂糖凝胶电泳共同确定。采用逆转录试剂盒(TAKARA Co.,Ltd.Dalian,中国)合成cDNA,CFX RT-PCR检测系统(Bio-Rad,Hercules,California,美国)进行real time qPCR分析。PCR循环参数如下:95℃,20 s;55℃,20 s;72℃,20 s,36个循环。引物序列见表1。扩增完成后,通过熔解曲线对产物纯度进行确认,PRL13作为内参基因。采用2-△△Ct法计算目的基因的相对表达量。
1.1.2 仪器。U3000高效液相色谱仪(配置DAD检测器,美国戴安公司);MS205DU电子分析天平(瑞士METTLERROLEDD公司);EXceed-AC-24超纯水机(成都康宁实验专用纯水设备);GT SONIC-P3超声波清洗仪(固特超声股份有限公司)。
1.2.5 蛋白质印迹法(Western blot)分析
取100 mg LD样品,溶解于500μL预冷裂解液中匀浆后,4℃14 000 r/min离心15 min。裂解液成分如下:20 mmol/L 三(羟甲基)氨基甲烷(Tris-HCl)(pH 7.4),2% 十二烷基苯磺酸钠(SDS),1% 聚乙二醇辛基苯基醚(Triton X-100),5.0 mmol/L 乙二胺四乙酸(EDTA),5.0 mmol/L 乙二醇双(2-氨基乙基醚)四乙酸(EGTA),1 mmol/L 二硫苏糖醇(DTT),100 mmol/L 氟化钠(NaF),2 mmol/L 偏钒酸钠(NaVO3),0.5 mmol/L苯甲基磺酰氟(PMSF)。取上清液,并与等体积的上样缓冲液(150 mmol/L Tris-HCl,20% 甘油,2 mmol/L的2-巯基乙醇,0.004%的溴酚蓝)混合后煮沸备用。制备好的蛋白样品经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecylsulhtate polyacrylamide gel electrophoresis,SDS-PAGE)(BIO-RAD,美国)、NC 膜转膜(BIO-RAD,美国)、封闭(脱脂奶粉)后加入相应的一抗与二抗。蛋白定量使用Odyssey远红外扫描系统(LI-COR Biosciences,Lincoln,NE,美国)完成。其中β-tubulin表达量作为内参蛋白。

表1 引物序列Tab.1 Primer sequences for real-time qPCR
本研究所用抗体信息如下:FABP4(bs-4059R),SREBP1(bs-1402R),CCAAT/enhancer-binding protein α(C/EBPα,bs-1630R),CCAAT/enhancer-binding protein β(C/EBPβ,bs-1396R),peroxisome proliferator-activated receptor γ(PPARγ,bs-4590R),β-tubulin(bsm-33034M)购于中国博奥森公司;ACC(#3662)购于美国Cell Signaling公司;山羊抗小鼠二抗(goat antimouse secondary antibody,926-68070)与山羊抗兔二抗goat anti-rabbit secondary antibody,926-32211)均购于美国LI-COR公司。
1.2.6 酶联免疫吸附测定(ELISA)分析
将500 mg LD样品加入4.5 mL pH为7.4的预冷磷酸盐缓冲液(phosphate buffer saline,PBS)中,并在冰上进行匀浆,4℃、2 500 r/min离心20 min后取上清,用于酶联免疫吸附测定(enzyme linked immunosorbent assay,ELISA)分析。试验所用试剂盒信息如下:FAS(ml03668)、ACC(ml036689)、MDH(ml036689)、LPL(ml025647)、HSL(ml036706)均购于上海酶联生物科技有限公司。
1.3 数据分析
本试验中,组内每只肉羊均作为一个试验单位,数据以“平均值±标准误”表示。试验数据使用Graphpad Prism 7统计软件(Monrovia,CA,USA)进行单因素方差分析,Duncan法进行多重分析。P<0.05则认为是差异显著,P<0.01则认为差异极显著。
2 结果与分析
2.1 日粮中添加SBP对肉羊LD剪切力的影响
剪切力是反应羊肉嫩度的重要指标。如图1所示,与对照组相比,肉羊日粮中添加7.8%SBP和16%SBP均可以极显著降低LD中WBSF(P<0.01)。

图1 日粮中添加SBP对肉羊LD中WBSF的影响Fig.1 The effects of different dietary SBP level on WBSF in LD muscle in lambs
2.2 日粮中添加SBP对LD中IMF的影响
2.3 日粮中添加SBP对脂肪细胞分化关键转录因子表达的影响
如图3a所示,日粮中添加16%SBP可显著提高ZFN423的mRNA水平(P<0.05)。与对照组相比,C/EBPα(图3b,P<0.01)与PPARγ(图3c,P<0.05)的mRNA表达极显著或显著上升。Western blot的结果显示,16SBP组中转录因子PPARγ和C/EBPα的蛋白含量显著上升(图3d、3e,P<0.05),而C/EBPβ蛋白含量未见显著变化(图3f)。

图2 日粮中添加SBP对肉羊LD中IMF的影响Fig.2 The effects of different dietary SBP level on IMF content in LD muscle in lambs
2.4 日粮中添加SBP对脂质代谢相关基因表达的影响
与对照组相比,16SBP组肉羊LD中SREBP1的表达在mRNA(图4a,P<0.05)与蛋白水平(图4b,P<0.05)均显著高于其他两组。如图4c、4d所示,日粮中添加SBP未显著影响FABP4的表达水平。与对照组相比,日粮中添加16%SBP可显著增加FAS的mRNA水平(图4e,P<0.05)。如图4f显示,日粮中添加7.8%SBP和16%SBP均可以显著增加ACC的含量(P<0.05)。
2.5 不同SBP水平对LD中脂肪代谢相关酶活力的影响
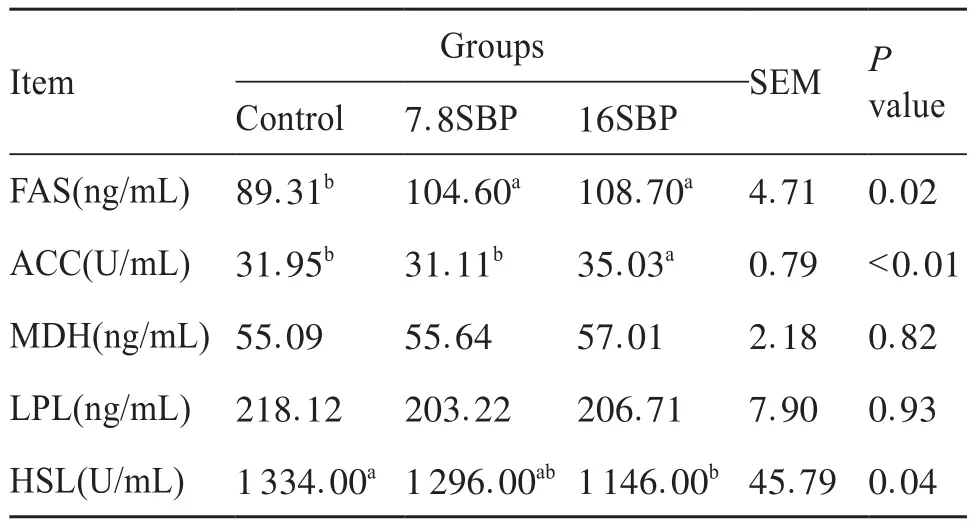
表2 日粮中添加SBP对肉羊LD中脂肪酸代谢相关酶活性的影响Tab.2 Effect of dietary SBP supplementation on fatty acid metabolism-related enzyme activities in Longissimus thoracis et lumborum muscle of lambs
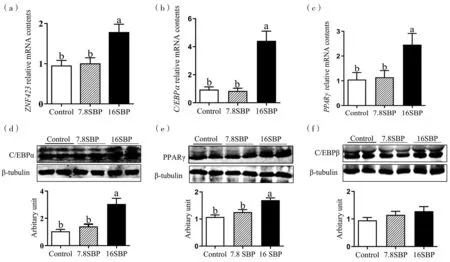
图3 日粮中添加SBP对肉羊LD中脂肪细胞分化转录因子表达的影响Fig.3 The effects of different dietary SBP level on adipogenesis related transcriptional factor expression LD muscle in lambs

图4 日粮中添加SBP对肉羊LD中脂质代谢相关基因表达的影响Fig.4 The effects of different dietary SBP level on the enzymes expression of lipid metabolism
如表2所示,与对照组相比,7.8SBP与16SBP组中的FAS活性显著升高(P<0.05),而ACC的活性在16SBP组中显著高于其他两组(P<0.05)。日粮中添加SBP未改变LD中的MDH活性。与对照组相比,16SBP组中的HSL均显著降低(P<0.05),而LPL未见显著差异。
3 讨论
随着羊肉消费市场的成熟,消费者对优质羊肉的需求逐渐增加。嫩度是决定羊肉品质的关键因素之一[15],其高低受到了动物品种、营养水平、饲养管理、养殖环境、宰前与宰后操作的影响[16]。WBSF是衡量肉嫩度的常用指标之一,WBSF越小,肌肉嫩度越好。本研究发现,日粮中添加7.8%SBP即可以显著降低WBSF,说明了SBP有提高羊肉嫩度的功能。黄酮是沙棘的重要活性成分之一。李垚等[17]在肉鸡日粮中添加沙棘黄酮后发现了鸡肉剪切力有下降趋势,本研究进一步证明了沙棘活性物质与肉嫩度的相关性。
肌内脂肪含量是决定肉品质的关键因素之一,其含量的高低影响了羊肉的多汁性、适口性、肉风味以及肉嫩度等指标[18]。本试验测定了IMF含量,并证明了日粮中添加SBP显著增加了IMF的含量。鉴于IMF对肉嫩度的贡献,添加SBP导致的IMF含量升高解释了WBSF降低的原因。与本试验结果类似的是,肉鸡日粮中添加一定比例的沙棘黄酮可以有效降低腹脂率,降低血液中的甘油三酯、胆固醇以及低密度脂蛋白,有效地提高了胸肌中的IMF含量[6]。结合我们的结果推测,沙棘中可能存在影响脂质代谢及肌内脂肪细胞分化的活性物质。
动物体内脂肪组织可分为4大类,皮下脂肪、内脏脂肪、肌间脂肪和肌内脂肪[19],其含量的高低受脂肪细胞分化能力与脂肪沉积能力的共同影响。在胚胎发育早期,肌肉纤维、肌内脂肪细胞和成纤维细胞来源于一种常见的间充质祖细胞群,在此期间形成肌源性或纤维/脂肪源性细胞谱系[20]。间充质干细胞分化为脂肪细胞经过两个阶段,即决定与分化[21],其中ZNF423在特化阶段其关键作用,决定了脂肪前体细胞的形成[22]。ZNF423可以诱导PPARγ的表达,它可以诱导纤维脂肪祖细胞分化为前体脂肪细胞进而分化为成熟的脂肪细胞。前人研究发现ZNF423在具有较高成脂能力的牛肌间质血管中含量丰富,ZNF423的过量表达促进了低脂细胞的成脂分化,反之亦然[23]。本研究发现,16SBP组的ZNF423基因表达量显著高于对照组,表明16SBP组肉羊LD有更高的前体脂肪细胞形成能力。脂肪细胞分化同时受到了C/EBPβ、C/EBPα和PPARγ等转录因子的共同调控,其中,C/EBPα直接与PPARγ基因的启动子结合,诱导其表达,并启动脂肪细胞特异性基因的表达,使前体细胞最终分化为成熟的脂肪细胞[24]。PPARγ是脂肪生成的主要调节因子,其激动剂(罗格列酮、噻唑烷二酮、吡格列酮等)通常对治疗代谢功能障碍和糖尿病有效[25]。前人研究表明,饲料中添加噻唑烷二酮和吡格列酮可以显著促进育肥猪IMF的沉积,而不影响背膘厚[26]。本研究证实了日粮中添加沙棘果渣可有效提高C/EBPα和PPARγ的表达水平,说明了沙棘果渣有增加LD中肌内脂肪细胞分化的功能,具体的活性成分有待进一步研究。
IMF含量的高低也与脂肪代谢能力相关。为了进一步分析SBP增加LD中IMF的原因,本试验分析了与脂肪酸代谢相关酶类的表达量及活性。SREBP1与细胞内脂肪酸的代谢密切相关,是诸多脂肪酸合成相关酶相关基因的转录调控因子[27]。本研究结果证明了日粮中添加SBP可有效地促进SREBP1的表达,而其下游基因ACC与FAS的表达也相应增加。ACC和FAS均为脂肪酸合成的关键酶,其中ACC 催化乙酰辅酶A的羧化反应生成丙二酰辅酶A,而FAS催化乙酰辅酶A和丙二酰辅酶A合成棕榈酸酯[28-29]。本研究结果证明了日粮中添加16%SBP可显著增加二者的酶活性。FABP4是一种脂肪酸结合蛋白,其表达高低与IMF含量及脂肪酸的合成能力呈正相关[30]。肉牛中的研究结果表明,FABP4是影响牛肉嫩度和IMF沉积的重要候选基因之一[31]。本研究发现的日粮中SBP对LD中FABP4、ACC及FAS的调控作用证明了日粮中添加SBP可以促进LD中脂肪细胞的脂肪酸合成。
除受合成影响外,IMF沉积能力与脂肪酸的分解有关。本研究发现,日粮中添加16%SBP可显著降低HSL酶活力。由于HSL是脂肪酸分解的限速酶,可以将甘油三酯分解成游离脂肪酸、甘油二酯和甘油[32],本结果说明了SBP可以抑制LD中脂肪细胞内的脂肪酸降解。虽然LPL可以将甘油三酯分解成脂肪酸和甘油,调控脂肪沉积[33],但本研究未发现LPL活性受SBP调控。
综上所述,日粮中添加16%的SBP可通过促进关键转录因子ZNF423、PPARγ和C/EBPα等的表达促进LD中脂肪细胞形成。同时促进ACC与FAS的酶活性,促进甘油三酯合成,抑制HSL酶活性,从而抑制甘油三酯分解,最终促进IMF的增加,降低肉嫩度。由于SBP中含有众多的活性物质,这些变化的转录因子及酶活性是受何种活性物质调控尚待进一步研究。
