果蝇隐(花)色素光感受机理的研究现状
2020-11-12姚鹏程周志强
姚鹏程,郑 伟,周志强,徐 蕾
(皖南医学院活性生物大分子研究安徽省重点实验室,芜湖 241002)
太阳给予了地球光和热,是生命的能量来源。但阳光中的中短波紫外线也会使生物体中的DNA产生损伤,进而抑制DNA的复制、转录,导致生物体受损、生长停滞甚至死亡[1]。光修复酶(photolyase)是进化过程中出现最早的DNA修复蛋白之一,其可利用光能直接修复紫外线导致的DNA损伤,恢复DNA的正常结构[2-3]。在进化过程中,一部分光修复酶的功能发生了异化,获得了调控基因表达以及生物节律的能力,而其DNA修复能力则减弱或丧失,从而进化成为隐(花)色素(cryptochrome,Cry)[4]。Cry根据其来源和结构特征,可分为植物隐(花)色素和动物隐(花)色素,而动物隐(花)色素又可分为I型和II型。植物隐(花)色素可作为蓝光受体参与调控植物的生长发育及光形态建成。动物II型隐(花)色素如哺乳动物隐(花)色素,可作为转录抑制因子参与抑制生物钟基因的转录表达,从而调控生物节律。而动物I型隐(花)色素,如果蝇隐(花)色素(Drosophilacryptochrome,dCry),则作为光受体参与校准生物节律[4]。
果蝇饲养简便,遗传背景清楚,仅含有四对染色体,便于研究,可通过化学诱变获得其突变体,并且可通过转座子转导等方法对其进行转基因操作,是生命科学中常用的模式生物之一。果蝇体内基因组中约50%与哺乳动物编码蛋白质的基因具有高度同源性,约有60%的人类疾病相关基因在果蝇的基因组中存在直系同源物。因此,以果蝇为模式生物探究人类的生理活动以及疾病发病机制有非常重要的作用和意义[5]。2017年,诺贝尔生理学或医学奖得主Hall JC、Rosbash M及Young MW在有关生命节律的分子机制研究过程中也选择了果蝇作为主要研究对象。本文针对目前关于dCry光感受的机理及其信号状态的争论,综述了dCry在果蝇生物钟系统中的功能、结构特征以及其光感受机理和信号状态的研究现状,并对今后的研究方向作了展望。
1 dCry在果蝇生物钟系统中的功能
人们很早就发现果蝇的运动以及蛹的羽化都具有明显的昼夜节律[6]。1971年,Konopka等[7]通过化学诱变得到了三种果蝇突变体(per0,perS和perL),分别能引起果蝇羽化及自发运动节律的丧失、加快和减慢。这三个突变都位于同一个基因上,该基因被命名为period,简称为per,以表明其调节生物节律的特性。这一发现首次在分子水平证明了生物钟基因的存在。在per基因发现二十多年后,人们陆续在果蝇中发现了其他生物钟基因,如timeless(tim)、clock、cycle、jetlag(jet)以及cry等[8-12]。这些生物钟基因及其表达的蛋白质组成了果蝇的生物钟系统。其中Clock和Cycle是转录因子,两者形成二聚体后,在核内可通过与增强子E-box结合激活一系列生物钟基因的表达。而Per和Tim蛋白可形成二聚体,抑制Clock和Cycle对生物钟基因(包括per和tim在内)的转录激活作用,这样就形成了一个转录/翻译反馈振荡回路,从而形成了基因表达的生物节律[4,9,13]。
dCry在果蝇生物钟系统中可作为光受体对光进行感受,以光照为线索对生物节律进行校准。其在光照条件下构象发生改变,C末端尾巴(C-terminal tail,CTT)弹出,位于其中心的活性区域暴露,进而通过与Tim蛋白结合使其通过Jet介导的泛素化途径降解,从而解除Per-Tim二聚体对Clock和Cycle的抑制作用,使得生物钟基因转录激活;而在暗处,dCry与Tim解离,转录激活被重新抑制,从而起到校准作用[4,13]。此外,有报道表明,在长时间光照下,dCry自身也可发生降解[12]。
2 dCry的结构特征
在一级结构上(图1a),dCry的N末端与6-4光修复酶(一类可以修复DNA上紫外线造成的6-4光产物损伤的光修复酶)高度同源,称为光修复酶同源区(photolyase homology region,PHR)[14]。但与光修复酶不同的是,dCry在C末端还存在一段短的尾部延伸,即C末端尾巴。
2.1 光修复酶同源区
晶体学研究揭示了dCry的空间结构(PDB ID:4JZY,4GU5),其N端与6-4光修复酶的结构高度同源,即光修复酶同源区。光修复酶同源区又可分为两个相对独立的结构域,即α/β结构域(α/β domain)和α螺旋结构域(α-helix domain),两者由一段肽段连接。在连接肽段中存在C末端尾巴基环(CTT base loop,氨基酸154~160位)模体,可以支持结合C末端尾巴。在光修复酶的α/β结构域和α螺旋结构域之间,通常可以结合一个可以增加酶的光吸收能力的天线辅酶。但目前研究表明,与光修复酶不同,dCry并不结合天线辅酶[15-16]。
dCry的α螺旋结构域和光修复酶一样,可以结合一个黄素腺嘌呤二核苷酸(flavin adenine dinucleotide,FAD)辅酶,此结构域也可称为FAD结合结构域,该区域高度保守[17-18]。功能研究表明,FAD辅酶的结合对于dCry行使光感受功能是必需的[14]。在α螺旋结构域中,dCry含有色氨酸(tryptophan,Trp)三联体的电子传递路径(W342、W397、W420),可在FAD光照还原中起到电子传递的作用,与光修复酶类似。最近的研究表明,可能还存在第四个Trp(W394)也在FAD光还原的电子传递中起作用[19]。值得注意的是,在dCry的α螺旋结构域中,位于FAD辅酶N5位侧面的一个残基是C416,这不同于绝大部分光修复酶,该位点在大部分光修复酶中为保守的天冬酰胺。C416位残基可能有助于dCry的FAD辅酶在光还原反应中保持在阴离子自由基状态(FAD·-),此状态可能为 dCry的激活所必需的条件[14,20]。此外,Xu等[21]的研究表明,位于FAD辅酶中异咯嗪环si面上方的V415位残基也对在光还原反应中维持FAD·-状态的稳定性有贡献。
在α螺旋结构域中,dCry还存在一些与6-4光修复酶类似的模体,如磷酸结合环(phosphate-binding loop,氨基酸249~263位)、突出模体(protrusion motif,氨基酸288~306位)等结构。但不同的是,6-4光修复酶在磷酸结合环处出现了近90°的弯曲,而dCry则是在其α8螺旋的基础上多延伸了两圈,从而在磷酸结合环处形成了一个小区域,使得FAD更容易与外界接触、受外界影响。此外,dCry在类似于光修复酶结合底物的识别区域的位置还存在一段富含丝氨酸的C末端盖子(C-terminal lit,氨基酸420~446位)模体,可参与和C末端尾巴的结合,其中包含若干磷酸化修饰的位点[15-16]。空间上,前述光修复酶同源区的C末端尾巴基环、磷酸结合环、突出模体以及C末端盖子等模体形成一个口袋结构,可通过类似于光修复酶结合底物的方式结合C末端尾巴(图1b),这些模体可统称为C末端尾巴耦合模体(CTT-coupled motif,CCM)[17]。
2.2 C末端尾巴
dCry的C末端尾巴(氨基酸528~539位)形成了一段α螺旋,占据了光修复酶同源区中由若干CCM组成的口袋结构[14]。C末端尾巴中存在由三个连续的芳香族氨基酸(F534、F535、W536)组成的FFW模体(F代表苯丙氨酸,W代表色氨酸),以类似于底物与酶结合的方式与光修复酶同源区中的口袋结构紧密结合。其中,F534位残基结合于口袋结构的中心位置,与口袋底部的FAD辅酶相接近[15-16]。有趣的是,在与dCry作用的生物钟蛋白Tim中也存在一段含有FFW模体且类似于dCry的C末端尾巴的区域(Tim C-terminal tail-like,Tim-CTL)[14]。由此可推测,C末端尾巴在暗处与CCM结合,可以阻止dCry与Tim结合并维持自身稳定。在光照条件下,dCry被激活后C末端尾巴从活性口袋中弹出,然后dCry可与Tim-CTL结合发挥作用,或者直接激活dCry自身的降解[20,22-23]。
3 dCry的光感受及信号状态
3.1 dCry的光感受
对于dCry的光感受机理,目前尚未完全阐明。有观点认为,dCry中FAD的光还原或化学还原是其光感受所必需的过程[14,20,24]。Vaidya 等[14]在 2013 年发表的文献中证明,采用光还原或者化学还原可使dCry中的FAD达到阴离子自由基型FAD·-(或完全还原型FADH-)状态,结果表明,这两种还原方式均可使dCry构象发生变化,并且氧化后构象会恢复。而另一种观点则认为,dCry中FAD在细胞内可能是FAD·-,在光照下激发为 FAD·-的激发态(FAD·-*)才会导致构象变化并激活dCry,且单纯的化学还原不能使dCry激活[25-27]。然而,后一种观点的问题在于,dCry的FAD·-状态不稳定,容易被氧化,该状态在细胞中是否稳定存在尚有疑问,且一些试验测定表明,在体内dCry所结合的FAD可能是氧化型(FADox)而不是FAD·-型的[14,24]。尽管目前看来,前一种观点较为可信,但该试验结果显示dCry的光感受是一个可逆的过程,这就与一些研究所示的dCry光感受不可逆性相驳斥[28-30]。上述研究结果表明,dCry的光感受除光还原外还存在着一些不可逆的过程。
有文献报导称,dCry白天不稳定,但在夜晚稳定,其表达量在夜间达到最大值,暗示了光照也可增加dCry的降解,说明dCry的光感受存在不可逆性[4,12,14]。Busza 等[23]在之后的对 dCry 光感受时结构变化的研究中也证明了光照停止后降解即停止。在机制的研究中,Ozturk等[31]发现果蝇体内存在着dCry的光依赖性受体BRWD3(bromodomain and WD repeat domain containing 3),该受体在光照下与dCry相连接,并通过BRWD3/DDB1/CUL4/ROC1 E3连接酶复合体使dCry泛素化降解。这种变化还可能通过电子传递、蛋白相互作用或磷酸化状态的改变对dCry的下游信号转导起重要作用,其具体的机理目前还在研究中[12]。

图1 果蝇隐色素的结构Fig.1 The structure of Drosophila cryptochrome
此外,体外研究也说明了在长时间蓝光的作用下,Trp失电子形成阳离子自由基TrpH·+,该自由基与蛋白骨架中其他正电氨基酸相排斥,引起dCry中α22螺旋的构象改变、CTT从活性区域弹出、Trp分解、FAD脱落这一系列不可逆反应[28]。实际上,大部分光修复酶和Cry中都含有Trp三(四)联体的电子传递路径。先前的研究表明,dCry中Trp三联体(W342、W397、W420)的突变会使得体外光还原受到阻碍,但不影响 dCry 在体内的生理活性[26-27,32-33],这说明 Trp在dCry的光感受中扮演的角色有待进一步明确。因为Trp三联体中Trp与FAD的位置远近不同,正电荷所在部位对光照下dCry的稳定性有着不可忽视的作用。Trp420最靠近FAD残基,而Trp420H·+状态相对不稳定;Trp342与FAD残基距离较远,Trp342H·+状态则相对稳定[28]。
3.2 dCry的信号状态
对于dCry的信号状态,光还原试验给出了两个可能的模型:一种是当FADox被还原为FAD·-后,dCry构象改变,此时为信号状态(图2a);另一种是当FAD·-进一步被激发,形成激发态,即FAD·-*时,dCry构象才发生变化,进而介导信号传导(图2b)[14,25]。这两种模型都是以FAD状态转变为核心,对dCry的信号状态进行阐述,即dCry从基态到信号状态的改变仅由FAD状态的变化引起。Hoang等[24]在对果蝇体内dCry活性的研究中,比较不同波长光引起50%dCry降解的时间,并绘制其作用光谱,发现作用光谱峰值位于450 nm处,与dCry中FAD的特征吸收峰一致,更是进一步证明了上述理论。
Peschel等[34]通过小角度X射线散射试验,从动力学角度进一步对dCry的信号状态进行了研究。该试验支持前期的一个试验结论——信号状态dCry的CTT从原先口袋结构中弹出[14-15]。此外,Berntsson等[35]的研究还说明了dCry需在CTT某个残基上接受一个H+后,才能顺利弹出。因此随着pH值的升高H+减少,使得传递受阻,dCry向信号状态的转化会被减缓或阻止,但是H+具体的结合位点尚未明确[35]。保守的H378位于FAD与CTT之间,并且在dCry的光反应中发挥质子化作用[36]。但动力学分析表明,突变体H378A在两个不同的pH下,信号状态的形成并未发生改变,说明H378并非H+的结合位点[35]。该观点所支持的信号状态相当于在先前的基础上加上了一个质子,补充了先前的理论,但质子具体的位置还有待进一步确认。
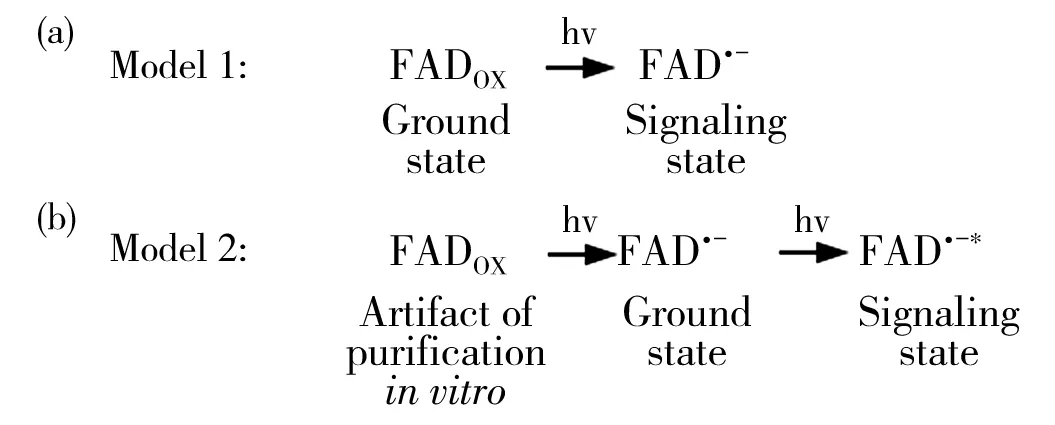
图2 果蝇隐色素两种可能的信号状态模型[14]Fig.2 Two signaling state models of Drosophila cryptochrome[14]
dCry不仅在450 nm附近的蓝光作用下发生反应,对长波紫外光也同样敏感[37]。VanVickle-Chavez等[38]在dCry光降解的试验中,在N末端连接一个荧光素酶,使dCry在光照下更易降解并便于检测,同时在暗处仍能稳定表达。通过测定在不同波长光照下荧光酶素的活性损失并绘制作用光谱来探究其作用的差异。结果表明,作用光谱在390 nm处达最大值,这与Hoang等[24]提出的氧化型FAD的特征吸收峰在450 nm处达最大值不同[25,37]。该结果与上述两种试验提出的信号状态相矛盾,暗示了dCry在光照下存在FAD光还原以外的变化。值得注意的是,Kao等[39]对dCry的光谱学研究表明,dCry存在特殊荧光特性,不遵守一般的卡莎规则(Kasha’s rule),表现为对不同波长的激发光其荧光发射峰的波长也不同。该作者将此现象解释为FAD基态和激发态发生“锥形交叉”(conical intersection,CI)的结果,这种荧光性质是否和dCry的光感受和信号状态有关,目前尚未有研究。
此外还有文献显示,在野生型果蝇中dCry可介导红光所诱发的去极化,这种去极化在敲除dCry的果蝇以及经FAD特异的抑制剂处理的果蝇中并不存在,这也提示了中性自由基FADH·可能在参与dCry信号状态的形成[40]。综上所述,dCry可对不同波长的光产生不同的反应,而以往单一试验中往往仅使用蓝光或是紫外光,这可能使试验的结果不够完整,而应用不同波长光对dCry信号状态进行研究无疑是一条重要的思路。
4 总结与展望
dCry是一种光感受蛋白,作为果蝇生物钟系统的重要组成部分,明确其作用机理有着重大意义。现有研究已确认,dCry可以通过光依赖的方式与Tim结合,并促进其通过泛素化途径降解,从而解除Per-Tim二聚体对生物钟转录因子Clock-Cycle的转录抑制作用,进而校准生物钟。在此过程中,dCry结合的FAD辅酶、CTT以及Trp三(四)联体等结构均扮演了重要角色。然而,dCry具体的光感受机理及信号状态尚未完全阐明。对于dCry的光感受机理,目前需要明确的问题包括:FAD以何种状态(氧化还原状态、基态或激发态)激活dCry的构象改变,以及光感受的过程是否可逆。对于dCry的信号状态,问题体现在光照下dCry是否存在除FAD光还原以外的作用,以及不同波长的光对dCry的影响。
针对上述问题,我们也有一些有待验证的设想。我们猜测光照下Trp三(四)联体上正电荷的位置对dCry构象的改变起着重要的作用。在光降解试验中,尽管450 nm波长的蓝光对dCry中FAD辅酶的光还原作用最快,但对降解的作用却十分微小[38]。这可能是因为蓝光对电子传递的作用较强,使得正电荷更多地分布在距离FAD中心较远的W342上,与周围正电荷氨基酸的经典排斥作用较弱,因而对FAD乃至整个蛋白分子的影响较小。而使用波长较小的390 nm波长紫外光照射时,尽管光还原速率慢于蓝光,但对电子在Trp三(四)联体上的传递作用也较弱,使得正电荷停留在靠近FAD中心的W420上,对FAD以及其活性中心的正电荷氨基酸有着较强的作用,因而对整个构象的影响较大。后续的研究中,我们可以利用分子克隆技术构建dCry突变体并绘制光降解作用光谱,从而进一步明晰dCry光感受机制。
此外,我们还推测dCry特殊的荧光性质可能在光感受中起重要的作用。为验证该设想,我们可以构建关键位点的突变体或截去CTT构建截短突变体,比较分析各突变体荧光及光照下荧光变化的差异,以探究dCry特殊荧光特性产生的机制,了解dCry是否存在类似绿色荧光蛋白(green fluorescent protein,GFP)一样的特殊荧光结构[41],并尝试分析荧光与光还原的关系、各氨基酸残基之间的作用关系。其次,在对dCry光感受结构变化的研究中,可通过蛋白酶解试验[14,25]研究光照不同时间及暗处恢复dCry的结构变化和变化速率,阐明光感受是否可逆。Tim是果蝇生物钟系统中直接与dCry作用的蛋白,研究在不同条件下dCry与Tim的蛋白相互作用对dCry光还原、光降解的影响对果蝇生物钟系统的发展显得尤为重要。最后,还可以利用热分析、液相层析、圆二色谱、小角度X射线散射等多种方法对dCry在不同波长光照射下的结构变化差异进行探究,从而明确dCry的光感受机理及信号状态。通过上述试验,我们期望能进一步明确dCry的光感受机理,为深入了解dCry的生理功能和作用机理打下基础。
综上所述,目前人们对于dCry在果蝇生物钟系统中的基本功能及其蛋白结构等方面已有比较透彻的认识,但对于dCry光感受的具体过程、光感受的信号状态等问题尚存在一些争议,光感受的具体机理有待进一步阐明。继续研究dCry的光感受机理,不仅对于深入认识生物体对生物钟系统的调控方式具有重要意义,也有助于蛋白质光生物化学和光生物物理研究领域的深层次拓展。
