光学相干层析的三维血管成像方法及其算法
2020-11-12郭晋豪刘智明钟会清郭周义庄正飞
郭晋豪,李 阳,刘智明,钟会清,郭周义,庄正飞
(国家中医药管理局中医药与光子技术三级实验室&广东省激光生命科学重点实验室,华南师范大学生物光子学研究院,广州 510631)
光学相干层析(optical coherence tomography,OCT)具有非入侵性、可跨层成像、高分辨率、高灵敏度、快速成像的技术特点,在皮肤、肠胃、心脏、神经、眼科等医学领域应用广泛。由于眼睛的近似于透明介质的特点,入射光可穿透眼前节到达视网膜、脉络膜,使OCT技术很早便被应用于眼科成像[1]。在初期,结构相对简单的时域OCT在医学上得到了一定的发展。随着傅里叶域OCT [(Fourier-domain OCT,FD-OCT),其包括频域OCT和扫频光源OCT]的噪音问题被逐步改善,OCT的成像速度大大加快,进一步促进了OCT三维成像的应用[2]。
光学相干层析血管造影(optical coherence tomography angiograhpy,OCTA)是FD-OCT在血管成像中的应用,它是一种非接触性、快速、安全的活体检测成像方法。传统OCT无法在组织中区分出血流,血流中血红细胞的移动造成背散射光信号不稳定,而静态组织中光的背散射强且信号相对稳定。利用该特点,在原FD-OCT采集到的OCT数据集中,用算法可对组织中的血流成像。
在传统眼科检查中,荧光素血管造影(fundus fluoresce angiography,FFA)和吲哚青绿血管造影(indocyanine green angiography,ICGA)被誉为“金标准”。这两种方法具有成像角度广、动态成像、无成像伪影的优点。但是,FFA不能检测出脉络膜异常,荧光素从脉络膜快速泄漏时影响其检测,且两种方法所成的像均为二维图像,无法对病灶进行空间定位以及详细选层观察。此外,注射造影剂还可能引发患者恶心、呕吐、过敏,严重者甚至死亡[3]。而OCTA与FFA 和ICGA相比,其穿透性好、分辨率高、可三维成像等优点便于医生分析确定病因,无需注射、无副作用使它可成为日常眼科检查的手段。
OCTA在临床上有广泛的应用,如糖尿病视网膜病变、青光眼、年龄相关的黄斑变性、脉络膜新生血管等与眼部血管相关的疾病的诊断。围绕临床诊断这一重点应用,国内研究者近年开展了各眼科疾病在OCTA方法下的表现和量化测定工作,但在OCTA硬件研制和算法开发方面的工作相对较少。
1 OCTA及其算法
在FD-OCT中,若干个轴向(激光的入射方向,与深度z同向)扫描(A-san)组成横向二维图,若干个横向二维图组成三维的OCT图像。对光强-频谱函数进行傅里叶逆变换后即可得出光强关于深度z的函数,并且分为振幅和相位项[4],即
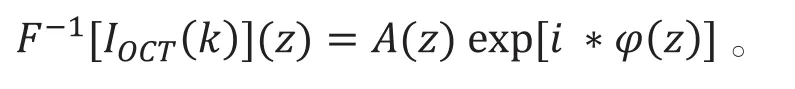
本文根据算法利用振幅与相位信息的情况,把要讲述的OCTA进行如下分类,如表1所示。

表1 OCTA分类Tab.1 Classification of OCTA
1.1 基于相位的OCTA
基于相位的OCTA算法主要包括多普勒OCT(Doppler OCT,DOCT)、相位方差、相位梯度血管造影及其拓展的裂频相位梯度血管造影。
1.1.1 DOCT
DOCT利用多普勒效应进行工作。血管中血红细胞的移动引起入射光发生多普勒效应,从而引起波的频率、干涉条纹相位发生变化,由此确定血管中血液的流动状态。由于利用了相位项,DOCT除了血管成像外,还有测血液流速、血管直径的功能。
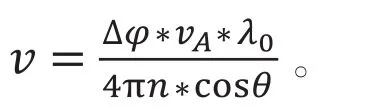
可见该方法所需系数多,入射光与血管垂直时测不出血流的流速,且视网膜中的目标血管与入射光的夹角往往难以知晓[5]。
在成像速度和灵敏度都有优势的FD-OCT出现后,傅里叶域DOCT随之发展。研究者们想出若干方法测量血流的速度。一种方法是用局部血管梯度法,测量相邻血管横截面层析图的血管梯度,从而得出缺失的角修正因子,其缺点为处理数据量大且耗时长[6]。另一种方法是使用冠状面提取速度矢量:用两幅横向血流图提取出血流血管的直径、方向与位置。上述两种方法均容易受到眼睛运动的影响,血管与入射光夹角的获取仍需解决[7]。
在解决眼睛运动的问题上,第一个将DOCT用于活体人眼成像的团队则使用了大样本运动引起的多普勒位移补偿算法和基于相关算法对样品的运动进行补偿[8]。而后发展出多光束入射方法,其中常用双光束入射方法,即用偏振方向相互垂直,或者光程编码、入射方向带夹角α的两路入射光,分别测出每路入射光的相差用下式算血流的绝对速度,即其中β为血流速度矢量平面与入射光束平面的夹角,λ为入射光中心波长。由于采用双光路入射,在测量血流时两光路的相差几乎不变,眼动带来相变从而影响血液流速测量的问题得以解决[9]。
DOCT可应用于测量视神经盘的总血流和血管直径。在视神经盘周围进行方形或圆形扫描,算出每条进入视神经盘血管的血流量后相加,即可得总视网膜血流量。血液高吸收、高散射的特性会导致阴影效应,遮挡血液下面的血管边界,影响测量。因此,用相位方法测量血管直径时,更易受到管壁附近低流速和系统相位噪声的影响。在用双光束入射测量视神经盘血流速度时,要求克服β角较大带来的错误估算引起的计算速度误差大的问题。Blatter等[10]用旋转的道威棱镜使入射光束探测面总是平行于速度矢量,使得测量不再依赖于获取的血管角度。
频域OCT的扫描速度越快,相邻扫描的时间间隔越短,散射光在单个扫描间隔中传播的距离相应缩短,从而使DOCT可测量的速度下限变大,成像精度降低。因此,加快扫描速度和提高灵敏度成为DOCT的矛盾。
1.1.2 相位方差
相位方差光学层析扫描(phase variance-OCT,PVOCT)利用OCT信号中相位变化的方差值识别出静态组织中血红细胞的运动。固定扫描时间间隔为T,频域OCT中信号相位方差的组成成分如下所示:
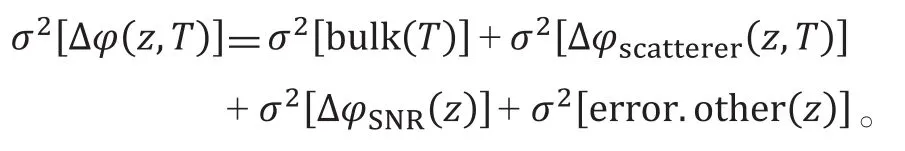
MB扫描模式是在同一个横向的不同位置进行M扫描。该模式下,扫描间隔T2>>T1,用得出成像信号。用此方法可消除与T无关、只与深度z相关的项,留下T1、T2时间段内项的差。PV-OCT采用MB扫描模式不仅增加了相位图之间的最大时间间隔T,更通过改善成像的统计方法增加了标准多普勒血流成像的动态范围。
BM扫描模式为在同一个横向面上进行多次B扫描。在BM扫描模式下相位噪音项需要通过数值估算后进行补偿。收集到的OCT信号可由信号S和噪声N的复数形式表示:
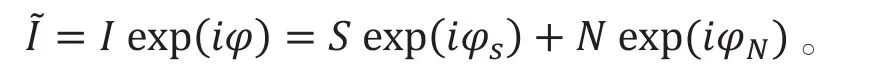
因此,OCT信号强度可由下式表示:
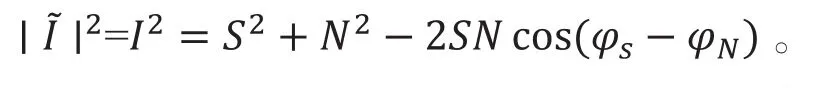
由于噪音相位的随机性,强度在一段时间内取平均值可以消除交叉项,因此OCT的信号可以表示为通过估算的值得出不同情况下N2的估值,即可得出最终的成像信号S2。在BM扫描模式下,扫描时间间隔增大,血流运动和布朗运动的比值提高,对比度也因更多的图像数据得到应用而提高[11]。与DOCT相比,PV-OCT的扫描速度与灵敏度不发生矛盾。
1.1.3 相位梯度血管造影
相位梯度血管造影(phase gradient angiography,PGA)先对两个不同时间的相位信号相减,再分析总相位变化信号的组成项,如下式所示:
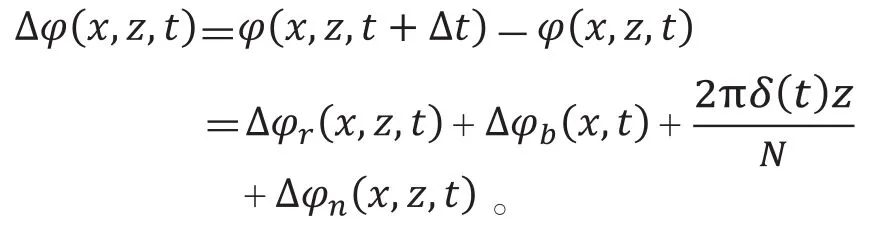
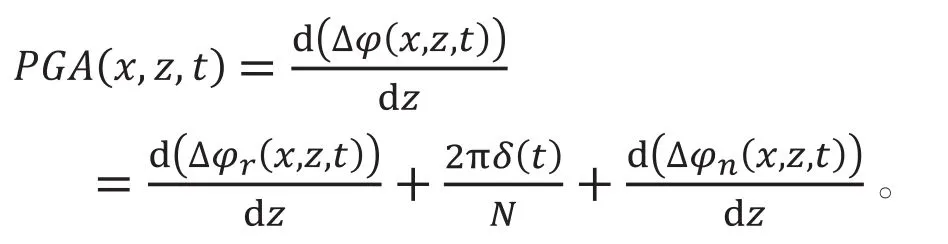
下式计算血管造影信号:
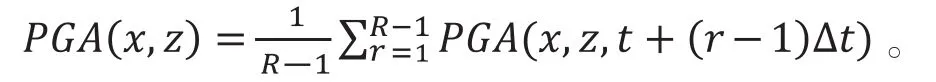
PGA结合裂频技术(split-spetrum)可以改善PGA的成像质量,得到裂频相位梯度血管造影,即SSPGA(split-spectrum phase gradient angiography),如下式所示:
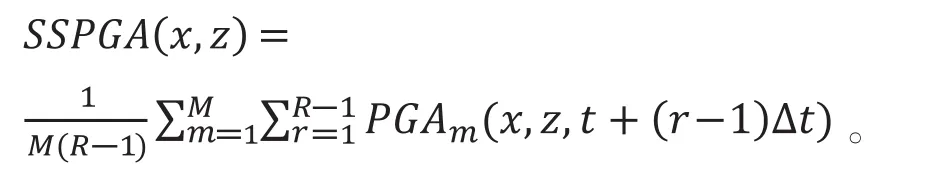
其中M为裂频的数量,m为M的序号数。
PGA与振幅信号、裂频方法相结合的裂频振幅相位梯度血管造影,将在下面基于复合信号的OCTA中提到[12]。
1.2 基于振幅的OCTA
用振幅或散斑信息进行血流成像的原理在于随机介质中散射粒子运动时会引起背散射光的相位变化,导致干涉条纹的频谱或者散斑发生变化,对变化作一定的处理,即可在一定程度上对血流信号进行表征。用OCT信号中的振幅信号进行成像既有优点也有缺点。一方面,只用振幅信息可以使其减少相位噪声,尤其是来自光源的相位噪音的影响;另一方面,当血液流动只引起相位变化而不引起振幅变化时,则达不到很好的血流成像效果。下面讲述振幅OCTA的几种算法。
1.2.1 散斑方差
由于进行频谱散斑分析对计算速度和成像帧率要求高,散斑技术在FD-OCT开始发展的一段时间内并没有得到很好的应用。在扫频光源和傅里叶域锁模技术的发展改善了扫描速度和成帧速度后,基于散斑的OCT得到了更好的发展。基于散斑的成像技术可用于血管成像、定量检测、实时监测等以血管为目标的治疗。其中利用散斑光强计算衬比时,可用于计算血管流速进行流速成像,而散斑方差(speckle variance,SV)方法通过计算散斑光强的方差成像,如下式所示:
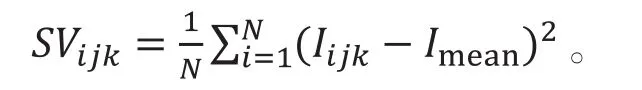
其中i为用于横向扫描中慢扫描轴的指数,j为横向扫描中快扫描的指数,k为深度指数。SVijk为所需的成像散斑方差信号,N为计算方差数量的窗口值,Imean为N次B扫描的平均强度[13]。
与同样是多功能OCT的DOCT对比,SV方法基本对任意入射角度均可成像,不受入射角度的影响,且由于算法相对简单,基本可做到实时成像。但是,SV方法同样也受投影伪影、体动伪影的影响。随后散斑方差算法的团队进行模型试验,探究了重复扫描次数N和帧间扫描时间间隔对成像质量的影响,用所得结论可获得更高的成像质量,但是所需成像时间也大大增加[14]。
1.2.2 相关映射
相关映射OCT(correlation mapping OCT,cmOCT)算法用来自同一位置采集的两个B扫描的强度信息,强度分别为IA、IB。在B扫描形成的帧中的xy轴向定义一个长宽为M、N的格子(相当于SV方法中的窗口),用于选定每个像素进行相关运算所用到的隔壁像素的数量,格子越大则运算时间越长。相关映射(correlation mapping,cm)方法计算相关值算法如下:
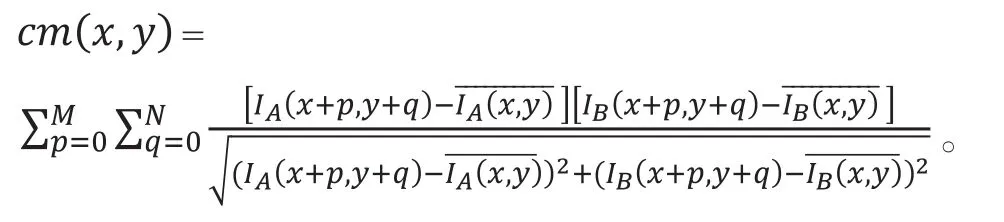
每个像素cm(x,y)值的范围为(-1,1)。反射物的流动性越小,相关值越大,据此设置阈值区分血管、组织。算法的灵敏度受窗口选择的影响:小窗口易受噪音以及环境变化影响,大窗口对小血管的成像能力不够强。对于低相关值的环境噪音,采用结构掩模(structural mask)方法抑制。
Lal等[15]使用更高速(200 kHz)的扫频光源在BM扫描模式下,对同一位置的8个A扫描的强度分布用一维交叉关联,补偿轴向动伪影;对不同位置的B扫描之间用图像配准方法,补偿横向动伪影。去除了较高和较低的相关值后,取N-1个同一位置的cm信号的均值,成像后用3×3的窗口逐个进行窗口滤波改善信噪比。该方法在同样的试验条件下比SV成像算法成像质量更优。cmOCT能识别出非常低速的液体运动,甚至是布朗运动,比DOCT有着更高的灵敏度,使其可以探测更微小的血管[16]。
1.2.3 裂频振幅去相关血管造影
在成像的算法原理上,裂频振幅去相关血管造影(split-spectrum amplitude-decorrelation angiography,SSADA)与cmOCT方法类似。cmOCT算法利用强度信号计算血管和组织的相关值,而SSADA算法用振幅信号计算血管和组织的去相关值:若扫描位置的流动性越大,则去相关值越大,图像赋予的亮度就越高。SSADA算法用BM扫描模式采集大量数据。在文献[17]中,在同一位置进行N=8次的B扫描,在对获取的数据进行预处理(去除噪音和自相关项)后,1个A扫描处有M个不同的频谱,原文中个数为 4,即k1、k2、k3、k4合成一个像素k,傅里叶变换后得到关于深度的复信号,即。而去相关运算只用复信号中的振幅项A(x,z),结合裂频方法,去相关信号算法如下式所示:
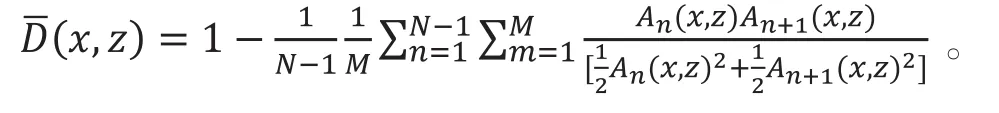
为提高信噪比,进一步设置阈值去除设置背景噪音,设置阈值去除眼球微动影响的帧,再取重复扫描算出的去相关信号的均值。2012年文献[17]发表时,尽管受伪影影响,但对活体视网膜成像的效果比DOCT要好,配合自动分层、亮度表征去相关值、最大值投影法等技术,SSADA对视网膜、脉络膜层血管成像的视觉效果良好。在2015年,Jia的团队[18]进一步对该算法完善的工作进行了报道,用去中值和3D正交配准方法进一步减少伪影影响,并通过模型试验探究参数设置对信噪比的影响,进一步改善了系统参数。
轴向信号采用了裂频技术,轴向分辨率有所降低,但是视网膜、脉络膜上的血管分布多为横向,与入射光垂直,因此采用SSADA算法成像更不容易受到轴向体移的影响,对视网膜、脉络膜的血管成像效果较佳。美国光视公司Optovue推出的OCTA产品AngioVue就采用了SSADA算法,在美国的OCTA产品中销量最高。
1.3 基于复合信号的OCTA
根据前面所述,基于相位信号的方法在不增加系统复杂程度的情况下,由于多普勒角的存在往往难以对垂直于入射光的血管成像,而且组织和血管的各向异性使组织也存在一个较小的多普勒频移,其与血管的多普勒频移重叠从而减少了对毛细血管血流的探测灵敏度。而基于振幅或强度信号的方法,由于毛细血管低流速可能只改变相位信号而不改变OCT信号的强度,因此难以对低流速的毛细血管进行成像。复合信号既包含振幅信息也包含相位信息,故该方法可较好地改善上述情况。
1.3.1 光学微血管造影
光学微血管造影(optical microangiography,OMAG)的相关学术文章最早由Wang团队[19-20]发表。OMAG算法用BM扫描模式获取图像的原始数据,采用BM扫描模式能增大B扫描的时间间隔,从而增大成像的灵敏度。该算法在采集信号后,直接把所采集到的横向慢轴信号相减,即
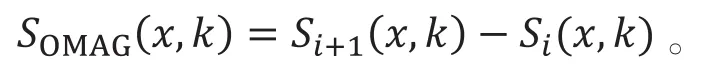
其中i为代表慢轴方向的下标。在信号相减后再对x~k的空域信号进行傅里叶变换得到2D的xz面方向的OCT信号,即
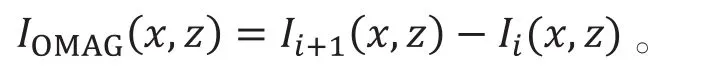
在慢轴上对复数形式的信号进行相减,相当于在慢轴上对信号进行高频滤波,也因为同时使用了相位和振幅信号而克服了单使用振幅或者相位信号的缺点,在成像表现上比单独使用振幅或者相位的方法要好。配合上BM扫描模式在同一位置进行的N次重复B扫描,用于成像的血流信号可由下式给出,即
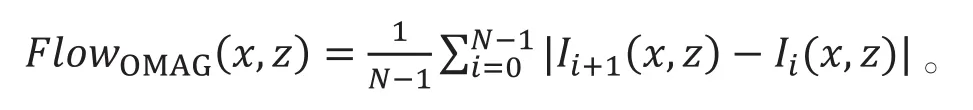
在OCTA中的一个大问题就是被检验者的眼运动问题。OMAG算法同样需要对体动带来的相位变化进行补偿。Wang的团队[21]在对其OMAG方法改善的过程中,在硬件系统中用扫频光源OCT替换频域OCT使扫描速度加快,然而扫频光源触发抖动引起的相变项同样会引起相位噪音,不对触发抖动引起的噪音进行补偿则会影响成像质量。在众多的OCTA产品中,蔡司(Zeiss)品牌所用的算法就是OMAG,并把视网膜跟踪技术应用于其OCTA产品中,在一定程度上改善了眼动在成像中带来的伪影和无效帧的问题。
1.3.2 裂频振幅相位梯度血管造影
裂频振幅相位梯度血管造影(spilt-spectrum amplitude phase gradient angiography,SSAPGA)由1.1.3所述的SSPGA与振幅信号结合而得。成像计算时,只用相位信号会使得来自组织各向异性导致的频移与运动血红蛋白的多普勒展宽发生一部分重叠,使灵敏度降低。SSPGA结合了振幅信号后得到的SSAPGA方法增强了微小血管的成像能力。用于成像的SSAPGA的信号由下式算得:
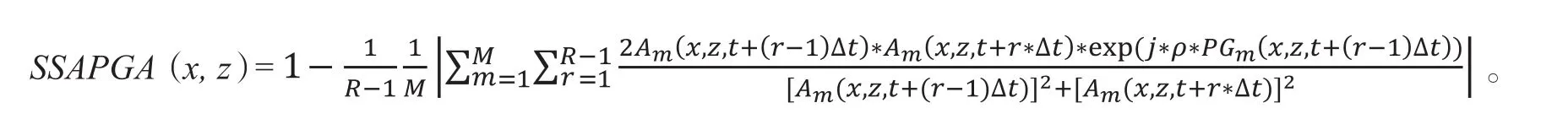
基于PGA算法,SSAPGA算法不用再额外去除体动带来的相位变化。经对比,使用了裂频方法的SSPGA算法比没使用裂频方法的PGA算法效果好一倍,说明了裂频方法可有效改善OCTA成像效果。与SSPGA算法和之前经过优化的SSADA算法量化对比,加入振幅信息后的SSAPGA算法在成像的各方面都表现得更好[12],而该算法的缺点是运算相对复杂,在计算耗时上不占优势。
1.4 OCTA的对比
OCTA对比传统的FFA和ICGA,在成像质量、临床辅助病症分析的便利性、耗时、被检查者体验、日常可重复性等方面都有优势。
同时,利用相同的原始扫描数据,在同样的预准备、后处理流程下,文献[12]和[22]对PGA、SSPGA、SSAPGA、SSADA、OMAG、SV、PV、cm算法成像的血流连接度、对比度、信噪比进行了定量对比。在文献[12]的对比结果中,只用相位信号的SSPGA算法对比复合信号的SSAPGA,前者信噪比和对比度几乎都只有后者的1/2(图1)。在文献[22]中,在5种对比的算法中,用复合信号的OMAG算法对比度和信噪比最高,断连度最低,所用时间最少(图2)。上述2个对比结果均为复合信号类效果最好。
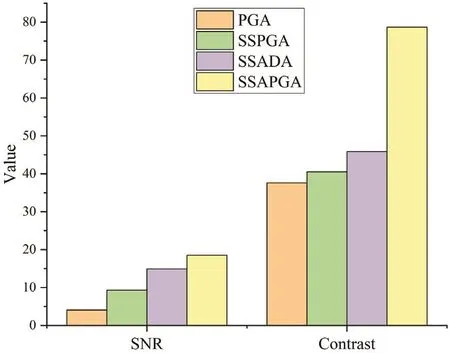
图1 4种算法成像效果对比[12]Fig.1 Imaging result of four algorithms[12]
2 OCTA的研究进展
OCTA作为一种优点众多的方法,近几年随着在眼科检查中的广泛应用而得到快速发展。在眼异常部位成像方面,近几年OCTA从眼底部位的成像发展到眼前节部位的成像。眼底部分,主要检测视网膜血管疾病,如年龄相关的黄斑变性、视神经病变。在眼前节方面,OCTA检测的疾病有青光眼、眼表疾病、虹膜血管异常、角膜血管增生等。
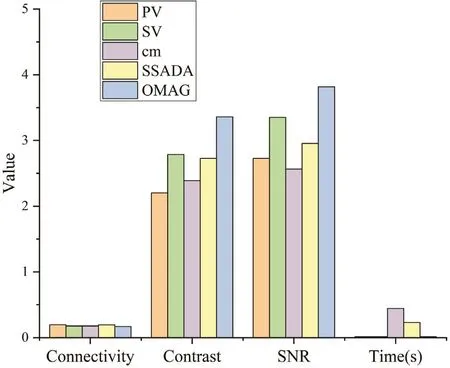
图2 5种算法成像效果对比Fig.2 Imaging result of five algorithms
近年随着人工智能(artificial intelligence,AI)的快速发展,OCTA与AI的结合应用得越来越广泛。AI在OCTA中从疾病分类到图像增强方面都有应用。在疾病分类方面,Liu的团队[23]进行了AI和专业医护人员在读片后对疾病检测分类的对比,探究各自的敏感性和特异性。其研究表明AI和专业医护人员的表现无明显差异,但检验结果缺少外部确认的手段和标准,且AI的检验重复性差。在图像增强的应用中,Liu等[24]用AI方法对OCTA方法中的SSAPGA算法进行图像增强。OCTA算法成像经AI处理后,图像的信噪比、血管连贯度均得到了改善,使低扫描次数的成像质量可达到高扫描次数的成像质量,减少了高质量成像的扫描时间,具有较高的临床应用价值。在我国,已有使用AI辅助社区医生进行眼底照片的读片和诊断的探索,这强化了社区首诊能力,形成了筛查-发现-转诊-随访-健康的管理模式,同时便于建立在线健康档案。
3 总结与展望
OCTA作为相对较新的眼部成像方法获得了人们的广泛关注。与传统FA、ICGA方法对比,OCTA具有成像速度快、分辨率高、三维成像、无副作用的优点,在宽场成像方面的缺点也随着视网膜跟踪技术的发展得了到改善。本文根据OCTA成像方法对应算法使用的OCT信号信息,把OCTA分为基于相位、振幅和复合信号3类,共描述了8种方法的原理、算法及其优缺点。各方法均可对眼底进行高清成像,成像的各种伪影也随着技术和算法的不断发展得到了相应补偿,以减少其对成像的影响。在各种OCTA方法的对比中,复合信号类成像效果最好。OCTA与人工智能技术结合在读片、图像增强、治疗建议等方面也逐渐获得研究和应用。
综上所述,在未来,OCTA的应用和发展前景都非常值得期待。OCTA的应用仍然面临着一些问题:高发射频率的扫频光源存在触发抖动问题,而宽场成像的图像场宽度比不上传统方法,AI用于疾病分类时重复性差。因此,在硬件技术上,发展更高速、稳定的扫描光源会成为实验室和企业的趋势。在软件和算法上,使用复合信号的算法以获得更好的成像质量,使用更好的宽场扫描、合成算法以获得宽场的血管分布图,用AI对更多成像算法进行图像增强、提高AI疾病分类的敏感性、特异性和重复性,这些方向在OCTA上都具有发展潜力。随着OCTA的发展,其作为日常检查方式在医院中得到普及后,必定会为减少中国疾病致盲率、维护居民眼部健康做出重要贡献。
