果蝇心脏发育标记基因Svp的多克隆抗体制备
2020-11-12李玉玲赵梦婧李瑞可张亚楠吴秀山袁婺洲
李玉玲,赵梦婧,李瑞可,张亚楠,吴秀山,袁婺洲
(湖南师范大学生命科学学院心脏发育研究中心,长沙 410081)
黑腹果蝇(Drosophilamelanogaster)是一种双翅目昆虫,具有生活史短、繁殖迅速、易于人工饲养、染色体少、突变性状多等优点。作为一种常见的模式生物,果蝇在现代生态学、群体生物学、行为学、系统学、遗传学、发育生物学和分子生物学等研究领域都被广泛的应用[1],特别是在遗传学、胚胎发育基因调控的研究中起着非常重要的作用。果蝇心脏发育过程与人类的心脏发育过程及调控机制有着密切的关联,研究果蝇心脏发育的调控机制能为认识人类先天性心脏病的发病机制和治疗提供重要的线索[2-3]。
果蝇心脏位于胚胎背中线的表层下,呈线性管状结构,由具有收缩特性的心肌细胞和不能收缩的副心肌细胞组成[4-5]。Svp(seven-up)作为一种孤儿受体基因在类固醇受体家族中存在,它与果蝇复眼中的光感受器细胞、神经细胞以及心脏前体细胞等细胞的分化存在联系,并且Svp在心肌细胞和副心肌细胞中都具有一定的表达量[6-7]。果蝇Svp基因定位于染色体3R上,cDNA长度为846 bp,编码282个氨基酸,是心脏发育的一种标记基因,但目前尚无用于科学研究的商用Svp抗体。本研究采用DNA免疫技术来快速制备Svp抗体,为研究心脏发育分子调控机制奠定基础。
DNA免疫是指将编码某种蛋白质抗原的重组真核表达载体直接注射到动物体肌肉、皮下或者腹腔等部位,利用宿主的转录和转译系统合成外源目标蛋白抗原,从而诱导特异性的免疫应答反应[8-9]。DNA免疫的应答强度取决于表达载体表达抗原的能力以及免疫接种的途径。DNA导入方式常用肌肉注射,其优点有:横纹肌细胞中溶酶体和DNA酶的含量较低,使得导入的质粒DNA能够在宿主细胞中长久存在;被注射的DNA会以环型分子存在于肌肉细胞中,使得其在宿主细胞中得不到复制,也不能整合到宿主细胞的染色体中;肌肉细胞外空间与其特有的横管系统有着直接的通道,当DNA质粒进入肌肉细胞后以胞吞作用的方式使外源目标蛋白抗原内吞进入细胞[10-12]。前人的研究发现pCAGGS-P7真核表达载体具有很高的表达效率,该载体含有鸡的β-actin启动子和巨细胞病毒(cytomegalovirus,CMV)增强子,能使下游被插入基因在哺乳动物细胞中更高效表达,同时质粒上具有KpnI、XhoI等多种方便目的基因插入的常见酶切位点[13-14],故而被广泛应用。本研究通过克隆果蝇Svp基因转录本NM_169459.2 CDS区域的284~846 bp的序列片断,构建真核表达重组质粒pCAGGS-P7-Svp,运用DNA免疫技术免疫小鼠,分离获得免疫后血清,制备出多克隆抗体。胚胎免疫荧光以及蛋白质免疫印迹(Western blot)鉴定检测等试验结果表明,该方法所制备的Svp多克隆抗体具备特异性,且效价较高,达到了果蝇心脏发育候选基因后续功能研究的应用标准。
1 材料与方法
1.1 菌株、质粒、小鼠以及主要试剂
大肠杆菌(Escherichia coli)感受态细胞DH5α、真核表达载体pCAGGS-P7、野生型黑腹果蝇(Drosophila melanogaster)W1118为湖南师范大学心脏发育研究中心试验室保存;野生型昆明白小鼠(Mus musculus)购自湖南斯莱克景达试验动物有限公司;2种限制性内切酶XhoI、KpnI以及连接酶均购自美国Thermo Fisher公司;高保真酶试剂盒购自唯赞公司;DNA纯化回收试剂盒、去内毒素质粒提取试剂盒购自北京自康为世纪生物公司。
1.2 引物设计与合成
通过NCBI网站搜索果蝇Svp基因的cDNA序列,导入到Primer5.0软件设计一对引物Sqe1、Resqe1,预期扩增长度为563 bp的Svp基因片段,并在引物的5'端上加了同源臂序列位点,使得插入片段在5'和3'端分别带有与线性化的质粒序列相同的同源臂。引物由北京擎科生物科技有限公司合成。引物如下(下划线序列为限制性内切酶KpnI、XhoI识别位点):
Sqe1:5'CTATAGGGCGAATTGGGTACCAGAACA TACCCTTCTTCCCG3'
Re-sqe1:5'ATCGATACCGTCGACCTCGAGTCAC ATCGAAGGCAGATAGG3'
1.3 构建pCAGGS-P7-Svp重组表达质粒
首先从W1118野生型黑腹果蝇胚胎中提取总RNA,反转录合成cDNA,以 cDNA 为模板用上述 Sqe1、Resqe1为引物,进行高保真PCR扩增,成功扩增出长为563 bp的Svp基因部分序列。反应条件为:95℃ 30 s预变性1个循环,95℃ 30 s 变性,44~60℃ 15 s 复性,72℃ 60 s延伸32个循环,72℃ 5 min 1 个循环,4℃ 保存。所得PCR产物通过琼脂糖电泳回收制备,并与用限制性内切酶KpnI、XhoI双酶切回收的约 5 000 bp的pCAGGS-P7线性载体相连接。一步克隆连接体系为:10μL ddH2O + 4μL 5×CEII Buffer + 2 μL ExnaseII +3μL含同源臂的SvpDNA片段 + 1μL线性化载体。37℃恒温水浴循环器中连接2 h。
1.4 大肠杆菌的转化及重组质粒的鉴定
将Svp片段与pCAGGS-P7载体连接后的产物转化到DH5α感受态细胞,通过氨苄青霉素抗性培养基筛选、挑取单克隆菌落,于液体培养基中37℃、220 r/min培养7 h。以Sqe1、Re-sqe1为引物,菌液为模板进行聚合酶链式反应(polymerase chain reaction,PCR)验证,再以双酶切法和测序法鉴定,确定获得重组质粒为pCAGGS-P7-Svp阳性克隆。
1.5 DNA免疫技术制备小鼠抗体
用重组质粒免疫4~6周龄昆明白小鼠:试验组5只小鼠,分别在其后肢股四头肌注射700μg/L的重组质粒,每只小鼠注射40μL。注射完毕后立即在注射部位两侧5 mm处用细胞融合转基因仪(electro cell manipulator)两端电极电击2次,让质粒DNA尽快扩散均匀。同时用pCAGGS-P7空载质粒DNA等量注射5只小鼠作为对照组。注射时间为第0、21、28 天,共免疫3次,每次免疫的剂量与免疫方式相同,于免疫后第35 天取血并分离收集血清,添加1%叠氮化钠后分装,储存于-80℃冰箱备用。
1.6 考马斯亮蓝染色及Western blot检测Svp多克隆抗体效价
收集过夜果蝇胚胎100枚/管,液氮迅速冷冻后用组织研磨棒充分研磨,加入100μL的RIPA裂解液(RIPA lysis buffer),再添加 1μL蛋白酶抑制剂混匀,低温离心机13 000 r/min离心10 min,收集上清液于冰上静置1 h,充分裂解细胞。加入25μL上样缓冲液,沸水煮10 min使蛋白变性,置于冰上冷却备用。根据预测的目的蛋白的大小配制10%的聚丙烯酰胺凝胶,电泳分离蛋白质,切取部分含有Marker蛋白以及样品的凝胶放入适量考马斯亮蓝染色液中,置于水平摇床上缓慢摇动,室温染色过夜。然后,倒出染色液,加入适量考马斯亮蓝洗脱液,确保洗脱液可以充分覆盖凝胶。将其置于水平摇床上缓慢摇动,室温脱色4~24 h,期间更换洗脱液2~4次,直至蓝色背景基本上全部被脱去,并且蛋白条带染色效果达到预期。完成脱色后,将其用双蒸水(double distilled water,ddH2O)浸泡,最后扫描得到果蝇全蛋白的考马斯亮蓝染色图。使用湿转的方式将电泳后的其他部分凝胶转膜到硝酸纤维素(nitrocellulose,NC)膜上,转膜条件为300 mA恒流进行。将转完后的膜取出,配制5%脱脂牛奶封闭缓冲液(phosphate buffered saline TWEEN-20,PBST),在室温下孵育2 h。封闭结束后,配制不同浓度的Svp多克隆抗体,4℃孵育过夜,然后用PBST以8 min/次漂洗3次。漂洗结束后加入1:2 000稀释的鼠二抗在室温下孵育2 h,PBST摇洗3次,每次8 min。清洗结束后,利用化学发光剂(electrochemiluminescence,ECL)显影以检测抗体的效价及目的蛋白的表达水平。
1.7 免疫荧光检测Svp多克隆抗体特异性
收集9~15 h野生型黑腹果蝇W1118的胚胎,用毛笔轻轻将果蝇胚胎刷到300目过滤网纱布上,清水漂洗3次。然后将胚胎浸泡于30%次氯酸钠溶液中约4 min,脱去胚胎表层绒毛膜,在显微镜下观察到胚胎触角消失即为脱膜成功。脱膜成功后立即用清水漂洗胚胎5次,用配制好的胚胎固定液在室温摇床孵育20 min以固定胚胎。去除固定液下层液体,加入5 mL甲醇后立即震荡胚胎1 min脱去卵黄膜,静置1 min后,去除上层液体,加入1 mL甲醇溶液漂洗胚胎,重复3次。最后,胚胎保在1 mL甲醇溶液中,-20℃保存。
取50μL固定好的胚胎于一只新离心管中,甲醇漂洗1次;500μL PBST漂洗胚胎3次,每次8 min;500μL 添加了牛血清蛋白的PBST室温封闭1 h;500μL PBST漂洗胚胎3次,每次8 min;加500μL 1:100 PBST稀释的Svp一抗和空白血清同时进行试验,4℃摇床孵育过夜;500μL PBST漂洗3次,每次8 min;加500μL按适当比例稀释后的荧光二抗,室温避光孵育2 h;500μL PBST漂洗胚胎3次,每次8 min;将胚胎转移至载玻片,70%甘油封片,于荧光显微镜下观察拍照。
2 结果与分析
2.1 真核表达质粒pCAGGS-P7-Svp的构建及鉴定
如图1所示,以Sqe1、Re-sqe1为引物,PCR扩增得到约563 bp的Svp条带,1~5泳道分别为44℃、48℃、52℃、56℃、60℃复性温度下的PCR结果,结果显示56℃的复性温度扩增效果最好。如图2a 中pCAGGSP7-Svp重组质粒示意图所示,将pCAGGS-P7载体用KpnI、XhoI酶切,得到线性目的载体带,然后将Svp目的带连接到pCAGGS-P7质粒的KpnI、XhoI酶切位点之间,获得重组质粒pCAGGS-P7-Svp。如图2b所示,将重组pCAGGS-P7-Svp用KpnI、XhoI进行单酶切以及双酶切验证,在563 bp的Svp片段中也存在着1个XhoI酶切位点,所以在用XhoI单酶切时有2条带,KpnI、XhoI双酶切时有3条带。最后将菌液提取质粒测序,进行核苷酸测序比对,结果表明pCAGGS-P7-Svp重组质粒的Svp序列与NCBI上Svp序列一致。以上结果表明pCAGGS-P7-Svp重组质粒构建成功。
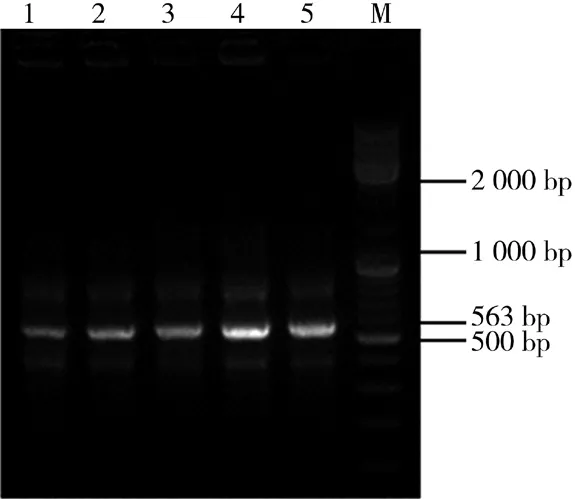
图1 Svp基因 PCR扩增电泳图Fig.1 Svp gene PCR amplification electropherogram
2.2 Western blot鉴定Svp多克隆抗体效价
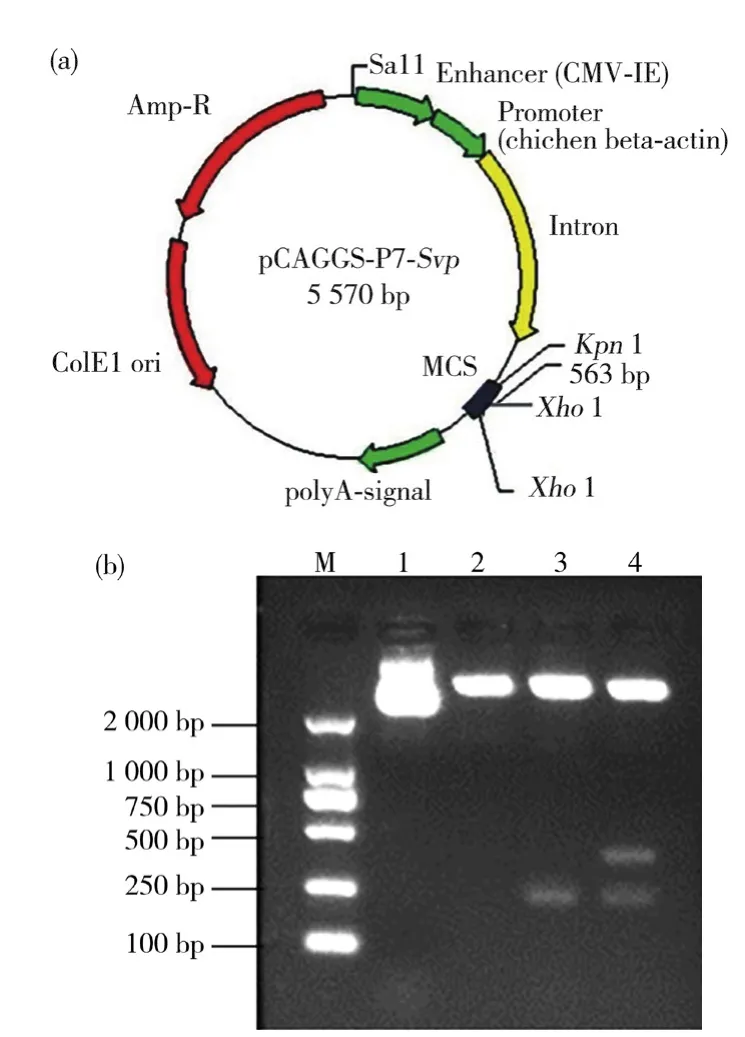
图2 pCAGGS-P7-Svp 重组质粒示意图和酶切图Fig.2 Schematic diagram of pCAGGS-P7-Svp recombinant plasmid and enzyme digestion result
收集野生型果蝇胚胎,提取总蛋白。如图3a为考马斯亮蓝染色的果蝇总蛋白图。分别以1:100,1:200,1:400,1:600,1:800比例稀释后的Svp多克隆抗体作为一抗进行了Western blot检测,结果如图3b所示。Svp多克隆抗体在各稀释比例下都出现了一条76 kD的特异性条带,说明免疫后的小鼠血清中产生了效价高的Svp蛋白的特异性抗体。而用免疫前血清以1:100稀释作为一抗进行检测,未见特异性条带。说明免疫后的小鼠血清中产生了Svp蛋白的特异性抗体,该抗体的特异性和敏感性良好,可以满足今后试验的需求。
2.3 Svp多克隆抗体免疫荧光鉴定
用野生型黑腹果蝇胚胎进行免疫荧光试验,对照组为免疫前血清的免疫荧光胚胎染色,试验组为用Svp多克隆抗体对9~15 h的野生型果蝇胚胎染色。对比Flybase数据,已知在理论上Svp蛋白会在果蝇胚胎背腹轴中线部位的部分心肌细胞和副心肌细胞表达,本试验结果显示的Svp表达图式也在背中线心脏细胞中表达,表明本研究制备的Svp多克隆抗体效价高。

图3 Western blot鉴定抗体效价Fig.3 Identification of antibody by Western blot
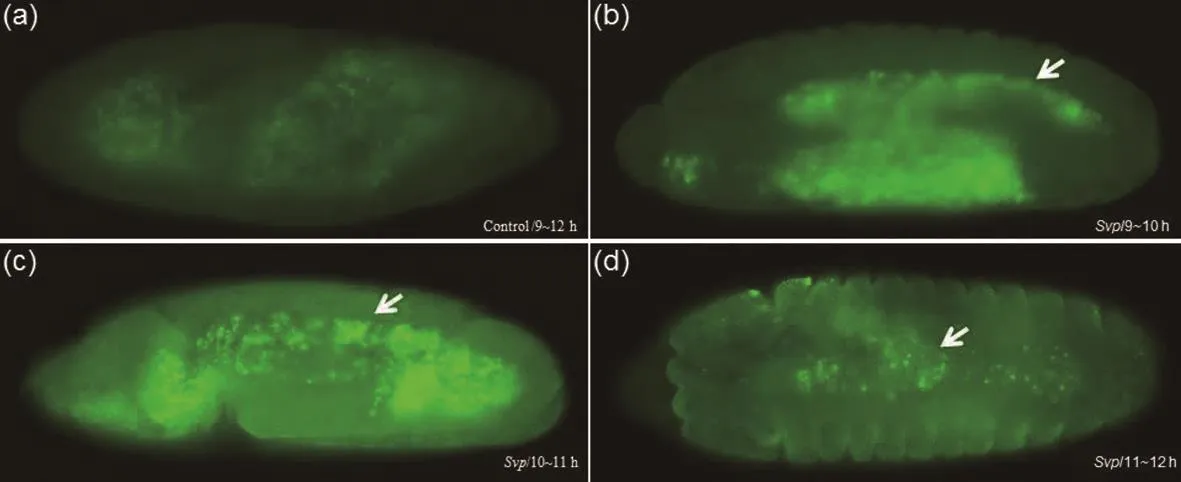
图4 Svp多克隆抗体免疫荧光鉴定(×200)Fig.4 Immunofluorescence identification of Svp polyclonal antibody (×200)
3 讨论
Svp作为一个果蝇心脏发育的标记基因,其特异性抗体对果蝇心脏发育研究有着重要作用。但鉴于目前无Svp的商用抗体,所以本研究采用DNA免疫技术,在降低成本的同时制备出高效价、特异性好的Svp抗体。将基因重组技术获得的编码Svp抗原蛋白的外源DNA直接注射进小鼠肌肉,并电击导入细胞内,使外源DNA在宿主细胞中表达合成免疫原性蛋白。在1个月内多次注射,加强免疫应答,分离并收集免疫后血清制备好抗体。然后用Western blot试验以及免疫荧光试验鉴定血清的效价和特异性,结果表明制备的Svp多克隆抗体能与果蝇体内表达的Svp蛋白结合,且特异性较好,这为今后进一步研究Svp基因的生物学功能提供了重要的研究材料。
相较于传统免疫技术而言,DNA免疫是通过直接引起机体对外源蛋白产生免疫反应的免疫技术。DNA免疫能在自身细胞中合成外源性蛋白,使抗原在活体内产生,在一些结构复杂或难以表达的蛋白(如膜蛋白)抗体的制备过程中能有效节省免疫原的生产和纯化时间,且其表达出的蛋白结构更加接近于天然分子,有助于生产高亲和力的抗体[15-16]。同时,这种免疫技术采用肌肉注射,进入体内的微量抗原一旦被肌细胞摄取,存在的半衰期延长,不断合成的外源蛋白持续性地刺激免疫系统,进而能加强免疫细胞的记忆持久性。最后,DNA免疫操作方法简便,仅需在构建高效表达质粒后直接接种免疫小鼠,不需要进行抗原提取和蛋白纯化步骤[17-18],进而时间会更短、价格更低廉。而相比于单克隆抗体而言,本研究采用的DNA免疫技术制备的多克隆抗体能识别任一抗原上的多个表位,有助于放大低表达水平的靶蛋白信号,因此在免疫检测中,可以识别更多的抗原,也较少受到抗原构象变化的影响[19-20]。因此,在相同条件下,利用多克隆抗体可以提高检测的灵敏度,从而在Western blot等检测试验中得到更好的结果。
