桔小实蝇肽聚糖识别蛋白基因BdPGRP-SB1的克隆及功能鉴定
2020-11-12张迎新张苏芸王进军
张迎新, 陈 冬, 张苏芸, 魏 冬,*, 王进军
(1.西南大学植物保护学院, 昆虫学及害虫控制工程重庆市重点实验室, 重庆 400715; 2.西南大学农业科学研究院, 重庆 400715)
先天免疫是昆虫抵御微生物感染的重要防线,该免疫过程主要包括细胞免疫和体液免疫,两者共同作用对昆虫起到有效的保护(Lemaitre and Hoffmann, 2007; 陈康康和吕志强, 2014)。细胞免疫通过血细胞介导完成,包括吞噬作用、集结作用和包囊作用(Lavine and Strand, 2002);体液免疫通过抗菌肽(antimicrobial peptides, AMPs)和黑化反应来抵御病原体(Kimbrell and Beutler, 2001; Hultmark, 2003)。肽聚糖识别蛋白(peptidoglycan recognition proteins, PGRPs)在昆虫抵御微生物的先天免疫中具有重要作用(Liuetal., 2001; Luetal., 2020)。PGRP可识别细菌细胞壁中的肽聚糖(peptidoglycan, PGN),进而激活Toll途径和Imd途径,触发抗菌肽产生(Hultmark, 2003; Beutler, 2004; Wangetal., 2019)。其中Toll途径由革兰氏阳性细菌和真菌激活,而Imd途径由革兰氏阴性细菌激活(Lemaitre, 2004; Lemaitre and Hoffmann, 2007; Hetru and Hoffmann, 2009)。所有革兰氏阴性菌和一部分革兰氏阳性菌(如芽孢杆菌)的PGN在肽链第3个位点具有一个内消旋-二氨基庚二酸残基,而其他的革兰氏阳性菌在该处具有一个L-赖氨酸(Lys)残基(Schleifer and Kandler, 1972; 陈康康和吕志强, 2014)。
Yoshida等(1996)在家蚕Bombyxmori血淋巴中首次纯化出PGRP蛋白,分子量约为19 kD,可与肽聚糖结合并激活酚氧化酶途径。随后在黑腹果蝇Drosophilamelanogaster、烟草天蛾Manducasexta和冈比亚按蚊Anophelesgambiae等昆虫中也发现了许多PGRP基因(Kangetal., 1998; Werneretal., 2000; Christophidesetal., 2002; Yuetal., 2002)。从脊椎动物到无脊椎动物,PGRP分布广泛且进化保守,根据其长度可分为长型PGRP(PGRP-L)和短型PGRP(PGRP-S)(Werneretal., 2000; Christophidesetal., 2002)。目前在果蝇中鉴定到13个PGRP基因,其中有7个短型PGRP基因,包括PGRPS-SA,PGRP-SB1,PGRP-SB2,PGRP-SC1a,PGRP-SC1b,PGRP-SC2和PGRP-SD(Werneretal., 2000; Kurata, 2014)。短型PGRP是具有信号肽的细胞外蛋白,广泛分布于血淋巴、表皮和脂肪体中,也有少量在肠道表皮细胞和血细胞中分布(Myllymakietal., 2014)。
在果蝇中,许多PGRP都充当了Toll通路和Imd途径的激活剂和调节剂(Dziarski, 2004; Wangetal., 2019)。果蝇PGRP-SA和PGRP-SD是在血淋巴中循环的分泌蛋白,其响应革兰氏阳性细菌的Lys型PGN,从而激活Toll途径(Micheletal., 2001; Bischoffetal., 2004)。PGRP-LF对NF-kB/Imd通路的负调控诱导果蝇细胞正常凋亡,以确保果蝇正常发育(Tavignotetal., 2017; Luetal., 2020)。PGRP-LB, PGRP-SC1a/b和PGRP-SC2对革兰氏阴性细菌敏感,是Imd通路的负调控因子,可防止宿主过度激活免疫反应,对昆虫起到保护作用(Paredesetal., 2011)。PGRP-SC1a/b和PGRP-SC2负责去除糖链上的多肽,与PGRP-LB和Pirk一起负调控Imd通路(Paredesetal., 2011),Toll通路的完全激活也需要PGRP-SC1和PGRP-SC2的参与(Costechareyreetal., 2016)。果蝇PGRP-SB1被证明在脂肪体内通过Imd途径活化后大量分泌到血淋巴中,且具有酰胺酶活性,但并未有相应的表型(Mellrothetal., 2003; Zaidman-Rémyetal., 2006, 2011)。
桔小实蝇Bactroceradorsalis属于双翅目(Diptera)实蝇科(Tephritidae)果实蝇属Bactrocera,为重要的世界性检疫害虫(Clarkeetal., 2005; Liuetal., 2019)。在桔小实蝇中,对PGRPs的研究还相对较少。最近有研究表明,桔小实蝇BdPGRP-SA和BdPGRP-SD参与识别革兰氏阴性和革兰氏阳性细菌,从而激活下游attacin-A,defensin和diptericin等AMP基因的表达以应对细菌感染(Weietal., 2019)。为进一步分析桔小实蝇中其他的PGRP,丰富对桔小实蝇中PGRP功能的认识,本研究克隆了桔小实蝇BdPGRP-SB1的cDNA全长序列,对其进行不同发育阶段和成虫不同组织的表达模式进行分析,利用RNAi抑制其表达水平进一步研究其功能,以探究BdPGRP-SB1在桔小实蝇免疫中的作用。
1 材料与方法
1.1 供试昆虫
研究所用桔小实蝇2008年采自中国海南省海口市于室内饲养,饲养环境温度27±0.5℃、相对湿度75%±5%、光周期14L∶10D,采用人工饲料饲养(Wangetal., 2013)。
1.2 RNA提取及cDNA的合成
收集不同发育阶段的试虫,包括:卵(n=100),第1(n=100)、3(n=100)、5(n=10)和8日龄(n=4)幼虫,第1, 3, 5和7日龄蛹(n= 4),以及第1, 3, 5和7日龄成虫(n=2)。解剖5日龄成虫中肠、马氏管、后肠、脂肪体、卵巢和精巢等组织(n=20),使用TRIzol(Invitrogen,美国)提取桔小实蝇不同发育阶段及成虫不同组织的总RNA。每组样品设置3个生物学重复。使用NanoDrop One核酸蛋白测定仪(Thermo,美国)测定RNA浓度及质量,并通过1%琼脂糖凝胶电泳检测RNA的完整性。使用RQ1 RNase-Free DNase试剂盒(Promega,美国)去除基因组DNA,以500 ng总RNA为模板按照PrimeScript RT Reagent Kit反转录试剂盒(TaKaRa,大连)说明书合成cDNA第1链。
1.3 BdPGRP-SB1基因克隆
分别使用Premier 6.0软件(PREMIER Biosoft,美国)和DNAMAN 5.0(Lynnon Biosoft,美国)设计和评估全长PCR引物(表1)。使用桔小实蝇5日龄成虫cDNA为模板,扩增目的基因,反应体系(25 μL): cDNA模板1 μL, 上下游引物(10 mmol/L)各1 μL, Primer STAR Max Premix(2×)(TaKaRa,大连)5 μL, ddH2O 9.5 μL。PCR反应条件: 94℃ 3 min; 94℃ 30 s, 55℃ 30 s, 72℃ 1 min, 34个循环; 72℃ 10 min(Weietal., 2018)。PCR产物使用1%琼脂糖凝胶电泳鉴定,根据Mini BEST Agarose Gel DNA Extraction Kit Ver 4.0胶回收试剂盒(TaKaRa,大连)说明书纯化回收目的条带;将纯化的片段连接到pGEM-T Easy载体(Promega,美国)中;将连接产物转化至大肠杆菌EscherichiacoliDH5α感受态细胞(北京全式金生物技术有限公司);用通用M13引物筛选阳性克隆送至深圳华大基因科技有限公司进行测序确认。
1.4 生物信息学分析
利用ORF Finder(http:∥www.ncbi.nlm.nih.gov/gorf/orfig.cgi)获得PGRP基因序列;利用ProtParam(http:∥web.expasy.org/protparam)预测分子量和等电点;利用InterPScan 5(http:∥www.ebi.ac.uk/Tools/pfa/iprscan5)分析PGRP蛋白序列的功能结构域;分别使用在线软件SignalP 4.1 Server(http:∥www.cbs.dtu.dk/services/SignalP-4.0)和TMHMM Server 2.0(http:∥www.cbs.dtu.dk/services/TMHMM-2.0)分析信号肽和跨膜结构域;NCBI上查找其他昆虫的PGRP序列,使用CLUSTALX 2.0进行多序列比对分析,并使用Jalview软件2.9(Waterhouseetal., 2009)进行多序列编辑;MEGA 5软件的邻接(neighbor-joining, NJ)法构建桔小实蝇BdPGRP-SB1和其他物种PGRPs的系统发育树,设置1 000次bootstraps进行检验。
1.5 BdPGRP-SB1时空表达模式检测
使用Primer Premier 3(http:∥fokker.wi.mit.edu/primer3)设计定量引物(表1)。检测肽聚糖识别蛋白基因BdPGRP-SB1的表达量,使用Novostar-SYBR SuperMix试剂盒(Novoprotein,上海)和CFX384TMReal-Time PCR Detection System实时荧光定量仪(Bio-Rad,美国)分析其在不同发育阶段和不同成虫组织中的表达模式。RT-qPCR体系(10 μL): cDNA模板0.5 μL, 上下游引物(10 mmol/L)各0.5 μL, qPCR SuperMix 5 μL, 无核酶水3.5 μL。qPCR反应条件: 95℃ 2 min; 95℃ 15 s, 60℃ 30 s, 40个循环; 60℃ 1 min; 95℃ 10 min(Weietal., 2018)。以桔小实蝇α-Tubulin(GenBank登录号: GU269902)为内参基因(Shenetal., 2010)。
1.6 细菌肽聚糖诱导BdPGRP-SB1基因表达
将大肠杆菌E.coli0111:B4肽聚糖(PGN-EB)和金黄色葡萄球菌Staphylococcusaureus肽聚糖(PGN-SA)(InvivoGen,美国)用无菌水稀释至100 μg/mL分别注射桔小实蝇5日龄雌成虫,每头虫200 nL,等体积无菌水作为对照,每个处理设置3个生物学重复,每个重复包含3头雌虫。在注射后3, 6, 9, 12和24 h后取样提取总RNA,利用RT-qPCR技术(反应体系及条件同1.5节),将对照组中基因表达量作为1,用于分析BdPGRP-SB1在肽聚糖诱导后的表达变化。
1.7 RNAi实验
使用特异性引物(表1)通过PCR扩增目的基因片段,使用Transcript Aid T7 High Yield Transcription Kit试剂盒(Thermo,美国),按说明书以扩增出来的目的片段为模版合成双链RNA(dsRNA)。使用NanoDrop One核酸蛋白测定仪(Thermo,美国)测量dsRNA浓度,并通过1%琼脂糖凝胶电泳检测dsRNA的完整性。将dsRNA稀释至4 000 ng/μL左右,使用Nanoject II Auto-Nanoliter Injector(WPI,美国)将dsRNA注射入桔小实蝇雌成虫腹部末端,每头虫注射2 000 ng,等量dsGFP作为对照。分别在注射dsRNA之后24和48 h后收样提取总RNA用于检测目的基因沉默效率,反应体系及条件同1.5节,每个处理收集3个生物学重复,每个生物学重复包含3头雌虫。

表1 本研究所用引物
在注射dsRNA 24 h后,分别注射200 nL OD600为1.8的革兰氏阴性细菌大肠杆菌DH5α和200 nL OD600为0.3的革兰氏阳性细菌金黄色葡萄球菌,每个处理包括至少30头试虫,统计注射后5 d内的存活率。
RNAi处理试虫后24 h注射200 nL OD600为1.8的灭活大肠杆菌,以注射dsGFP和PBS为对照,24 h后收集样品并且提取总RNA,去基因组后反转录得到cDNA,利用RT-qPCR检测抗菌肽基因表达量,反应体系及条件同1.5节。每个处理3个生物学重复,每个生物重复3头雌虫。参考桔小实蝇PGRP-SA和PGRP-SD的研究,选取3个抗菌肽基因attacin-A(GenBank登录号: KY038167),defensin(GenBank登录号: KX510002)和diptericin(GenBank登录号: KJ488999)分析其表达量变化(Weietal., 2019)。
1.8 数据分析
基因相对表达量使用2-ΔΔCt法计算(Livak and Schmittgen, 2001),基因时空表达模式分析中基因相对表达量使用单因素方差分析及最小显著差法(LSD)分析差异显著性;RNAi和细菌诱导中死亡率和基因表达量差异显著性采用Student氏独立样本t检验进行分析,使用SPSS 16.0软件进行统计分析。
2 结果
2.1 BdPGRP-SB1的克隆和序列分析
扩增获得桔小实蝇BdPGRP-SB1(GenBank登录号: MN892482),开放阅读框长558 bp,编码185个氨基酸。其编码蛋白BdPGRP-SB1预测分子量为21.45 kD,等电点为8.57,无跨膜结构域,具有PGRP保守结构域(第42-181位氨基酸),前端含有19个氨基酸的信号肽,为分泌型蛋白。这些特征表明,BdPGRP-SB1属于短型PGRP。
选取果蝇、地中海实蝇Ceratitiscapitata、埃及伊蚊Aedesaegypti、家蝇Muscadomestica和家蚕Bombyxmori的同源氨基酸序列与BdPGRP-SB1氨基酸序列进行比对(图1),昆虫PGRPs保守区域十分一致,结构域高度保守。BdPGRP-SB1含有3个保守的半胱氨酸残基和6个PGRP/酰胺酶活性所需的氨基酸残基,表明BdPGRP-SB1具有Zn2+依赖性酰胺酶活性。Arg99残基为DAP型PGN识别位点,表明BdPGRP-SB1可识别DAP型PGN。

图1 桔小实蝇BdPGRP-SB1和其他昆虫PGRP序列比对
使用MEGA 5软件的邻接法联合桔小实蝇BdPGRP-SB1和其他物种PGRPs构建系统发育树,结果表明桔小实蝇BdPGRP-SB1与辣椒实蝇Bactroceralatifrons的PGRP-SB1亲缘关系最近,氨基酸序列一致性达96%(图2)。

图2 基于氨基酸序列的桔小实蝇BdPGRP-SB1 和其他昆虫PGRPs系统发育树
2.2 BdPGRP-SB1时空表达模式
以α-Tubulin作为内参基因,对桔小实蝇不同发育时期以及成虫不同组织中BdPGRP-SB1表达模式进行分析,结果显示:BdPGRP-SB1在桔小实蝇各阶段均有所表达,在3日龄幼虫、1日龄蛹和成虫期高表达,显著高于在卵和其他日龄的幼虫及蛹中表达量(图3: A),其中3日龄幼虫中表达量是卵期的409倍(P<0.05),1日龄蛹中表达量是卵期的257倍(P<0.05),5日龄成虫中的表达量是卵期的543倍(P<0.001)。BdPGRP-SB1在成虫各组织中亦均有所表达,在脂肪体中表达量最高,其次是在中肠、后肠和精巢中,在马氏管和卵巢中表达水平较低(图3: B);BdPGRP-SB1在脂肪体中的表达量是在卵巢中表达量的30倍(P<0.001),在中肠中的表达量是在卵巢中表达量的20倍(P<0.001)。

图3 BdPGRP-SB1在桔小实蝇不同发育阶段(A)和成虫不同组织(B)中的相对表达量
2.3 肽聚糖对BdPGRP-SB1转录水平的影响
注射大肠杆菌肽聚糖(PGN-EB)和金黄色葡萄球菌肽聚糖(PGN-SA)均能诱导桔小实蝇雌成虫体内BdPGRP-SB1表达水平变化(图4)。BdPGRP-SB1表达量在PGN-EB诱导后的多个时间点显著上调,在诱导3 h时最高,较对照上调31倍(P<0.05),随后逐渐下降,在诱导6 h时较对照上调11倍(P<0.05),在诱导9 h时较对照上调10倍(P<0.05),在诱导24 h时较对照仅上调3倍(P<0.01)(图4: A)。BdPGRP-SB1在PGN-SA诱导后的多个时间段也显著上调,在诱导3 h时较对照上调9倍(P<0.05),在诱导6 h时表达量最高,较对照上调11倍(P<0.05),随后逐渐下降,在诱导9 h时较对照上调5倍(P<0.01),在诱导24 h时较对照上调3倍(P<0.05)(图4: B)。结果说明BdPGRP-SB1对PGN-EB更为敏感。
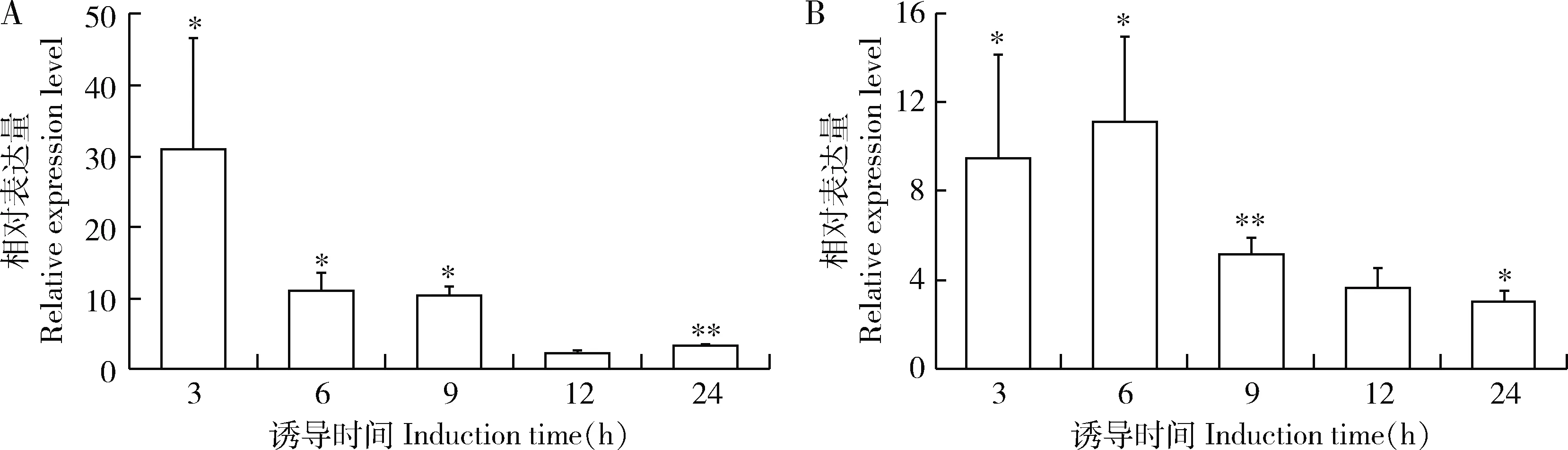
图4 分别注射PGN-EB(A)和PGN-SA(B)后桔小实蝇5日龄雌成虫中BdPGRP-SB1的表达量
2.4 BdPGRP-SB1基因功能分析
桔小实蝇5日龄雌成虫注射dsBdPGRP-SB1 24 h和48 h后BdPGRP-SB1均能被有效沉默,沉默效率分别为55%(P<0.01)和76%(P<0.01)(图5: A)。利用RNAi干扰桔小实蝇BdPGRP-SB1表达后,再分别注射大肠杆菌和金黄色葡萄球菌后桔小实蝇雌成虫在5 d内的存活率统计结果表明,在大肠杆菌注射组中dsBdPGRP-SB1处理组(30%)较对照组(54%)存活率显著性降低(P<0.01)(图5: B),在金黄色葡萄球菌注射组中dsBdPGRP-SB1处理组存活率(13%)与对照组(14%)无显著差异(图5: C)。说明BdPGRP-SB1参与桔小实蝇免疫系统对大肠杆菌的识别。
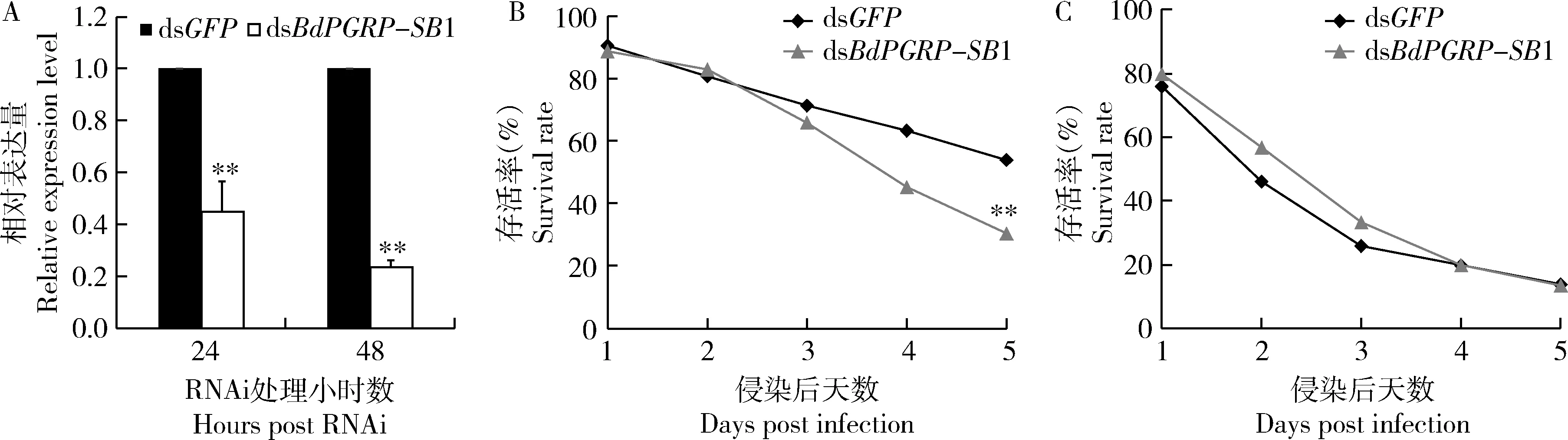
图5 RNAi后BdPGRP-SB1的沉默效率(A)以及大肠杆菌(B)和金黄色葡萄球菌(C)侵染桔小实蝇雌成虫的存活率
干扰BdPGRP-SB1后24 h注射灭活的大肠杆菌,桔小实蝇雌成虫中attacin-A,defensin和diptericin3种抗菌肽基因的表达量与注射dsGFP和灭活E.coli的对照组相比表达上调(图6),其中attacin-A上调1.73倍(P<0.05),defensin上调3.16倍(P<0.01),diptericin上调1.68倍(P<0.05)。表明BdPGRP-SB1参与识别大肠杆菌,抑制其表达后抗菌肽被激活。

图6 RNAi干扰BdPGRP-SB1表达后注射灭活大肠杆菌桔小实蝇雌成虫中抗菌肽基因attacin-A(A),defensin(B)和diptercin(C)的相对表达量
3 讨论
昆虫依靠先天免疫防御微生物病原体,先天免疫包括细胞免疫和体液免疫,体液免疫可诱导的AMPs和血淋巴中活化的酚氧化酶级联反应(Royetetal., 2005)。肽聚糖识别蛋白在昆虫识别细菌感染中起关键作用(Lemaitre and Hoffmann, 2007; Wangetal., 2019)。本研究克隆获得到了桔小实蝇BdPGRP-SB1全长。序列分析(图1)发现BdPGRP-SB1具有Arg残基,可识别DAP型PGN,同时具有5个保守残基,具有T7溶菌酶Zn2+依赖性酰胺酶活性,表明该基因可能参与具有DAP型PGN的革兰氏阴性细菌的识别。在果蝇中,同系物PGRP-SB1具有N端乙酰胞壁酸(N-acetylmuramoyl)和L端丙氨酸酰胺酶(L-alanine amidase),具有T7溶菌酶Zn2+依赖性酰胺酶活性,对DAP型PGN具有较高活性,对大多数Lys型PGN活性较低(Mellroth and Steiner, 2006)。BdPGRP-SB1与其他昆虫的PGRP系统发育树显示,其与辣椒实蝇PGRP亲缘关系较高(图2),暗示着其功能上的保守性。
短型PGRPs广泛存在于昆虫血淋巴、表皮和脂肪体等组织中,它们主要在脂肪体细胞中合成,部分在肠道的表皮细胞中合成,也有少部分在血淋巴合成(Dziarski and Gupta, 2004)。昆虫脂肪体由富含脂质和糖原的松散细胞组成,除了具有能量储存和卵黄质前体合成的功能外,脂肪体还产生和分泌具有溶解活性的抗菌肽,以及体液免疫反应的一些其他成分,是防御病原物的重要免疫器官(Hillyer, 2015)。研究表明果蝇PGRP-SC1,PGRP-SC2和PGRP-LB在幼虫肠道中高表达,PGRP-SC2同时为脂肪体中Imd途径的负调控因子(Costechareyreetal., 2016)。桔小实蝇BdPGRP-SA和BdPGRP-SD在成虫脂肪体内高表达,其参与识别革兰氏阴性和革兰氏阳性细菌,从而激活下游AMPs以应对细菌感染(Weietal., 2019)。果蝇PGRP-SB1在脂肪体内大量产生,然后释放到血淋巴中(Zaidman-Rémyetal., 2011)。本研究关注的桔小实蝇BdPGRP-SB1属于短型PGRP基因,该基因在脂肪体中表达最高(图3:B),说明该基因可能通过脂肪体在昆虫免疫中发挥重要作用。
昆虫PGRP可识别细菌细胞壁中的肽聚糖激活Toll途径和Imd途径(Hultmark, 2003; Hetru and Hoffmann, 2009)。在果蝇中,感染胡萝卜软腐欧文氏菌Erwiniacarotovora会诱导PGRP-SC1,PGRP-SC2和PGRP-LB表达(Costechareyreetal., 2016)。PGRP-SB1能被含有DAP型PGN的革兰氏阴性细菌激活,而含有Lys型PGN的革兰氏阳性细菌只能短暂且轻微地激活PGRP-SB1。在缺乏Imd途径的突变果蝇中,革兰氏阴性细菌也无法诱导PGRP-SB1的表达(Zaidman-Rémyetal., 2011)。在本研究中,在PGN-EB和PGN-SA诱导后,桔小实蝇BdPGRP-SB1表达量显著增加,这表明BdPGRP-SB1可以被大肠杆菌和金黄色葡萄球菌诱导(图4),大肠杆菌诱导倍数比金黄色葡萄球菌多,而大肠杆菌为含有DAP型PGN的革兰氏阴性细菌(陈康康和吕志强, 2014),说明BdPGRP-SB1对革兰氏阴性细菌更为敏感。
黑腹果蝇PGRP-LB和PGRP-SCs突变后饲喂胡萝卜软腐欧文氏菌,其存活率较野生型果蝇显著降低(Paredesetal., 2011)。在桔小实蝇中,抑制BdPGRP-SA和BdPGRP-SD后侵染大肠杆菌和金黄色葡萄球菌,桔小实蝇死亡率均显著高于对照(Weietal., 2019)。在本研究中,用大肠杆菌感染后,注射dsBdPGRP-SB1的桔小实蝇成虫存活率比对照降低了24%;用金黄色葡萄球菌感染后,注射dsBdPGRP-SB1的桔小实蝇成虫存活率和对照相比无差异(图5),表明BdPGRP-SB1参与大肠杆菌的识别过程。两种细菌的侵染结果表明,BdPGRP-SB1主要参与革兰氏阴性细菌的识别,与BdPGRP-SB1序列分析可识别DAP型PGN的结果一致。但PGRP-SB1突变品系果蝇,对革兰氏阴性细菌和革兰氏阳性细菌的耐受力与野生型果蝇相似,PGRP-SB1的突变并没有引起其对细菌的敏感性增加(Zaidman-Rémyetal., 2011),可能因为不同物种之间基因功能存在差异。
在昆虫中,已鉴定出许多AMPs。果蝇被胡萝卜软腐欧文氏菌或大肠杆菌侵染时,会诱导AMPs表达升高(Gobertetal., 2003)。果蝇中,抑制Imd通路的负调控因子PGRP-LB表达后,注射革兰氏阴性细菌或其肽聚糖和气管细胞毒素(tracheal cytotoxin, TCT)等惰性化合物,均能诱导diptericin表达量升高(Zaidman-Rémyetal., 2006)。不表达Imd通路的负调控因子Pirk, PGRP-LB和PGRP-SCs的果蝇在被细菌感染后,AMP的表达水平是野生型果蝇的8~10倍,表明免疫反应受到负调节的高度限制(Paredesetal., 2011)。PGRP-SB1突变品系在感染无害李斯特菌Listeriainnocua(具有DAP型PGN的革兰氏阳性细菌)24 h后和感染大肠杆菌6 h后,diptericin有轻微的上调,Imd途径轻度的过度激活表明PGRP-SB1作为负调节因子起到一定作用,在大多数情况下可能被更有效的负调节剂(如PGRP-LB)所掩盖(Zaidman-Rémyetal., 2011)。Attacin,diptericin,cecropin和defensin是昆虫中常见的AMPs,且参与桔小实蝇免疫(Liuetal., 2017)。在本研究中,BdPGRP-SB1沉默后注射灭活大肠杆菌,attacin-A,defensin和diptericin3种抗菌肽基因表达水平显著上升。Imd途径的过度激活表明BdPGRP-SB1可能参与Imd途径的负调控。研究表明,过表达Imd可激活抗菌肽基因的表达,同时Imd的过表达会诱导细胞凋亡,对果蝇有害(Georgeletal., 2001);Imd途径负调节因子可防止过度免疫对果蝇的伤害(Paredesetal., 2011)。干扰BdPGRP-SB1后,抗菌肽基因表达量上调(图6),Imd途径被过度激活,导致桔小实蝇对革兰氏阴性细菌敏感性增加,说明BdPGRP-SB1可能参与Imd途径的负调控,以防止过度免疫对桔小实蝇的伤害。
