下颌升支截骨去血供后牙槽骨内氧水平变化与骨改建的变化研究
2020-11-12康非吾
蔡 昀,唐 燚,康非吾
正畸-正颌联合治疗是治疗牙颌面畸形的主要手段。骨是一类高度血管化的结缔组织[1],颌面部骨血供丰富,同时接受向心性与离心性血供的滋养,其多源性的血供方式是正颌外科得以成功实施的解剖学基础。同时,正颌外科手术中对颌面部进行的广泛软组织剥离及运用的大量骨切开术也会对全身及局部的血供产生影响[2-3]。
骨内灌注减少将阻碍氧气传递到牙槽骨内的各类细胞和周围组织,我们推测牙槽骨骨内氧环境将发生变化同时引起骨代谢的改变。基于此,本文旨在通过建立大鼠双侧下颌升支截骨模型去血供后,分析非术区牙槽骨组织氧水平与骨代谢随时间变化的规律,了解颌骨手术对非术区牙槽骨骨改建的影响。
1 材料与方法
1.1 主要仪器与试剂
抗酒石酸酸性磷酸酶(Trap)检测试剂(Sigma-Aldrich,德国);BCIP/NBT碱性磷酸酯酶(ALP)显色试剂盒(碧云天,中国);甲基绿染色液(凯基,中国);透明质酸酶(Sigma-Aldrich,德国);山羊血清(迈新,中国);低氧探针-1(Hypoxyprobe -1,简称Hp-1)检测试剂盒(Hypoxyprobe,美国);DAPI染色液(Sigma-Aldrich,德国);抗荧光淬灭剂(生工,中国);共聚焦荧光显微镜及照相系统(Nikon,日本)
1.2 实验动物与分组
本实验选用7周龄健康雄性Sprague-Dawley大鼠,体质量180~200克,订购于虔碧生物科技(上海)有限公司,饲养于同济大学口腔医院实验动物中心。按随机原则分为对照组与手术组。对照组即术前组,不做任何处理;手术组再按时间点分为术后第1、3、5、7、14天组。每组需要5只实验大鼠(n=5)。
1.3 模型建立
所有操作均已通过同济大学附属口腔医院动物伦理委员会批准,登记号为[2019]-DW-038。下颌升支截骨手术模式图如图1所示。手术组腹腔注射1.5%戊巴比妥钠溶液(剂量30 mg/kg)对大鼠进行麻醉。待麻醉显效后,取仰卧位,在下颌骨术区备皮消毒。在无菌状态下,于下颌下缘作弧形切口,用眼科剪分离下颌骨边缘附着的肌肉,用骨膜分离器钝性分离咬肌与下颌骨体,减少向心性血供并暴露下颌升支。用涡轮机在第三磨牙后4 mm,平行于下颌孔处进行垂直截骨,止于下颌体下缘,截断下牙槽动脉,减少离心性血供,期间生理盐水保持冲洗冷却。缝合软组织和皮肤并消毒。另一侧以相同方式进行截骨手术。剪去上下颌切牙,防止其过度生长。待大鼠清醒后安返笼位。术后喂予软质饲料并以8万单位/d剂量腹腔注射青霉素3 d。
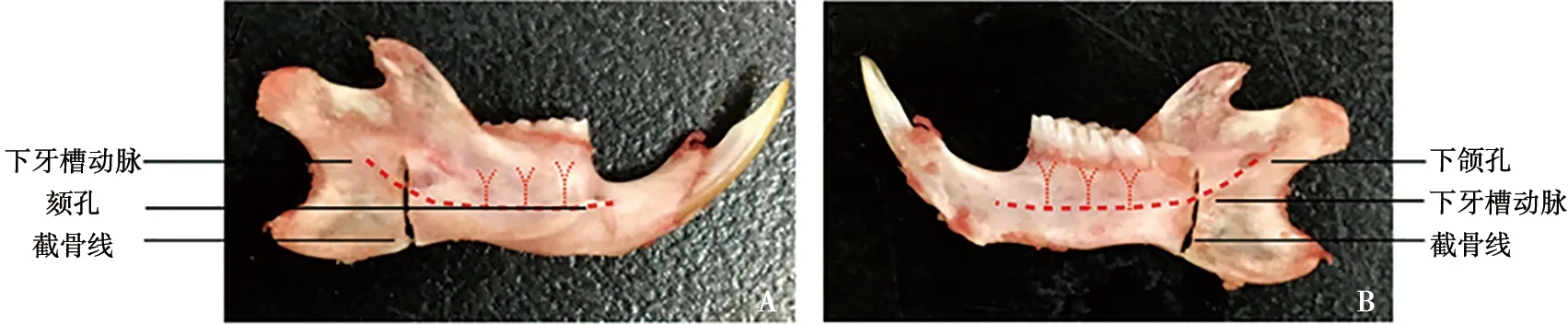
A:下颌骨外面观;B:下颌骨内面观
1.4 低氧探针标记与免疫荧光染色
低氧探针-1(Hp-1)是一种2-硝基咪唑替代物,主要成分是盐酸吡莫硝唑(pimonidazole HCl),可在细胞水平标记低氧状态。在大鼠处死前2 h,以60 mg/kg剂量腹腔注射Hp-1溶液。注射后,Hp-1将分布到体内所有组织,但仅在氧浓度小于14 μmol/L(相当于在37 ℃时分压p(O2)=10 mmHg)的细胞中与含硫醇的蛋白质形成加合物。
标记完成后,对大鼠进行过量麻醉灌流后分离下颌骨,于4%多聚甲醛固定24 h,经10%乙二胺四乙酸(EDTA)脱钙液脱钙完全后,进行石蜡包埋,平行于第一磨牙长轴切片,切片厚度为5 μm。常规脱蜡水化后,使用透明质酸酶在37 ℃烘箱孵育1 h进行抗原修复,山羊血清封闭20 min,加入鼠抗吡莫硝唑IgG1单克隆抗体工作液(1∶50),于4 ℃冰箱内孵育过夜。隔日避光孵育荧光二抗(1∶500)45 min,PBS洗3次,DAPI(1∶1 000)孵育5 min,抗荧光淬灭剂封片,镜检。
1.5 组织学染色
如前所述,制备5 μm组织切片。常规脱蜡水化后,分别使用TRAP染色试剂盒检测骨吸收功能,使用ALP染色试剂盒检测骨形成功能,甲基绿复染10 min,二甲苯透明,中性树胶封片,镜检。
1.6 统计学方法
用image J软件对样本染色图进行分析获得相关定量结果,即随机视野下,采用color threshold获取阳性染面积,计算阳性面积占视野面积的百分比。使用PRISM 7.0软件和SPSS 24.0进行作图及统计学分析。多组之间通过单因素方差分析与Tukey多重比较法进行检验。所有计量数据结果以均数±标准差表示,定义当P<0.05时说明实验结果有统计学差异(*:P<0.05,**:P<0.01,***:P<0.001,****:P<0.000 1)。
2 结 果
2.1 术后第一磨牙区域牙槽骨骨内氧水平变化
通过低氧探针联合免疫荧光染色评估下颌升支骨截骨术后牙槽骨氧水平的变化,当氧浓度低于14 μmol/L时,标记为绿色,认定处于低氧状态。选择第一磨牙牙根之间的牙槽骨作为观察区域。如图2A所示,在术后第一磨牙区域牙槽骨出现了低氧强阳性信号,骨内低氧程度随时间发生变化。通过定量分析发现(图2B),术后第1天(10.69±2.13)%、第3天(11.37±2.74)%低氧相对面积与术前(2.84±2.23)%相比显著增加(P<0.000 1),术后第5天(7.66±3.51)%低氧相对面积有所下降,但仍较术前有统计学差异(P<0.01),术后第7天(4.64±1.92)%及第14天(5.15±1.98)%与术前相比,低氧面积无显著性差异(P>0.05),低氧状态缓解。
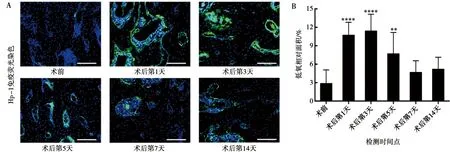
A:术前及术后第1、3、5、7、14天第一磨牙区域牙槽骨低氧探针免疫荧光染色图;蓝色:DAPI;绿色:Hp-1;标尺=100 μm; B:低氧相对面积定量分析;与术前组相比,**:P<0.01;****:P<0.0001
2.2 术后第一磨牙区域牙槽骨组织学表现
通过对第一磨牙牙根之间的牙槽骨进行TRAP染色及ALP染色评估骨改建情况,发现术后牙槽骨骨代谢活跃。TRAP染色(图3A)提示术后第1天出现活跃的破骨细胞行骨吸收功能并持续至术后第7天。定量分析结果(图3C)显示:TRAP阳性染色相对面积在术后第1天(2.40±0.58)%较术前(0.57±0.39)%有统计学差异(P<0.01),术后第3天(3.11±0.96)%,术后第5天(3.87±1.30)%持续增加,术后第7天(5.62±1.82)%达到峰值,与术前相比统计学差异显著(P<0.0001),骨吸收能力在术后第14天(1.46±0.46)%下降至术前水平(P>0.05)。ALP是早期成骨标志,反应了成骨细胞分化水平。ALP染色(图3B)及其定量分析(图3D)结果显示:术后第1天(0.56±0.28)%,第3天(0.31±0.32)%,第5天(0.25±0.14)%牙槽骨成骨活性与术前(0.32±0.12)%无显著性差异(P>0.05),但在术后第7天(5.53±1.70)%,牙槽骨ALP阳性面积显著增加(P<0.0001),染色较深,提示ALP活性高,说明前成骨细胞向成熟的成骨细胞分化地越明显,即早期骨向分化显著,且在术后第14天(2.22±0.67)%仍保持较术前高水平的成骨活性。
3 讨 论
氧气是许多组织正常发育的关键信号,参与了不同的生命进程[4]。在骨外伤、骨肿瘤或骨质疏松等情况下骨内氧含量的时空分布将发生变化[5]。Epari等[6]对绵羊胫骨截骨后的骨损伤部位处进行氧张力测量,发现最初氧分压较高为110 mmHg,术后5 d内持续显著下降,5 d后达到平台期稳定在20 mmHg。正颌手术骨切开线与牙槽骨有一定距离,如上颌骨水平骨切开术的骨切开线距离上颌牙根根尖5 mm,下颌升支矢状骨劈开术的骨切开线主要在下颌升支部。因此,我们建立大鼠双侧下颌升支截骨模型,并通过低氧探针在分子水平检测其第一磨牙牙槽骨区域内氧分压的变化。我们发现在术后早期非术区牙槽骨内出现低氧微环境。虽然颌面部骨血供有广泛的吻合支可以在术后代偿,输送营养物质及氧气,但骨内和周围的血管网络受到损害,同时修复代谢需求对氧的消耗增加,仍使牙槽骨内的低氧状态持续5 d。氧水平的变化可以调节特定的信号级联,例如低氧诱导因子(hypoxia-inducible factor,HIF)信号传导途径[7]。HIF可以介导转录多种成血管基因编码促进血管生成及动脉重塑,促使组织灌注恢复[8]。值得一提的是,有证据表明从下颌骨分离的成骨细胞比从股骨分离的成骨细胞拥有更强的促血管生成能力[9]。细胞从周围血管获得氧气的距离需要在200 μm以内[10]。在术后1周时,牙槽骨骨内局部氧水平恢复到了术前基线,这可能与新生血管长入有关[11]。
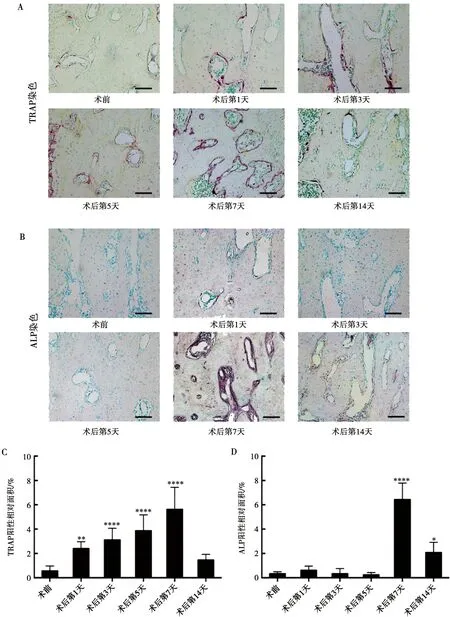
A、B:术前及术后第1、3、5、7、14天第一磨牙区域牙槽骨Trap染色(A)及ALP染色(B);C:Trap阳性染色相对面积定量分析;D:ALP阳性染色相对面积定量分析;标尺=100 μm;*:与术前组相比,P<0.05;**:与术前组相比,P<0.01;****:与术前组相比,P<0.0001
骨内氧水平的变化影响非术区牙槽骨骨吸收与骨形成能力。通过比较牙槽骨低氧状态与TRAP染色数据的时间变化关系,我们发现在术后早期牙槽骨骨内发生低氧的同时破骨骨吸收活跃并持续1周。我们初步认为术后早期的牙槽骨骨内低氧状态促进了破骨骨吸收能力。据文献报道,破骨细胞适合在低氧、酸性环境中发挥作用[12]。相比于在体外以20%和0.2% O2培养诱导条件下,2% O2孵育诱导的破骨细胞形成效果最佳[13]。也有研究指出,体外在低氧条件下培养诱导对破骨细胞衰老有负向调控作用且能导致破骨细胞生成延迟,但对破骨吸收能力没有负面影响[14]。除了低氧的严重程度,低氧的作用时间也会对破骨细胞生成、存活或骨吸收能力产生影响。短时间的急性缺氧-复氧可以增加破骨细胞活性与破骨细胞凋亡,并能维持两者间的平衡[15]。然而,持续性地暴露在低氧环境中则会显著抑制破骨细胞的形成和吸收功能[16]。此外,本课题组先前研究表明,体外低氧培养骨细胞也可以促进其分泌RANKL介导破骨细胞分化[17]。破骨细胞活性增强是颌骨手术后牙槽骨重塑的有利因素。骨内低氧引起的破骨吸收增强或许可以成为临床中可利用的加快正畸牙移动的有效措施。之后,通过比较牙槽骨低氧状态与ALP染色数据的时间变化关系,我们发现术后早期骨内低氧出现时,牙槽骨成骨活动不明显,而在术后1周当骨内氧水平恢复到术前状态时,则成骨分化显著。据文献报道,成骨细胞对氧浓度的变化极为敏感,当细胞周围氧气浓度降低到5%时,成骨细胞的增殖与骨矿化结节的形成会受到强烈抑制,而当氧浓度降低到1%时则几乎完全消失[18]。在大鼠体内通过系统性低氧-复氧会引起成骨细胞、骨细胞的凋亡[19],但低氧微环境稳定的HIF-1α具有抑制成骨细胞凋亡的能力,可以拮抗低氧引起的细胞活力降低[20]。
骨改建是由破骨骨吸收与成骨骨形成协调共同完成的过程[21]。本研究对术后低氧与骨改建的研究尚处于初步探讨阶段,这种复杂的过程需要不同类型的细胞参与,因此可以考虑进一步引入基因敲除模型动物来探究破骨细胞、成骨细胞和骨细胞等分别如何对截骨后牙槽骨的低氧作出反应。
综上,本文初步表明术后骨内氧水平的变化与牙槽骨骨代谢变化有一定的时空联系。当下颌升支截骨去血供后,非术区牙槽骨出现局部低氧微环境的同时骨吸收活跃,当低氧状态缓解后骨形成能力增强。因此,可以从低氧的角度对正颌术后牙槽骨骨改建进行深入探究,以期临床中在正颌术后利用骨代谢的变化适时介入正畸治疗,实现精准调控。
