全普CBD 油大鼠灌胃长期毒性试验研究
2020-11-12王振宇宋京风
唐 敏,王振宇,郭 翀,项 伟,宋京风
(1) 云南省第二人民医院麻醉科,云南昆明 650021;2) 昆明医科大学生物医学工程中心,云南昆明 650500;3) 昆明医科大学第一附属医院检验科,云南昆明 650032;4) 云南省汉木森科技有限公司,云南昆明 650500;5) 昆明医科大学药学院暨云南省天然药物药理重点实验室,云南昆明 650500)
大麻二酚 (cannabidiol,CBD)是大麻(Cannabis sativa) 提取物的主要成分之一。大麻中的主要活性成分是大麻素类化合物,目前已知天然大麻素有113 种[1-2],四氢大麻酚(THC)、CBD含量最高[3],是大麻中的主要化学成分。它们互为同分异构体[4]。虽然THC 被认为是其最重要的活性成分,具有神经活性,可用于治疗癌症引起的呕吐,但THC 具有致幻作用,这成为许多国家禁种大麻的唯一原因[5]。与THC 不同的是,CBD 是大麻中的非成瘾性成分,能阻碍THC 对人体神经系统影响,并具有抗痉挛、抗风湿性关节炎、抗焦虑等药理活性[6]。最近Daniel Friedman 等[7]发现全普CBD 油能够有效治疗难治性癫痫Lennox-Gastaut 综合症和Dravet 综合症。Fabricio 等[9]发现在治疗难治性癫痫和儿童癫痫方面,全谱CBD 油较纯品CBD 具有更好的临床效果和更低的临床用量。Schrader 等[8]发现THC 和CBD 的混合物治疗EB 病毒引起的疼痛,相比于阿片类镇痛药物,其目前尚未发现成瘾性和耐受性,且具有良好的止疼效果。这正符合了新药研发高效、低毒的思路和目标。目前全谱CBD 的抗肿瘤、抑制精神疾病、抗氧化等药理作用成为研究的热点,但是,有关全谱CBD 油的毒性和安全性评价尚未见报道。为进一步研究其安全性,探索其给药安全范围,本研究对SD 大鼠连续经口染毒13 周,恢复4 周的安全性进行评价研究,旨在研究全普CBD 油毒性的作用性质、程度、量效和时效关系以及可逆性等,为临床应用安全性及防治提供毒理学依据。
1 材料与方法
1.1 材料
1.1.1 受试药物全普CBD 油中含有CBD 化学成分约为67%,THC 含量低于0.2%,由云南省汉木森科技有限公司提供。
1.1.2 实验动物160 只SPF 级SD 大鼠,来源于昆明医医科大学实验动物中心,实验动物生产许可证号:SCXK(滇) 2015-002,实验动物使用许可证:SYXK(滇) 2015-002。饲养环境为SPF 级。
1.1.3 主要仪器Roche Cobas311 全自动生化分析仪;SysmexHST-302 血液分析仪;STAGO STA-R Evolution 血凝仪;Nikon ECLIPSE 50i 研究型系统生物显微镜。
1.2 方法
1.2.1 剂量设计临床应用剂量[10-13]:本品临床为口服用药,临床拟用量以CBD 算为30~200 mg/d,按60 kg 体重计算人用药最大剂量为3.33 mg/(kg.d)。
急性毒性试验:SD 大鼠急性毒性试验最大耐受量(MTD) 以CBD 计算为837.5 mg/(kg.bw)。
1.2.2 分组适应性饲养后,选择合格动物150只,雌雄各半随机分为五组,每组30 只,实验设全普CBD 油50、125、250 mg/kg 三个剂量组,以CBD 算为33.5、83.75、167.5 mg/kg,分别为临床推荐剂量的10、25、50 倍,同时设玉米油溶媒对照,高压灭菌水阴性对照,每天5 mL/kg 等容量灌胃一次。进行连续经口染毒13 周,停药恢复观察4 周。
1.2.3 给药及观察检测试验期间密切观察大鼠一般状况,记录每周动物的体重、摄食量。在给药13 周及停药后4 周,每组各解剖20、10 只大鼠,雌雄各半。采用腹主动脉采血做血液学及血清生化检查。停药观察4 周做可逆性观察。解剖并对主要脏器进行病理组织学检查。

1.3 统计学处理
实验数据均采用SPSS 软件统计分析,计量资料,符合正态分布,结果采用均数±标准差方式表示,多组间比较用单因素方差分析,方差齐性时两两比较用LSD 方法分析,方差不齐时用秩和检验,P<0.05 为差异有统计学意义。
2 结果
2.1 对大鼠一般状况及体质量的影响
大鼠灌胃给于全普CBD 油13 周和停药恢复性观察4 周内,对照组和各给药组大鼠精神状态良好,行为活动、呼吸正常,唾液腺、泪腺等腺体未见有异常分泌,皮毛光滑,粪便和尿液也未见异常。全普CBD 油对各组大鼠体质量增长变化未出现统计学差异(P>0.05),见图1。
2.2 摄食量变化
给药期各给药组和溶媒对照组各时段雌、雄鼠摄食量均低于阴性对照组,比较均有显著性差异(P<0.05/0.01),恢复期各给药组和溶媒对照组摄食量逐渐增加,见图2。
2.3 血液学检测结果
给药末期和恢复期血液学指标各组间比较均无显著性差异(P>0.05),见表1,2。

图1 CBD 油给药13 周大鼠体质量的经时变化Fig.1 Effect of the full spectrume CBD oil on the changes of dodyweight of rats

图2 全普CBD 油给药13 周大鼠耗食量的经时变化Fig.2 Effect of the full spectrume CBD oil on the changes of food consuptio
表1 全普CBD 油给药末期对血液学指标的影响()Tab.1 Effect of the full spectrume CBD oil haematological indexes after 13 weeks medication ()

表1 全普CBD 油给药末期对血液学指标的影响()Tab.1 Effect of the full spectrume CBD oil haematological indexes after 13 weeks medication ()
表2 全普CBD 油恢复期对血液学指标的影响()Tab.2 Effect of the full spectrume CBD oil haematological indexes after withdrawing medication for 4 weeks()

表2 全普CBD 油恢复期对血液学指标的影响()Tab.2 Effect of the full spectrume CBD oil haematological indexes after withdrawing medication for 4 weeks()
2.4 血清生化学及电解质指标检查结果
给药末期谷丙转氨酶(ALT)、血清碱性磷酸酶(ALP),给药中、高剂量组高于溶媒对照组,比较有统计学差异(P<0.01);血清白蛋白(ALB)、甘油三脂(Tri)、尿素氮(Urea) 高剂量组低于溶媒和阴性对照组,比较有统计学差异(P<0.01);血糖(GLU) 高、中、低剂量组均低于阴性对照组,比较有统计学差异(P<0.01);血清Na+,Cl-高剂量组低于溶媒和阴性对照组,比较有统计学差异(P<0.01),K+高剂量组低于阴性对照组,比较有统计学差异(P<0.01)。恢复期,除高剂量Tri 低于溶媒对照组外,其余各项检查指标均恢复正常,给药组与对照组比较无显著性差异(P>0.05),见表3,4。
表3 全普CBD 油给药末期血清生化学检查结果()Tab.3 Effect of the full spectrume CBD oil serum biochemical indexes of rats after 13 weeks medication ()

表3 全普CBD 油给药末期血清生化学检查结果()Tab.3 Effect of the full spectrume CBD oil serum biochemical indexes of rats after 13 weeks medication ()
与阴性对照组间比较,*P <0.05,**P <0.01;与溶媒对照组比较,▲P <0.05,▲▲P <0.01。
表4 全普CBD 油恢复期血清生化学检查结果()Tab.4 Effect of the full spectrume CBD oil serum biochemical indexes of rats after withdrawing medication for 4 weeks ()

表4 全普CBD 油恢复期血清生化学检查结果()Tab.4 Effect of the full spectrume CBD oil serum biochemical indexes of rats after withdrawing medication for 4 weeks ()
2.5 脏器重量及系数
给药末期雌、雄鼠肝脏重量及系数高、中剂量组,肝脑系数,高、中、低剂量均高于溶媒和阴性对照组,比较有统计学差异(P<0.01/0.05),脾脏重量、系数及脾脑系数高、中剂量组低于溶媒和阴性对照组,比较有统计学差异(P<0.01/0.05)。恢复期各剂量组各脏器重量、系数及脏脑系数均无统计学差异(P>0.05),见表5~表10。
2.6 对肝脏的病理组织学检查结果
给药末期高剂量组部分动物(7/10),中剂量组部分动物(5/10)、可见肝细胞脂肪变性,肝细胞胞浆可见大小不等的圆形空泡(图3、图4),图5 为正常的肝组织,且给药中、高剂量组与对照组比发生率有显著性差异(P<0.05)。部分可见肝细胞点状坏死、小灶炎,心脏局部间质有少量淋巴细胞为主的炎细胞浸润,此病理改变属大鼠常见自发性病理改变。
表5 全普CBD 油给药末期对雌鼠脏器系数的影响[g/100 g,()]Tab.5 Effect of the full spectrume CBD oil organ coefficients of the female rats after 13 weeks medication[g/100 g,()]

表5 全普CBD 油给药末期对雌鼠脏器系数的影响[g/100 g,()]Tab.5 Effect of the full spectrume CBD oil organ coefficients of the female rats after 13 weeks medication[g/100 g,()]
与阴性对照组间比较,*P <0.05,**P <0.01;与溶媒对照组比较,▲P <0.05,▲▲P <0.01。
表6 全普CBD 油给药末期对雄鼠脏器系数的影响[g/100 g,()]Tab.6 Effect of the full spectrume CBD oil organ coefficients of the male rats after 13 weeks medication[g/100 g,()]
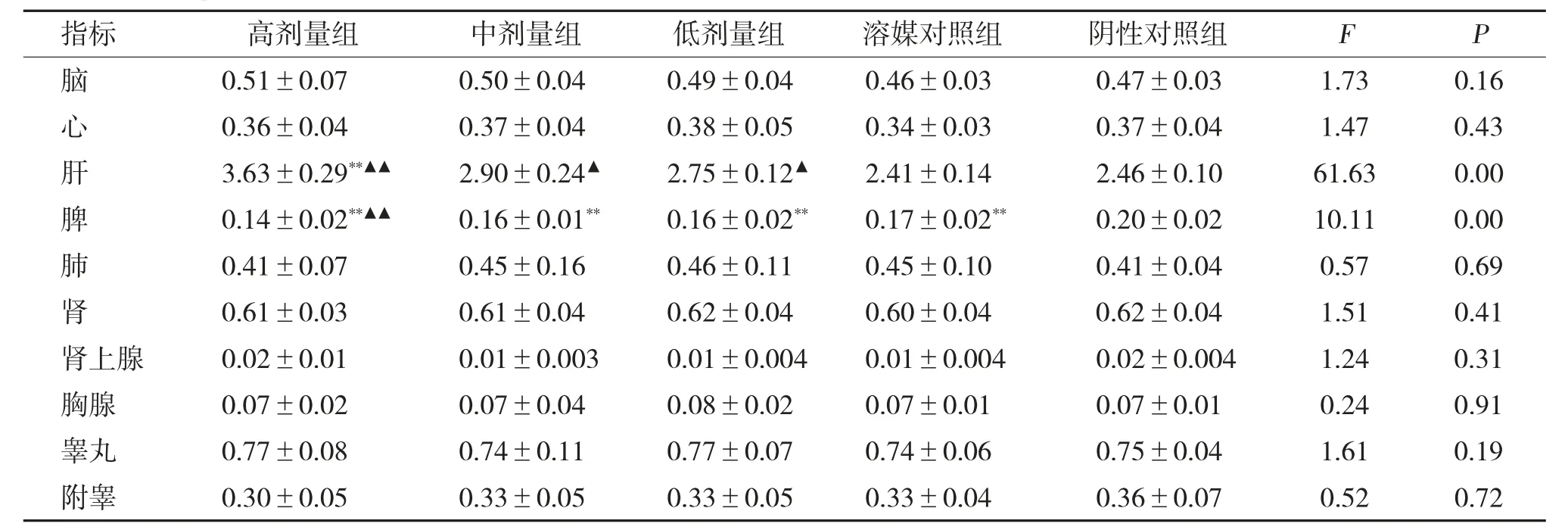
表6 全普CBD 油给药末期对雄鼠脏器系数的影响[g/100 g,()]Tab.6 Effect of the full spectrume CBD oil organ coefficients of the male rats after 13 weeks medication[g/100 g,()]
与阴性对照组间比较,*P <0.05,**P <0.01;与溶媒对照组比较,▲P <0.05,▲▲P <0.01。
表7 全普CBD 油恢复期对雌鼠脏器系数的影响[g/100 g,()]Tab.7 Effect of the full spectrume CBD oil organ coefficients of the female rats after withdrawing medication for 4 weeks [g/100 g,()]

表7 全普CBD 油恢复期对雌鼠脏器系数的影响[g/100 g,()]Tab.7 Effect of the full spectrume CBD oil organ coefficients of the female rats after withdrawing medication for 4 weeks [g/100 g,()]
表8 全普CBD 油恢复期对雄鼠脏器系数的影响[g/100 g,()]Tab.8 Effect of the full spectrume CBD oil on organ coefficients of the male rats after withdrawing medication for 4 weeks[g/100 g,()]
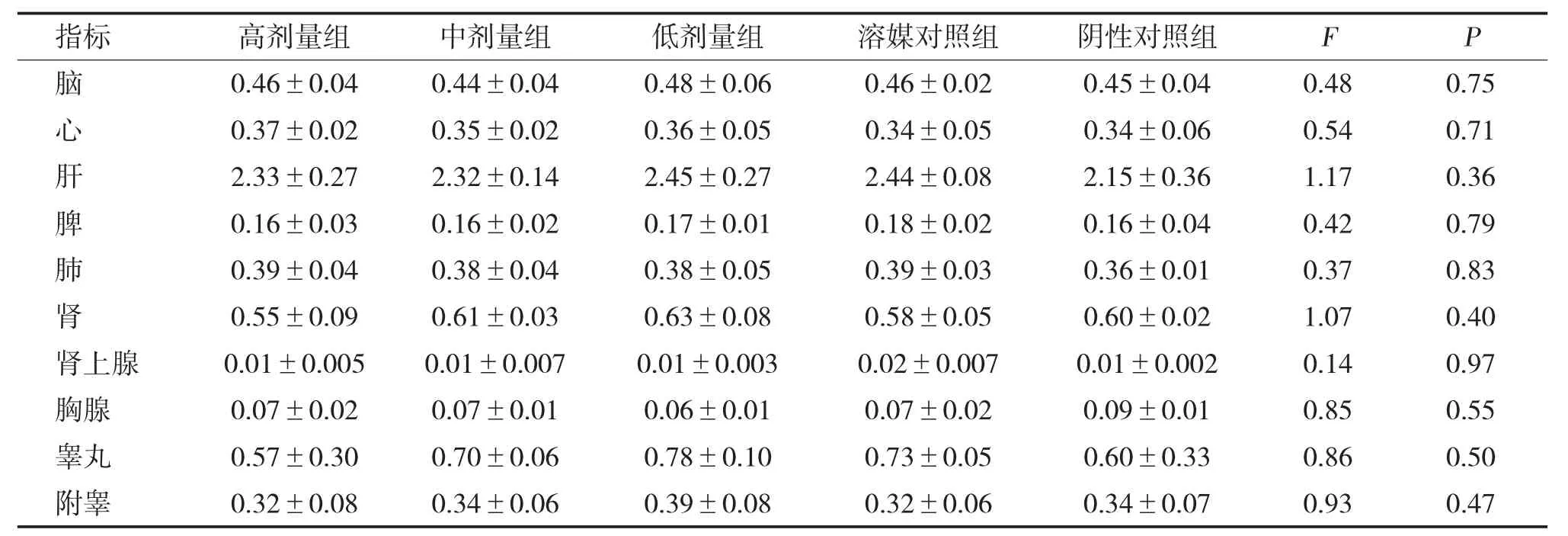
表8 全普CBD 油恢复期对雄鼠脏器系数的影响[g/100 g,()]Tab.8 Effect of the full spectrume CBD oil on organ coefficients of the male rats after withdrawing medication for 4 weeks[g/100 g,()]
表9 全普CBD 油给药末期对大鼠脏脑比的影响[g/g,()]Tab.9 Effect of the full spectrume CBD oil on Viscera/brain coefficients after 13 weeks medication[g/g,()]

表9 全普CBD 油给药末期对大鼠脏脑比的影响[g/g,()]Tab.9 Effect of the full spectrume CBD oil on Viscera/brain coefficients after 13 weeks medication[g/g,()]
与阴性对照组间比较,*P <0.05,**P <0.01;与溶媒对照组比较,▲P <0.05,▲▲P <0.01。
表10 全普CBD 油恢复期对大鼠脏脑比的影响[g/g,()]Tab.10 Effect of the full spectrume CBD oil on Viscera/brain coefficients after withdrawing medication for 4 weeks[g/g,()]

表10 全普CBD 油恢复期对大鼠脏脑比的影响[g/g,()]Tab.10 Effect of the full spectrume CBD oil on Viscera/brain coefficients after withdrawing medication for 4 weeks[g/g,()]
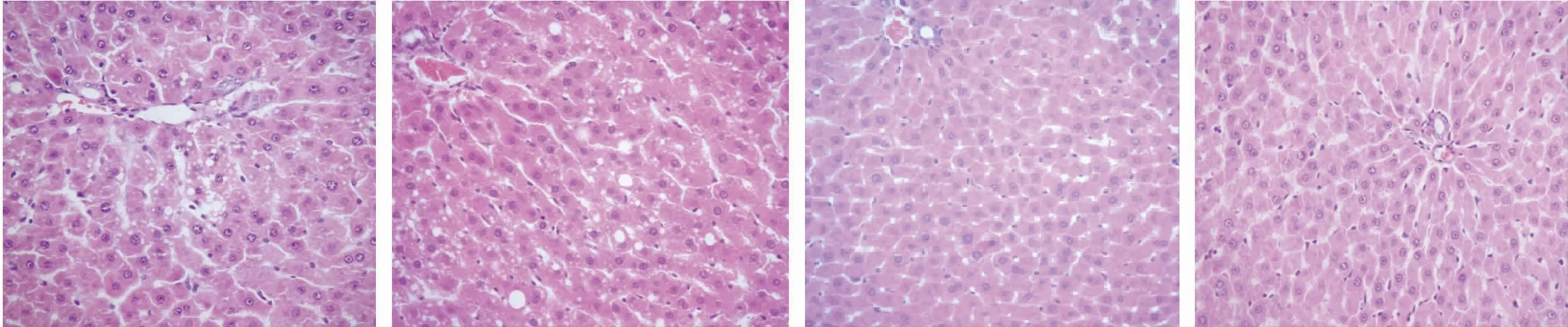
图3 全普CBD 油高剂量组肝脏轻度脂肪变性(HE 40×)Fig.3 Liver is mildly steatotic in CBD high group(HE 40×)

图4 全普CBD 油中剂量组肝脏轻度脂肪变性(HE 40×)Fig.4 Liver is mildly steatotic in middle group (HE 40×)
3 讨论
3.1 体重及摄食量
本研究对SD 大鼠连续经口染毒13 周,恢复4周的安全性进行评价研究。试验期间,每天观察大鼠的外观、行为等表现,整个试验过程中各剂量组大鼠未出现死亡情况,且所有大鼠的行为、精神状态、饮饲等无异常。给药期及恢复期,各剂量组动物体重呈稳步上升趋势,符合正常生长规律[15-16]。给药各剂量组摄食量有所降低,但降低程度与溶媒对照组相当,原因主要考虑溶媒植物油对大鼠食欲、消化功能的影响,而非全普CBD油本身的毒性所致。

图5 CBD 油低剂量组肝脏小灶炎(HE 40×)Fig.5 Liver has focal inflammation in CBD low group(HE 40×)

图6 溶媒组正常肝组织(HE 40×)Fig.6 Liver is normal in solvent group (HE 40×)
3.2 血液学及血清生化指标
给药末期和恢复期对大鼠采血进行血液学和血清生化学检测。给药末期和恢复期血液学指标各组间比较均无显著性差异。
血清生化指标,ALT、AST 和ALP 等生物酶学指标,是评价肝细胞损伤的敏感指标[17-19],大多数情况下ALT 和AST 升高程度与肝细胞受损程度相一致,是目前最常用的肝功能检测指标。给药末期,给药高、中剂量组血清中ALT、ALP 明显升高,ALB 降低,提示服用全普CBD 油用高、中剂量组药物时对可能引起肝细胞损伤,但停药后该影响即消失,提示在后期的研究和临床应用过程中注意监测肝功能变化。
血清K+、Na+、Cl-对保持细胞外液容量、调节酸碱平衡、维持正常渗透压和细胞生理功能有重要意义,并参与维持神经肌肉的正常应激性。而本研究中、高剂量K+、Na+、Cl-及高剂量组血清Tri、Urea 低于阴性对照或溶媒对照组,GLU 高、中、低剂量组均低于阴性对照组,但降低程度较低,是其药理作用的延申或毒性作用,可以通过增加剂量或延长给药时间来进一步研究判断。
3.3 脏器重量、脏器系数和病理组织学检查
给药末期雌、雄鼠肝脏重量及系数高、中剂量组,肝脑系数,高、中、低、剂量均高于溶媒和阴性对照组,比较有统计学差异(P<0.01/0.05),且具有剂量-反应关系。病理组织学显示高、中剂量组均出现肝脏的轻度脂肪变性,且高剂量组发生率增加。脾脏重量、系数及脾脑系数高、中剂量组低于溶媒和阴性对照组,比较有统计学差异(P<0.01/0.05),但毒性判断必须综合考虑脾脏重量的剂量相关性及组织病理学改变才具有一定的毒理学意义[20]。该研究血液学、血清生化学和病理组织学检查未发现关联性变化,因此无毒理学意义。恢复期各剂量组各脏器重量、系数及脏脑系数均无统计学差异(P>0.05)。本实验表明全普CBD 油无毒反应剂量为50 mg/kg,相当于人体推荐用量的10 倍以下为安全剂量,但在临床应用过程中需要密切监测肝功变化。
