血浆IGF-1联合GOS评分对动脉瘤性蛛网膜下腔出血患者预后的预测价值
2020-11-12秦浩尹航张亚波冯丽君庄强
秦浩,尹航,张亚波,冯丽君,庄强
枣庄市立医院,山东枣庄 277100
动脉瘤性蛛网膜下腔出血(aSAH)是导致神经功能缺损甚至死亡的严重脑血管疾病,病死率30%~50%,仅30%可恢复到生活自理[1]。近年来,随着临床治疗技术的提高,aSAH病死率有所下降,但其预后仍不乐观,多数存活患者可遗留不同程度神经功能缺损,严重影响患者生存质量[2]。目前缺少aSAH预后有效预测指标。格拉斯哥预后(GOS)评分是评价严重创伤和头部损伤预后的常用指标,操作简便,在颅脑损伤、脑出血患者预后评估中有一定价值[3],但受操作者主观因素影响较大,单独应用GOS评分存在一定弊端。aSAH患者存在明显垂体功能障碍和生长激素缺乏,影响神经内分泌系统稳定和患者预后,胰岛素样生长因子-1(IGF-1)具有调节生长激素作用,IGF-1缺乏可能参与了aSAH后垂体功能障碍进程[4]。IGF-1联合GOS评分是否能有效预测aSAH患者预后尚待探讨。2016年6月—2019年6月,我们探讨了IGF-1联合GOS评分预测aSAH患者预后预测的价值。
1 资料与方法
1.1 临床资料 选择218例aSAH患者(aSAH组),纳入标准:①颅脑CT和MRI提示出血灶,符合2015版《中国蛛网膜下腔出血诊治指南》中诊断标准[5];②脑数字减影血管造影(DSA)检查明确责任动脉瘤;③发病至入院时间<48 h。排除标准:①颅脑外伤、高血压导致的脑出血、烟雾病、动静脉畸形、假性动脉瘤;②合并颅内感染、全身感染、心血管疾病、肝肾功能障碍者;③入院48 h内死亡者。218例患者中男126例、女92例,年龄59~73(66.35±4.49)岁。发病至入院时间1~20(3.27±0.45)h,吸烟史100例,饮酒史87例,高血压110例,糖尿病94例,高脂血症68例,冠心病38例。动脉瘤位置:颈内动脉84例,前交通动脉75例,大脑中动脉59例;动脉瘤直径:<5 mm者72例,6~15 mm者99例,>15 mm者47例。Hunt-Hess分级[6]Ⅰ~Ⅱ级125例,Ⅲ~Ⅴ级93例;改良Fisher分级[7]Ⅰ~Ⅱ级137例,Ⅲ~Ⅴ级81例;治疗方式:血管介入术75例,开颅夹闭术110例,保守治疗28例;入院至手术时间<72 h 111例,≥72 h 107例;术后并发症:迟发性脑缺血[8]51例,脑出血59例,脑血管痉挛36例,脑积水47例。另选择同期我院门诊93例体检健康者为对照组,男56例、女37例,年龄55~72(65.19±4.03)岁。两组受试者年龄、性别比较无统计学差异(P>0.05)。本研究获得我院伦理会批准,受试者或其家属均知情同意签署同意书。
1.2 血生化指标检测 患者入院24 h内采集空腹肘静脉血3~5 mL,置于TDZ4-WS低速自动平衡离心机(长沙湘智离心机仪器有限公司)4 ℃条件下离心取血浆,保存于-80 ℃超低温冰箱(Thermo Fisher公司)。采用意大利BIOBASE2000型全自动酶免分析仪,以酶联免疫吸附试验检测血清IGF-1、C反应蛋白(CRP)水平,试剂盒购自美国Epitope Diagnostics公司。罗氏 Modular全自动生化分析仪检测总胆固醇(TC)、甘油三酯(TG)、低密度脂蛋白胆固醇(LDL-C)、高密度脂蛋白胆固醇(HDL-C)。雅培I2000全自动化学发光免疫分析仪及配套试剂检测空腹血糖(FPG)。
1.3 GOS评分 aSAH组出院时进行GOS评分,1分为死亡;2分为植物生存状态,仅有最小反应;3分为遗留重度残疾,意识清醒,需要他人照顾;4分为遗留轻度残疾,可独立生活或在保护下工作;5分为患者恢复良好,可正常生活,经有轻度缺陷[3]。
1.4 预后判断 患者出院后均随访6个月,采用改良Rankin量表(mRS)[9]评估患者临床转归,0分为无功能受限和遗留症状;1分为有症状、无明显功能障碍;2分为轻度残疾、但生活能自理;3分为中度残疾;4分为中重度残疾;5分为重度残疾。mRS评分≤2分为预后良好组,共150例,mRS评分>2分为预后不良组,共68例。
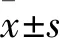
2 结果
2.1 aSAH组与对照组血浆IGF-1水平、GOS评分比较 aSAH组血浆IGF-1水平51~71(60.32±8.59)ng/mL,对照组75~129(92.15±15.46)ng/mL,aSAH组血浆IGF-1水平低于对照组(t=26.296,P<0.01)。aSAH组GOS评分1~5(3.03±0.25)分。
2.2 影响 aSAH预后的单因素分析 预后不良组年龄(66.91±6.34)岁,男40例、女28例,发病至入院时间(3.15±0.34)h,吸烟史31例,饮酒史26例,高血压39例,糖尿病32例,高脂血症27例,冠心病12例,动脉瘤位置:颈内动脉28例、前交通动脉24例、大脑中动脉16例,动脉瘤直径<5mm 22例、6~15mm 30例、>15mm 16例,Hunt-Hess分级Ⅰ~Ⅱ级28例、Ⅲ~Ⅴ级40例,改良Fisher分级Ⅰ~Ⅱ级32例、Ⅲ~Ⅳ级36例,迟发性脑缺血30例,脑出血29例,脑血管痉挛15例,脑积水19例,治疗方式:血管介入28例、开颅夹闭术35例、保守治疗5例,入院至手术时间<72 h 26例、≥72 h 42例。预后良好组年龄(66.10±6.03)岁,男86例、女64例,发病至入院时间(3.32±0.47)h,吸烟史79例,饮酒史61例,高血压71例,糖尿病62例,高脂血症41例,冠心病26例,动脉瘤位置:颈内动脉56例、前交通动脉51例、大脑中动脉43例,动脉瘤直径<5mm 50例、6~15mm 69例、>15mm 31例,Hunt-Hess分级 Ⅰ~Ⅱ级97例、Ⅲ~Ⅴ级53例,改良Fisher分级Ⅰ~Ⅱ级105例、Ⅲ~Ⅳ级45例,迟发性脑缺血21例,脑出血30例,脑血管痉挛21例,脑积水28例,治疗方式 :血管介入47例、开颅夹闭术75例、保守治疗23例,入院至手术时间<72 h 85例、≥72 h 65例。预后不良组与预后良好组年龄、性别比例、吸烟史比例、饮酒史比例、高血压比例、糖尿病比例、高脂血症比例、冠心病比例、动脉瘤位置、动脉瘤直径、术后并发脑血管痉挛比例、并发脑积水比例、手术方式、比较差异均无统计学意义(P>0.05),预后不良组Hunt-Hess分级Ⅲ~Ⅳ级占比、改良Fisher分级Ⅲ~Ⅳ级占比、并发迟发性脑缺血比例、并发脑出血比例、入院至手术时间≥72h占比、FPG、血浆CRP高于预后良好组(P<0.05),血浆IGF-1水平、GOS评分低于预后良好组(P<0.05),两组血生化指标检测结果见表1。
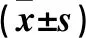
表1 两组血生化指标检测结果
2.3 aSAH预后影响因素的Logisic回归分析 以aSAH预后为因变量(0=转归不良,1=转归良好),Hunt-Hess分级(赋值:1=Ⅰ~Ⅱ级,2=Ⅲ~Ⅳ级)、改良Fisher分级(赋值:1=Ⅰ~Ⅱ级,2=Ⅲ~Ⅳ级)、并发迟发性脑缺血(赋值:1=是,0=否)、并发脑出血(赋值:1=是,0=否)、并发脑积水(赋值:1=是,0=否)、入院至手术时间(赋值:1=<72 h,2=≥72 h)、FPG(连续性变量)、CRP(连续性变量)、IGF-1(连续性变量)、GOS评分(连续性变量)为自变量,建立Logistic回归模型,最终并发迟发性脑缺血、Hunt-Hess分级Ⅳ~Ⅴ级、低血浆IGF-1水平、低GOS评分是aSAH不良预后的独立危险因素(P均<0.01),见表2。
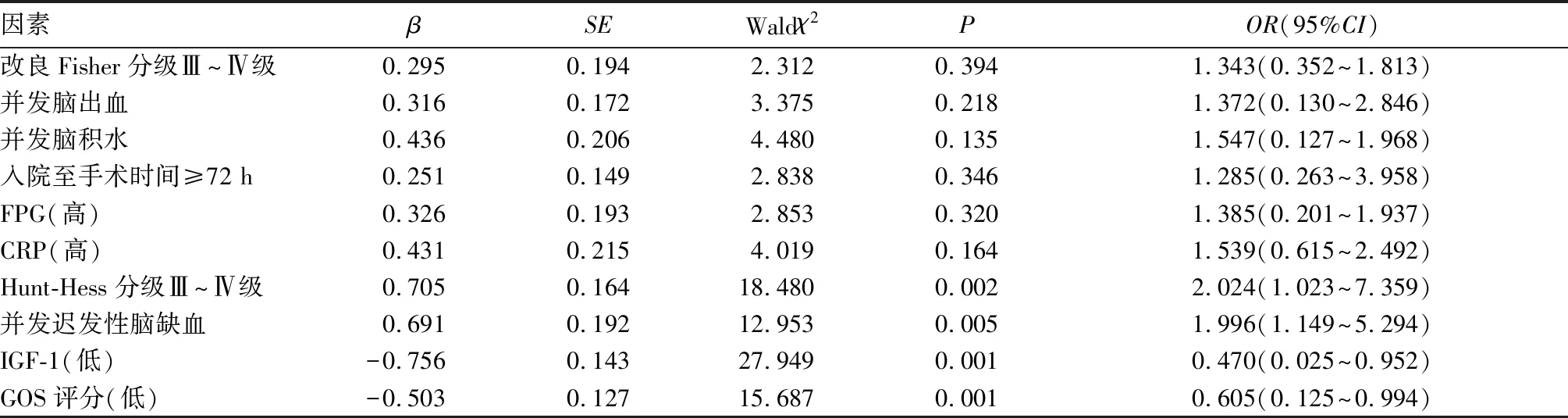
表2 影响aSAH预后的Logistic回归分析
2.4 血浆IGF-1水平联合GOS评分对aSAH预后的预测价值 血浆IGF-1水平、GOS评分、IGF-1+ GOS预测aSAH预后不良的曲线下面积(AUC)分别为0.850、0.771、0.946,IGF-1+ GOS预测aSAH预后不良的AUC高于单独IGF-1、GOS(Z分别为2.031、3.264,P均<0.05)。血浆IGF-1水平、GOS评分最佳截断值(cut-off)分别为70.05 ng/mL、3分,血浆IGF-1水平、GOS评分、IGF-1+ GOS预测aSAH预后的效能见表3。
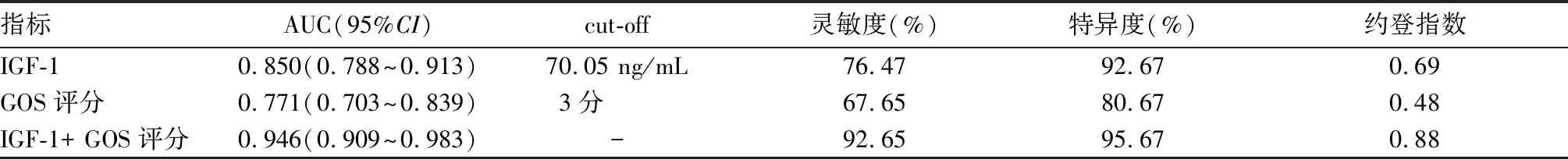
表3 血浆IGF-1水平、GOS评分、IGF-1+ GOS评分预测aSAH预后的效能

图1 血浆IGF-1水平、GOS评分、IGF-1+ GOS评分预测aSAH预后的ROC曲线
3 讨论
aSAH是动脉瘤破裂导致血液进入蛛网膜下腔引起的脑实质损伤性疾病,吸烟、饮酒、高血压、遗传等是aSAH发病的高危因素,aSAH发病急,病情进展迅速且凶险,早期得不到有效救治,可导致不可逆转的脑损伤或脑死亡等,病死率高[10]。目前aSAH治疗以保守治疗、介入和手术治疗为主,但疗效仍不容乐观,治疗后早期出血、脑血管疾病、迟发性脑缺血、脑水肿等均可影响手术治疗转归,增加病死率[11,12]。GOS评分是评估神经功能的敏感指标,本研究结果显示,GOS评分降低是aSAH患者不良预后的危险因素之一,说明GOS评分可用于aSAH患者预后评估,但GOS评分对aSAH患者预后预测灵敏度和特异度均偏低,可能与其缺乏年龄、影像学检查结果及与患者预后密切相关的生物学指标有关[13]。
IGF-1是一种分泌型小肽生长因子,参与机体生长、组织修复、碳水化合物、蛋白质和脂质代谢等多种生理和病理生理过程[14]。IGF-1作为生长激素关键调节因子,在生长发育中起重要作用,同时还参与调控中间代谢、组织修复和糖尿病、高血压等慢性疾病发病机制[15]。近期研究显示,外伤性脑损伤、aSAH后垂体功能障碍可影响患者认知和整体预后[16],垂体是人体内分泌器官的“头领”,可分泌多种激素类物质,垂体功能障碍可导致神经内分泌紊乱,约12.1%创伤性脑损伤和aSAH患者血清IGF-1水平明显下降[17],提示IGF-1缺失与aSAH发病和发展可能存在关联。目前缺乏IGF-1与aSAH的相关报道,IGF-1是否能为aSAH预后评估提供有效信息尚不清楚。本研究结果显示,aSAH组血清IGF-1水平低于对照组,且在预后不良组中血清IGF-1水平更低,说明IGF-1缺失可能与aSAH发病和不良预后有关。多因素分析结果显示,低血清IGF-1水平是aSAH患者出院6个月内神经功能恶化的危险因素,验证了IGF-1与aSAH患者预后的关系。IGF-1参与aSAH患者病情进展的机制:垂体位于鞍隔下方,被willis环包围,对缺血敏感,脑组织损伤出血可影响垂体血供,导致垂体功能障碍,影响生长激素分泌,降低外周血IGF-1浓度[18]。IGF-1作为生长激素调节蛋白,具有维持神经元存活和轴突生长功能,在神经内分泌调节中发挥重要作用,IGF-1活性降低或表达缺失不仅影响神经元生长,而且可促使神经细胞凋亡、坏死,导致神经退行性病变和神经功能的恶化[19]。因此 IGF-1水平降低加剧了aSAH病情进展,导致不良预后的发生。
本研究结果显示,IGF-1预测aSAH患者预后的AUC为0.850,灵敏度76.47%,特异度92.67%,提示IGF-1可作为一种新的生物标记物评价aSAH患者预后。而GOS评分联合IGF-1预测aSAH患者不良预后的灵敏度和特异度提高,AUC大于GOS评分,说明增加IGF-1评估可弥补GOS评分不足,提高对aSAH患者预后评估的准确性。本研究多因素回归分析结果显示,并发迟发性脑缺血、Hunt-Hess分级Ⅳ~Ⅴ级是aSAH患者预后不良危险因素之一,迟发性脑缺血由脑血管痉挛引起,是aSAH的严重并发症,可导致aSAH死亡[20]。Hunt-Hess Ⅳ~Ⅴ级预示较高的再出血和脑血管痉挛风险,临床病死率高于Ⅰ~Ⅱ级患者[21]。提示对于低IGF-1、低GOS评分、并发迟发性脑缺血、Hunt-Hess Ⅳ~Ⅴ级的aSAH患者,应高度警惕不良预后的发生,加强病情监测和临床干预以降低神经功能恶化的风险。
综上所述,血浆IGF-1水平降低、GOS评分低与aSAH患者不良预后密切相关。IGF-1联合GOS评分可提高对aSAH患者预后的预测价值。
