野生型和自然缺失突变型HBx蛋白对肝癌细胞生物学行为的影响
2020-11-12张晶毕利泉辛萱王翠翠刘晓红
张晶,毕利泉,辛萱,王翠翠,刘晓红
1 山东省立第三医院,济南250031;2 中国人民解放军联勤保障部队第九六〇医院
乙型肝炎病毒(HBV)与肝癌的发生密切相关。HBV基因组具有四个开放读码框,其中X基因是最小的一个,其编码的HBx蛋白在转录水平反式激活病毒基因表达,在肝癌的发生发展中发挥重要作用[1]。研究发现,人肝癌组织中存在频发的HBx基因的缺失突变,导致HBx蛋白羧基端氨基酸的缺失,但其确切生物学功能和作用机制尚不清楚[2,3]。既往我们在人肝癌组织中发现了HBx基因的自然缺失突变体,其编码的HBx蛋白羧基端129-154aa缺失,我们命名为HBx-128w[4]。2012年3月—2015年12月,我们构建了含全长序列野生型HBx(HBx-FJ)和羧基端缺失129-154aa突变型HBx(HBx-128w)的真核表达载体,用pcDNA3.1空载体作为对照,通过转染人肝癌细胞系SMMC-7721并检测各转染组细胞的生物学活性,了解该自然缺失突变体和野生型HBx蛋白对SMMC-7721细胞生物学行为的影响,从而明确这两种蛋白在肝癌发生中的作用及功能差异。
1 材料与方法
1.1 材料 人肝癌细胞系SMMC-7721(以下称SMMC-7721细胞)购自中国科学院细胞库。重组表达载体pcDNA3.1-HBx-128w和pcDNA3.1-HBx-FJ购自上海锐赛生物技术有限公司。真核表达载体pcDNA3.1和脂质体LipofectamineTM2000转染试剂盒购自美国Invitrogen公司;鼠抗HBxAg单克隆抗体、辣根过氧化酶(HRP)标记的鼠抗兔IgG二抗、ECL化学发光检测试剂盒购自美国Santa Cruz公司;十二烷基硫酸钠—聚丙烯酰胺(SDS-PAGE)凝胶配制试剂盒购自上海碧云天公司;G418培养基、胎牛血清、RPMI1640培养基、Opti-MEM培养基、胰蛋白酶购自美国Gibco BRL公司;聚偏二氟乙烯(PVDF)膜购自美国Bio-Rad公司;四甲基偶氮唑盐(MTT)、二甲基亚砜(DMSO)、溴化乙啶、RNaseA购自美国Sigma公司;Transwell小室及Matrigel胶购自美国Corning公司;多聚甲醛、结晶紫均为国产分析级产品;SPF级5周龄雄性BALB/C裸小鼠购自上海斯莱克实验动物责任有限公司。NanoDrop ND-1000超微量分光光度计购自美国Nanodrop公司;倒置显微镜购自日本Olympus公司;Synergy酶标仪购自美国Bio-Tek公司;流式细胞仪FACScan购自美国Becton Dicknson公司。
1.2 细胞转染与稳定转染细胞株的筛选 SMMC-7721细胞培养于含10%胎牛血清和1%双抗(青霉素、链霉素)的RPMI1640培养液中,置于5% CO2、37 ℃、饱和湿度的培养箱,隔天换液1次,PBS洗涤2次,3~4 d传代1次。取对数生长期、生长状态良好的SMMC-7721细胞,用0.25%胰蛋白酶消化2 min,用含10%胎牛血清的Opti-MEM培养基吹打细胞形成单细胞悬液。以每孔6×105个接种于6孔板,随机分为pcDNA3.1组、HBx-FJ组、HBx-128w组,每组设3个复孔。将6孔板放入5% CO2、37 ℃的培养箱中培养24 h,至细胞80%~90%融合时取出,去除原培养基,加入500 μL Opti-MEM培养基,备用。取10 μL LipofectamineTM2000试剂加入到240 μL Opti-MEM培养基中混匀,室温孵育5 min;4 μg待转染质粒加入到240 μL Opti-MEM培养基中混匀,室温孵育5 min。将这两种稀释物混合形成质粒-LipofectamineTM2000混合物,室温孵育20 min。将质粒-LipofectamineTM2000混合物平均分配至待转染孔中,培养箱中培养5 h。去除含质粒-LipofectamineTM2000复合物的培养基,添加含10%胎牛血清的Opti-MEM培养基,继续培养24 h。取1/3的细胞用PBS冲洗,胰蛋白酶消化后加入6孔板,并加入含G418(终浓度为600 μg/mL)的培养基,每3 d更换1次新的G418筛选培养基,10 d左右可见大部分细胞死亡,降低G418浓度至300 μg/mL继续培养,每周更换1次新的筛选培养基,至培养皿中可见少量肉眼可见的克隆,将之用胰蛋白酶消化后扩大培养。
1.3 各组稳转细胞HBx蛋白表达检测 采用Western blotting法。取培养48 h的各组稳转细胞及未转染SMMC-7721细胞,PBS清洗2次,加入SDS-PAGE上样缓冲液,冰上将细胞刮下,转移至EP管中,100 ℃水浴10 min,12 000 g离心5 min(离心半径10 cm),取上清,上样至10%的SDS-PAGE凝胶加样孔内电泳(100 V)。湿转法将蛋白质电泳产物转移到PVDF膜上,5%脱脂奶粉封闭1 h,TBST洗膜3次,加入鼠抗HBxAg单克隆抗体4 ℃过夜,β-actin作为内参。次日加入HRP标记的二抗37 ℃孵育1 h,TBST洗膜5次,每次5 min,ECL化学发光检测试剂盒显影成像。
1.4 细胞增殖活性检测 采用MTT法。取对数生长期的各组稳转细胞,用0.25%胰蛋白酶消化,用含10%胎牛血清的培养基吹打细胞,形成密度为5×104/mL的单细胞悬液。按1×104/孔接种于96孔板中,每组设3个复孔,取平均值。置于5% CO2、37 ℃、饱和湿度的培养箱中继续培养。接种后每24 h为1个检测点,连续检测7 d。检测时每孔中避光加入5 mg/mL MTT液继续培养,4 h后除去培养基,加入DMSO 150 μL,振荡混匀,避光反应15 min。每孔各取100 μL转移至新的酶标板,于酶标仪上读取570 nm波长处的OD值,以时间为横坐标、OD570值为纵坐标并绘制生长曲线。实验重复3次。
1.5 细胞增殖能力检测 采用平板克隆形成实验。取对数期生长的各组稳转细胞,0.25%胰蛋白酶消化,按3×102/孔细胞密度接种于6孔板,置于5% CO2、37 ℃、饱和湿度的培养箱中培养14 d,至出现肉眼可见的克隆,4%多聚甲醛固定15 min,0.4%结晶紫染液染色10 min,PBS冲洗、拍照并计数大于50个细胞的克隆数,计算克隆形成率(%)=克隆数/接种细胞数×100%。每组设3个复孔,各组实验均重复3次。
1.6 细胞周期测定 取对数生长期的各组稳转细胞,制成密度为1×106/mL的单细胞悬液,按2×106/孔接种于6孔板中继续培养。48 h后终止培养,除去培养基,预冷的PBS清洗2次,1 500 r/min离心5 min(离心半径10 cm),弃上清,加入70%乙醇4 ℃过夜固定。加入PBS离心,用200 μL的PBS重悬细胞,100 μg/mL RNaseA 37 ℃消化30 min。加入50 μg/mL溴化乙啶4 ℃避光染色30 min,流式细胞仪测定。每孔设3个复孔,实验重复3次。
1.7 细胞迁移能力检测 采用细胞划痕实验。取对数生长期的各组稳转细胞,0.25%胰蛋白酶消化后制成单细胞悬液。按1×105/孔接种于6孔板中,置于5%CO2、37 ℃、饱和湿度的培养箱中继续培养,待融合度达到90%时,弃去培养基,用200 μL Tip头部垂直快速划痕,PBS洗去划下的细胞,记录时间为0 h,加入新鲜培养基继续培养48 h,倒置显微镜下观察拍照,Image J软件测量划痕区宽度,计算划痕宽度百分比(%)=(48 h划痕宽度/0 h划痕宽度)×100%。每组实验重复 3 次。
1.8 细胞侵袭能力检测 采用Transwell小室实验。无血清培养基以1∶8稀释 Matrigel胶,平铺于Transwell上室。取对数生长期的各组稳转细胞,用0.25%胰蛋白酶消化后制成单细胞悬液,按1×104个(200 μL)加入到上室,下室加入500 μL含10%胎牛血清的培养基,置于5%CO2、37 ℃、饱和湿度的培养箱中孵育24 h。弃掉下室的培养基,用4%多聚甲醛固定15 min,0.4%结晶紫染液染色10 min,除去上室残留的细胞,显微镜下随机取5个不同的视野(×100)拍照并计数穿膜细胞数。每组实验重复3次,取均值。
1.9 各组稳转细胞体外成瘤能力检测 采用裸鼠成瘤实验。裸小鼠置于层流架中SPF条件下饲养,所用饲料、垫料、笼具及器械均高压消毒后使用。将9只SPF级5周龄雄性BALB/C裸小鼠随机分为3组,分别接种pcDNA3.1-HBx-FJ、pcDNA3.1-HBx-128w、pcDNA3.1转染的SMMC-7721细胞。每只小鼠于颈背部皮下接种,接种后10 d左右肿瘤生长至可测量大小,之后每4~5 d测量肿瘤体积,接种后第32天无痛处死裸鼠,测量各移植瘤的重量。
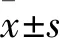
2 结果
2.1 稳转细胞HBx蛋白表达 Western blotting结果显示,HBx-FJ组和HBx-128w组SMMC-7721细胞检测到HBx阳性条带,而pcDNA3.1组无此条带,提示HBx蛋白在HBx-FJ组和HBx-128w组SMMC-7721细胞内高表达。
2.2 各组SMMC-7721细胞增殖活性比较 MTT实验结果显示,从第2天开始,HBx-FJ组和HBx-128w组细胞增殖能力高于pcDNA3.1组(P<0.05);从第4天开始,HBx-128w组细胞增殖能力高于HBx-FJ组(P<0.05)。见表1。
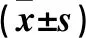
表1 转染后各组SMMC-7721细胞增殖活性比较
2.3 各组SMMC-7721细胞增殖能力比较 pcDNA3.1组、HBx-FJ组、HBx-128w组细胞的克隆形成率分别为40.11%±5.32%、52.67%±6.34%、70.78%±4.53%,HBx-FJ组和HBx-128w组细胞增殖能力高于pcDNA3.1组,而HBx-128w组细胞增殖能力高于HBx-FJ组(P均<0.05)。
2.4 各组SMMC-7721细胞周期比较 流式细胞分析结果显示,与pcDNA3.1组相比,HBx-FJ组和HBx-128w组G1期细胞减少,S期细胞增多(P<0.05);而HBx-FJ组和HBx-128w组比较差异无统计学意义。见表2。
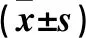
表2 转染后各组SMMC-7721细胞周期分布
2.5 各组SMMC-7721细胞迁移能力比较 划痕实验结果显示,pcDNA3.1组、HBx-FJ组、HBx-128w组细胞的划痕宽度百分比分别为84.44%±6.74%、72.78%±4.19%、46.67%±12.02%。与pcDNA3.1组和HBx-FJ组相比,HBx-128w组细胞的迁移距离增加(P<0.05);而pcDNA3.1组和HBx-FJ组细胞迁移能力比较无统计学差异。
2.6 各组SMMC-7721细胞侵袭能力比较 Transwell实验结果显示,pcDNA3.1组、HBx-FJ组、HBx-128w组穿膜细胞数分别为(35.2±6.14)、(63.2±7.50)、(93.0±7.18)个。与pcDNA3.1组相比,HBx-FJ组和HBx-128w组的穿膜细胞数增加(P均<0.05);与HBx-FJ组相比,HBx-128w组穿膜细胞数增加(P<0.05)。
2.7 各组SMMC-7721细胞体外成瘤能力比较 移植瘤体积测量结果显示,HBx-128w组移植瘤体积大于HBx-FJ组和pcDNA3.1组(P均<0.05);而HBx-FJ组移植瘤体积虽大于pcDNA3.1组,但差异无统计学意义,见表3。移植瘤重量测量结果显示,pcDNA3.1组、HBx-FJ组、HBx-128w组移植瘤重量分别为(90.435±49.526)、(190.092±51.631)、(255.995±31.658)mg;与pcDNA3.1组相比,HBx-FJ组和HBx-128w组移植瘤重量增加(P均<0.05);而HBx-128w组移植瘤重量虽大于HBx-FJ组,但差异无统计学意义。
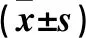
表3 转染后各组移植瘤体积比较
3 讨论
2018年2月,中国国家癌症中心发布最新癌症数据,肝癌是中国第四位的常见恶性肿瘤和第二位的肿瘤致死原因,全世界新发肝癌病例约50%来自我国,而我国的肝癌患者多与HBV慢性感染有关,往往具有肝纤维化、肝硬化背景[5,6]。目前, HBV基因组的整合与突变被认为可促进肝癌的发生发展[7~9]。HBV基因组是一种部分双链的环状DNA分子,双链长度不等,其长链含有4个公认的开放读码框——S、C、P、X[10],其中X基因是较易被整合的基因,频繁整合于宿主基因组,导致染色体的不稳定和突变的发生,是HCC发生发展的重要因素[11],其编码基因区位于1374~1838核苷酸,整合后的X基因编码HBx蛋白,相对分子质量约17 kD,有145~154个氨基酸残基,是具有广泛激活作用的反式作用因子[12]。其反式激活功能与抗细胞增殖、促细胞凋亡、抑制细胞转化密切相关,此有利于HBV在宿主体内的感染与复制。由于HBx蛋白不能直接与DNA双链结合,而是通过蛋白质—蛋白质的相互作用,结合细胞核内的转录因子或影响细胞浆内的信号转导途径,直接或间接地作用于靶基因的启动子或增强子,实现其反式激活功能[13]。
既往研究表明,在HCC组织中存在频繁的HBx基因3′端缺失突变,导致HBx蛋白羧基端氨基酸不同数目的缺失。对这些缺失突变体功能研究显示,氨基酸缺失的数目和位置不同,对HBx蛋白活性的影响也不同。Ritter等[14]研究发现,HBx蛋白C末端第149~154aa或N末端第2~30aa缺失不影响HBx的活性;而C末端的106~154aa或N末端1~9aa缺失,HBx的活性完全丧失;N末端3~66aa缺失,HBx的活性明显下降。因此认为,HBx蛋白的3~66aa和106~148aa是其功能域。Arii等[15]认为,HBx蛋白的3个区域(46~52aa、61~69aa、132~139aa)是其反式激活功能所必需的。Yoo等[16]认为,HBx蛋白的氨基端缺失对其反式激活功能影响不大,而羧基端缺失会使其严重丧失反式激活功能。HBx的缺失突变让野生型HBx促细胞凋亡的能力消失,其反式激活功能受到抑制,其功能区域在调节细胞增殖、凋亡、转化间的平衡改变,导致肝细胞单克隆性无控生长。
我们发现的HBx自然缺失突变体缺失了羧基端129~154aa,正好包含了132~139aa区域,与功能域106~148aa一致。体外实验结果显示,自然缺失突变体HBx-128w能显著增强肝癌细胞SMMC-7721的增殖能力、克隆形成能力、迁移侵袭能力及体外成瘤能力,细胞周期检测结果显示,HBx-128w促进细胞由G1期到S期的进程。Zhang等[17]亦从人HCC组织中发现了HBx的自然缺失突变体,其羧基端氨基酸128~154aa缺失。他们的实验结果显示,突变型HBx蛋白能增强细胞增殖,与本研究结果一致;他们还发现,突变型HBx蛋白失去了诱导细胞凋亡的能力,这可能是HBx缺失突变体促进HCC发生的原因之一。Ma等[18]研究了羧基端缺失121~154aa的HBx蛋白功能,认为该节段HBx蛋白通过激活细胞增殖在HCC癌变中发挥重要作用,并且比野生型HBx更能有效转化正常肝细胞系MIHA。这与我们的研究结果一致。本实验结果还显示,野生型HBx亦能增强SMMC-7721细胞的增殖活性、增殖能力、侵袭能力及体外成瘤能力,同样能促进细胞由G1期到S期的进程,但是缺失突变体HBx-128w的作用较之更显著。提示野生型HBx蛋白的持续高表达可能通过加速肝细胞凋亡从而诱导肝细胞再生以及基因突变的积累,最终导致肝细胞的恶性转化[19]。此外,HBx蛋白的持续高表达可以激活宿主体内多种转录因子和信号转导通路,参与HCC的发生。有研究发现,人HCC组织内普遍存在异质性的HBx,即可同时检测到野生型和突变型HBx[3]。因此,不排除二者协同作用,共同促进HCC的发生。
综上所述,野生型HBx蛋白和缺失突变体HBx-128w均能促进肝癌细胞SMMC-7721的恶性转化,在HCC发生发展中扮演重要角色。HBx蛋白的羧基端129~154aa区域是其重要功能区域,该区域的缺失使缺失突变型HBx蛋白发挥不同于野生型HBx蛋白的生物学功能,二者可能在HCC的不同发展阶段发挥作用,共同促进HCC的发生发展。未来我们将借助芯片技术研究二者在调控的靶基因及LncRNA方面的差异,进一步筛选差异表达基因,寻找治疗HCC的合适靶点。
