血清HMGB1、ESM-1 水平对脓毒症并发ARDS的预测价值
2020-11-12郭小芙席与斌陈刚
郭小芙,席与斌,陈刚
苏州市立医院,江苏苏州 215000
脓毒症是感染引起的全身炎症反应综合征,不积极控制体内炎症反应可引起体内环境失衡,导致多脏器功能障碍、休克甚至死亡[1]。肺是脓毒症易受累器官之一,如果脓毒症患者合并急性呼吸窘迫综合征(ARDS)则病情加重,病死率升高[2]。积极预防ARDS的发生对抑制脓毒症的病情进展、提高患者存活率有积极意义。高迁移率族蛋白B1(HMGB1)是人体早期、晚期重要的促炎细胞因子,是炎症级联反应的启动者,与脓毒症、类风湿关节炎和动脉粥样硬化有关[3]。研究发现,HMGB1作为炎症反应启动子参与脓毒症的发病和进展,与脓毒症患者临床结局有关[4],但HMGB1是否参与脓毒症并发ARDS尚不清楚。内皮细胞特异性分子1(ESM-1)是内皮细胞激活的标志物,表达于肺血管网中,参与血管内皮功能异常性疾病。研究显示,ESM-1在急性肺损伤早期呈高表达[5],但ESM-1在脓毒症所致ARDS发病机制中发挥何种作用有待探讨。2018年5月—2019年10月,我们检测了并发ARDS脓毒症患者、单纯脓毒症患者血清HMGB1、ESM-1,分析其对脓毒症患者并发ARDS的预测价值。
1 资料与方法
1.1 临床资料 选择2018年5月—2019年10月我院ICU收治的123例脓毒症患者,纳入标准:①初次确诊脓毒症,符合2015年欧洲危重病医学会制定脓毒症诊断标准[6];②入住重症监护室(ICU)超过24 h;③年龄18~70周岁;④心胸外科手术后。排除标准:①合并其他部位急慢性感染;②血液系统、免疫系统疾病;③既往有哮喘、肺气肿、肺部创伤史、肺部感染史、肺癌、肺结核等肺部疾病;④入住ICU不超过48 h内死亡者。其中39例合并ARDS(ARDS组),符合2012年柏林新定义的相关诊断标准[7],84例未合并ARDS(NARDS组)。ARDS组男21例、女18例,年龄(52.35±3.26)岁。NARDS组男51例、女33例,年龄(50.12±3.02)岁。另选择51例门诊体检健康的志愿者为对照组,男32例、女19例,年龄(50.34±3.16)岁。三组性别比较无统计学差异(P>0.05),ARDS组年龄高于NARDS组和对照组(t分别为5.562、5.036、P均<0.05),NARDS组与对照组年龄比较差异无统计学意义(P>0.05)。本研究获得我院伦理委员会批准,患者或其家属知情同意并签署同意书。
1.2 相关资料收集 收集患者基础疾病、感染部位、脓毒症分级(严重脓毒症、脓毒症休克[8])、急性生理与慢性健康状况Ⅱ(APACHE Ⅱ)评分、机械通气、合并症(肺部感染、急性肾损伤)、ICU住院时间、脏器衰竭数量等。APACHE Ⅱ评分根据患者入ICU 24 h内临床指标(体温、心率、呼吸、平均动脉压、血氧分压、电解质、肌酐、白细胞、神经功能等)最差值计算[9]。
1.3 血清HMGB1、ESM-1检测 患者入院24 h内(对照组于体检日)采集空腹肘静脉血3~5 mL,置于TDZ4-WS低速自动平衡离心机(长沙湘智离心机仪器有限公司)4 ℃下3 000/min离心15 min(离心半径10 cm),取血浆,保存于-80 ℃超低温冰箱(Thermo Fisher公司)。采用意大利BIOBASE2000型全自动酶免分析仪,以酶联免疫吸附试验检测血清HMGB1、ESM-1,试剂盒购自美国Epitope Diagnostics公司。
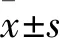
2 结果
2.1 两组疾病相关资料比较 ARDS组脓毒症休克比例、肺部感染比例、合并急性肾损伤比例、脏器功能衰竭个数≥2个比例、APACHE Ⅱ评分分别为64.10%(25/39)、58.97%(23/39)、48.72%(19/39)、41.03%(16/39)、(23.15±6.24)分,NARDS组脓毒症休克比例、肺部感染比例、合并急性肾损伤比例、脏器功能衰竭个数≥2个比例、APACHE Ⅱ评分分别为39.29%(33/84)、30.95%(26/84)、29.76%(25/84)、17.86%(15/84)、(15.02±3.74)分,ARDS组均高于NARDS组(χ2/t分别为6.583、8.726、4.166、7.584、8.926,P均<0.05)。ARDS组、NARDS组男性比例、糖尿病比例、高血压比例、冠心病比例、高脂血症比例、泌尿系统感染、导管相关血流感染、腹腔感染、其他部位感染比例、机械通气比例、ICU住院时间≥10 d比例分别为53.85%(21/39)、38.46%(15/39)、46.15%(18/39)、53.85%(10/39)、38.46%(15/39)、46.15%(18/39)、25.64%(10/39)、33.33%(13/39)、28.21%(11/39)、38.46%(15/39)、23.08%(9/39)、10.26%(4/39)、51.28%(20/39)、43.59%(17/39);60.71%(51/84)、35.71%(30/84)、41.67%(35/84)、22.62%(19/84)、25.00%(21/84)、26.19%(22/84)、35.71%(30/84)、22.62%(19/84)、15.48%(13/84)、63.10%(53/84)、35.71%(30/84),两组比较差异均无统计学意义(χ2分别为0.743、0.087、0.219、0.135、0.925、0.623、1.541、0.700,P均>0.05)。
2.2 三组血清HMGB1、ESM-1 水平比较 ARDS组、NARDS组血清HMGB1、ESM-1 水平高于对照组(P均<0.05),见表1。
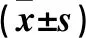
表1 三组血清HMGB1、ESM-1水平比较
2.3 影响脓毒症患者合并ARDS的Logistic回归分析 构建脓毒症患者合并ARDS的Logistic回归模型,以是否发生ARDS为因变量(赋值:0=否,1=是),年龄(连续性变量)、脓毒症类型(赋值:1=严重脓毒症,2=脓毒症休克)、肺部感染(赋值:0=否,1=是)、合并急性肾损伤(赋值:0=否,1=是)、脏器功能衰竭个数(赋值:1=<2个,2=≥2个)、APACHE Ⅱ评分(连续性变量)为自变量,逐步法排除无关变量(入α=0.05,出α=0.10),校正年龄、性别、基础疾病等混杂因素,最终肺部感染,APACHE Ⅱ评分、HMGB1、ESM-1 水平与脓毒症并发ARDS有关(P均<0.01),见表2。
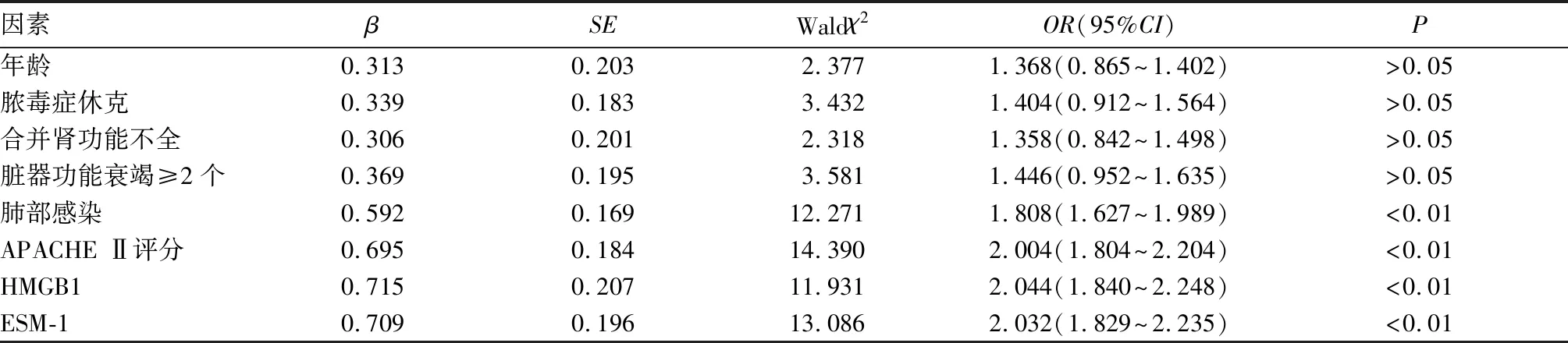
表2 影响脓毒症患者合并ARDS的Logistic回归分析
2.4 血清HMGB1、ESM-1水平预测脓毒症患者合并ARDS的价值 血清HMGB1、ESM-1 、HMGB1+ESM-1 水平预测脓毒症患者合并ARDS的ROC曲线下面积(AUC)分别为0.754、0.651、0.921,P均<0.05。HMGB1+ESM-1预测脓毒症患者合并ARDS的AUC高于单独HMGB1、ESM-1(Z分别为2.435、2.965,P均<0.05)。血清HMGB1、ESM-1、HMGB1+ESM-1预测脓毒症患者合并ARDS的效能见表3。

表3 HMGB1、ESM-1、HMGB1+ESM-1预测脓毒症患者合并ARDS的效能
3 讨论
脓毒症是临床常见的急危重症,随着人口老龄化、肿瘤发病率增加、侵入性操作增加,我国脓毒症发病率和病死率呈逐年上升趋势[8]。脓毒症可导致多器官受累,其中ARDS是脓毒症常见并发症,患者病死率高,早期预测ARDS的发生对临床治疗指导、病情评估有重要意义。
HMGB1是一种DNA结合蛋白,存在于多数组织细胞核中,在细胞内通过与DNA结合发挥调节基因转录、稳定细胞结构功能。当细胞损伤时炎症介质被激活,HMGB1通过活化主动分泌或坏死细胞被动释放形式从细胞核中进入外周血循环,发挥刺激炎症反应、趋化、调节免疫应答、代谢等功能,活化HMGB1具有较强致炎性,被认为是炎症瀑布反应的启动子[10]。HMGB1异常激活参与急性肺损伤[11]发病过程,但是否参与脓毒症所致ARDS过程鲜见报道。本研究结果显示,ARDS组血清HMGB1水平高于NARDS组和对照组,HMGB1水平升高是脓毒症患者并发ARDS的危险因素,说明HMGB1介导的炎症反应参与了脓毒症患者肺组织损伤过程。研究显示,脓毒症合并ARDS小鼠模型中发现HMGB1、IL-6、IL-10等炎性因子表达升高[12]。HMGB1参与脓毒症并发ARDS的可能机制:脓毒症患者机体强烈炎性反应导致HMGB1大量释放,HMGB1可能通过延迟中性粒细胞凋亡参与脓毒症大鼠ARDS发病过程[13];HMGB1通过与受体晚期糖基化终产物受体、Toll样受体结合激活活化核因子-κB通路,诱导氧化应激反应,加剧炎症反应,介导肺损伤过程[14]。
ESM-1是一种硫酸皮肤素黏蛋白,表达于肺动脉、肺泡毛细血管内皮细胞、支气管和黏膜上皮细胞,具有广泛生物学活性,参与胚胎发育、损伤修复、炎症反应、血管形成等病理生理过程[15]。炎症反应中ESM-1通过直接与白细胞表面整合素细胞功能相关抗原结合阻止白细胞向炎症部位迁移浸润,并抑制白细胞与内皮细胞间黏附作用,减轻炎症反应损伤。脓毒症早期,在细菌脂多糖刺激下,内皮细胞产生大量白细胞介素,刺激ESM-1表达和分泌,血清ESM-1水平对脓毒症诊断优于C反应蛋白和降钙素原[16]。研究显示,ESM-1与急性肺损伤发病有关[5]。本研究结果显示,脓毒症患者血清ESM-1水平高于对照组,ESM-1是否参与脓毒症并发ARDS尚待探讨。另外,ARDS组血清ESM-1水平高于NARDS组,说明ESM-1参与脓毒症肺损伤过程,机制为脓毒症炎症级联反应导致气道大量细胞因子、趋化因子、免疫细胞产生,共同作用下导致肺血管内皮细胞损伤,分泌ESM-1,以发挥保护肺组织作用,避免大量激活白细胞迁移黏附造成多脏器功能障碍。因此,ESM-1的升高被认为与脓毒症患者预后不良有关[5]。
本研究ROC曲线分析结果显示,血清HMGB1、ESM-1水平预测脓毒症患者并发ARDS的AUC分别为0.754、0.651,说明HMGB1、ESM-1水平升高对脓毒症ARDS的发生有一定警示意义,但灵敏度尚不理想,联合HMGB1、ESM-1提高了预测效能,AUC均大于单独HMGB1、ESM-1诊断,说明HMGB1、ESM-1水平均升高者肺部损伤更严重,并发ARDS的可能性更大,对临床风险评估更具指导意义。本研究Logistic回归分析结果显示,肺部感染、APACHE Ⅱ评分与脓毒症患者并发ARDS关系密切,APACHE Ⅱ评分是评估危重病患者预后的常用敏感指标,与重症患者病死率密切相关,脓毒症并发肺部感染是导致ARDS的直接因素,因此与脓毒症患者ARDS风险有关。
综上所述,脓毒症合并ARDS患者血清HMGB1、ESM-1水平升高,高水平HMGB1、ESM-1 是脓毒症患者并发ARDS的危险因素之一。HMGB1、ESM-1可作为脓毒症患者并发ARDS预测的参考指标。
