毛花猕猴桃叶中AE的含量测定方法建立及提取纯化工艺研究
2020-11-10王永红王雪莹彭世陆禹奇男李红亮
王永红 王雪莹 彭世陆 禹奇男 李红亮

[摘要]目的 建立毛花獼猴桃叶中2α,3α,24-三羟基-12-烯-28-乌苏酸(AE)的检测方法并考察提取纯化工艺。方法 以AE为对照品,利用高效液相色谱(HPLC)结合蒸发光散射检测器(ELSD),建立AE的含量测定方法;采用单因素及正交试验,考察最佳提取工艺;采用单因素实验,考察最佳纯化工艺。结果 建立了稳定可行的AE含量测定方法,并测定了5个不同产地的猕猴桃叶中AE的含量,发现不同产地之间含量差异较大;考察得出最佳提取工艺为:用70%乙醇提取2次,第1次15倍量提取2 h,第2次10倍量提取1 h;最佳纯化工艺为:将提取液浓缩至0.50 g生药/ml,浓缩液静置8 h后,弃去上清液,取沉淀,加入30%乙醇至浓度为0.50 g生药/ml,充分搅拌,再静置8 h,弃去上清液,取沉淀,加入适量石油醚(60-90)充分洗涤。最终得到的AE中间体平均含量为36.25%,从药材到中间体的得率也达到55.96%。结论 本实验建立的含量测定方法稳定可行,可用于猕猴桃叶中AE的含量测定;优选出的工艺操作简单可行、重复性好,可推广于工业化大生产。
[关键词]毛花猕猴桃叶;2α,3α,24-三羟基-12-烯-28-乌苏酸;含量测定;提取工艺;纯化工艺
[中图分类号] R917 [文献标识码] A [文章编号] 1674-4721(2020)9(a)-0018-05
[Abstract] Objective To establish the method for determination of 2α,3α,24-trihydroxyurs-12-en-28-oic acid (AE) from the leaves of Actinidia eriantha Benth., and optimize the extraction and purification process. Methods The content determination method of AE was established by high performance liquid chromatography-evaporative light-scattering detector (HPLC-ELSD) using AE as reference substance. The optimal extraction process was researched by single factor test and orthogonal test. The optimal purification process was researched by single factor test. Results The stable content determination method of AE was established, and it was found that the content of AE in Actinidia eriantha Benth. leaves from 5 different habitats was quite different. The optimal process of the extraction was as follows: extraction for 2 hours with 15-fold 70% ethanol in the first time, and extraction for 1 hour with 10-fold 70% ethanol in the second time. The optimal purification process was as follows: concentrating the extract to 0.50 g crude drug/ml, discarding the supernatant after sit for 8 hours, adding 30% ethanol into the sediment to let the concentration become 0.50 g crude drug/ml, and stirring thoroughly, discarding the supernatant after sit for 8 hours again, adding the appropriate amount of petroleum ether (60-90) into the sediment, and washing thoroughly. The average content of AE intermediate was 36.25%, and the yield from medicinal materials to intermediates also reached 55.96%. Conclusion The method established in this experiment is stable and feasible, and can be used for the determination of AE in Actinidia eriantha Benth. leaves, the optimized process is simple, stable and repeatable, which is suitable for industrial production.
[Key words] Leaves of Actinidia eriantha Benth.; 2α,3α,24-trihydroxyurs-12-en-28-oic acid; Content determination; Extraction process; Purification process
毛花猕猴桃(Actinidia eriantha Benth.)为猕猴桃科猕猴桃属植物。《中药大辞典》[1]《福建中草药》[2]《浙江民间常用草药》[3]记载其多个功效,如:清热利湿、活血消肿、解毒、舒筋活血,可以治疗胃癌、鼻咽癌、乳癌等。其作为浙江地区少数民族畲族特有的畲药,在畲族中被广泛用于肿瘤治疗[4]。毛花猕猴桃含有三萜[5-7]、黄酮[8]、多糖[9]等成分,其中三萜类化合物是其抗肿瘤作用的主要活性成分之一[4,10-13]。
现代研究中主要是从毛花猕猴桃的根中提取得到三萜类化合物[14-15],而从叶中提到三萜类化合物的研究却罕有报道。但猕猴桃根的采收是一次性的,而叶的采收却可以做到源源不断,且两者本就是同根同源,所含化学成分也类似,特别是三萜类化合物。毛花猕猴桃叶中同样含有大量三萜类化合物,2α,3α,24-三羟基-12-烯-28-乌苏酸(AE)便是其中之一,研究表明,AE具有明显的抗肿痛活性[16-17]。AE在叶中的含量达到了1.15%,可以作为猕猴桃叶中三萜类化学物的指标性成分。因此,从药材资源方面考虑,可加强对猕猴桃叶的研究,争取在某些研究领域可以取代猕猴桃根。
本实验拟建立AE的高效液相色谱结合蒸发光散射检测器(HPLC-ELSD)测定方法,并采用单因素及正交试验对AE的提取工艺及纯化工艺进行系统性研究。
1仪器与试剂
Millipore Synergy超纯水系统(美国密理博公司);METTLER AE240型电子分析天平(梅特勒-托利多仪器有限公司);JA2003N电子天平(上海精密科学仪器有限公司);KQ-500DE型数控超声波清洗器(昆山市超声仪器有限公司);Agilent 1100高效液相色谱仪(Agilent公司);Alltech ELSD-6000A蒸发光散射仪(美国奥泰公司);WSK-A全自动空气源(天津津分分析仪器有限公司)。甲醇为色谱纯,水为超纯水,其余试剂均为分析纯。
毛花猕猴桃叶药材购于浙江、福建等地(表1),经重庆中药研究院罗维早研究员鉴定为猕猴桃科猕猴桃属Actinidia eriantha Benth.的干燥叶。
AE对照品为自制,经面积归一化法计算,纯度>98%。AE对照品制备方法:取5 kg毛花猕猴桃叶,加70%乙醇充分提取,提取液浓缩后利用硅胶柱色谱以二氯甲烷-甲醇为洗脱系统进行初步分离,再利用葡聚糖凝胶色谱及重结晶得到单体,经高分辨质谱及核磁共振技术鉴定为2α,3α,24-三羟基-12-烯-28-乌苏酸。
2 AE的HPLC-ELSD含量测定方法建立
2.1色谱条件及系统适用性实验
色谱柱:Agilent TC-C18(2)柱(4.6 mm×250 mm,5 μm);流动相:甲醇-水(甲醇比例为0~6 min:73%~75%;6~10 min:75%;10~11 min:75%~90%;11~20 min:90%~100%;20~30 min:100%),流速:l.0 ml/min;检测器:ELSD;柱温:40℃,进样量:20 μl。在上述色谱条件下分析,AE色谱峰与相邻的色谱峰分离度均>1.5,理论塔板数按AE计算不低于5000,色谱图见图1。
2.2对照品溶液的制备
精密称取AE对照品(10.31 mg),用73%甲醇(与液相流动相的初始浓度保持一致)溶解并稀释至25 ml量瓶中,配成0.4124 mg/ml的溶液,即得对照品溶液,冷藏备用。
2.3供试品溶液的制备
取粉碎后过3号筛的猕猴桃叶样品约1 g,精密称定,加入25 ml 95%乙醇超声提取2次,每次30 min,合并提取液,减压浓缩至干,用73%甲醇溶解并定容至50 ml容量瓶中,即得供试品溶液。
2.4线性关系
分别精密吸取AE对照品溶液1.0、2.0、3.0、4.0、5.0 ml置5 ml量瓶中,用73%甲醇稀释至刻度,摇匀,配成0.082 48、0.164 96、0.247 44、0.329 92、0.412 40 mg/ml系列标准溶液,进样20 μl测定。以AE对照品溶液质量浓度(μg/ml)为横坐标,峰面积为纵坐标进行回归分析,得回归方程:Y=15 465X-1245(R2=0.9999),线性范围82.48~412.40 μg/ml。
2.5精密度试验
2.5.1重复性考察 取猕猴桃叶样品适量,按“2.3”项下方法制备供试品溶液6份,进样20 μl,测定峰面积,计算含量,结果显示,样品中AE平均含量为1.15%,RSD为1.31%,表明重复性良好。
2.5.2不同人员精密度考察 取猕猴桃叶样品,由3个不同的工作人员,分别按“2.3”项下方法制备供试品溶液2份,进样20 μl,测定峰面积,计算含量,结果显示,人员变动制备的精密度RSD为1.64%,表明不同人员制备的精密度良好。
2.5.3不同日期精密度考察 取猕猴桃叶样品,在不同的工作日内,分别按“2.3”项下方法制备供试品溶液2份,进样20 μl,测定峰面积,计算含量,考察不同日期精密度,结果显示,两者日间精密度RSD为1.89%,表明日间精密度良好。
2.5.4不同仪器精密度考察 取猕猴桃叶样品,在不同的仪器(仪器型号均为Agilent 1100 HPLC仪与Alltech ELSD-6000A蒸發光散射仪)上,按“2.3”项下方法制备供试品溶液2份,进样20 μl,测定峰面积,计算含量,考察不同仪器的精密度,结果显示,仪器变动的精密度RSD为1.85%,表明不同仪器精密度良好。
2.6稳定性试验
取猕猴桃叶样品,按“2.3”项下方法制备供试品溶液2份,于不同的时间间隔(0、4、8、12、16、20、24 h),分别精密吸取20 μl,按“2.1”项下色谱条件,注入液相色谱仪,记录峰面积。结果表明,供试品溶液室温下密闭保存,存放24 h,AE保留时间及峰面积RSD分别为0.49%、1.86%,表明稳定性良好。
2.7加样回收率试验
取已知含量(1.15%)的猕猴桃叶样品适量,精密称取9份,分别加入适量AE对照品,按“2.3”项下方法制备供试品溶液,按“2.1”项下色谱条件,注入液相色谱仪,记录峰面积,计算加样回收率,结果如表2,计算公式如下:回收率(%)=[测得量(mg)-样品量(mg)]/加入量(mg)×100%。
2.8样品含量测定
取5批来自不同产地的毛花猕猴桃叶,每批平行称取2份,按“2.3”项下方法制备供试品溶液,按“2.1”项下色谱条件,注入液相色谱仪,记录峰面积,计算不同产地毛花猕猴桃叶中AE的含量,结果见表3。
3结果与讨论
3.1提取工艺考察
3.1.1提取溶媒考察 取已知含量(1.15%)的猕猴桃叶药材,由于AE的极性较大,故从50%浓度的乙醇开始考察。分别选择15倍量乙醇浓度为50%、60%、70%、80%、90%的溶媒回流提取3次,每次2 h,测定AE得率及转移率,具体见表4。结果显示,AE的得率与乙醇浓度成正比,但乙醇浓度达到70%以上后AE的得率增加较小,因此从生产成本及安全性考虑选择65%、70%、75%乙醇作为正交试验所选溶剂范围。
3.1.2浸泡时间考察 取猕猴桃叶药材适量,加入15倍量70%乙醇,每隔5 min观察浸泡情况,15 min时药材已基本浸泡完全。
3.1.3饱和溶媒吸附量考察 取猕猴桃叶药材5 g,精密称定,加入20倍量70%乙醇,浸泡30 min,过滤剩余溶媒,体积差为24 ml,约为药材的5倍量,故在正交试验中以5倍量作为递减值。
3.1.4正交试验考察提取工艺 根据“3.1.1~3.1.3”的考察结果及实际情况,确定正交试验考察的因素为提取乙醇浓度(%,A)、提取溶媒倍量(倍,B)、提取次数(次,C)、提取时间(h,D),按L9(34)正交表设计试验,以AE的转移率为考察指标,优选最佳提取工艺,因素水平表见表5,正交设计试验结果见表6,方差分析结果见表7。
正交试验直观分析与方差分析结果显示,对试验结果影响程度依次为A>C>B>D,其中因素A对提取结果有显著影响,故最佳提取工艺为用20倍量70%乙醇提取3次,每次2 h。但是提取时间、提取次数及溶剂倍数均对提取结果没有显著影响,且K值都相差不多,从工业化大生产方面考虑为节约成本,可選择70%乙醇提取2次,第1次15倍量提取2 h,第2次10倍量提取1 h。
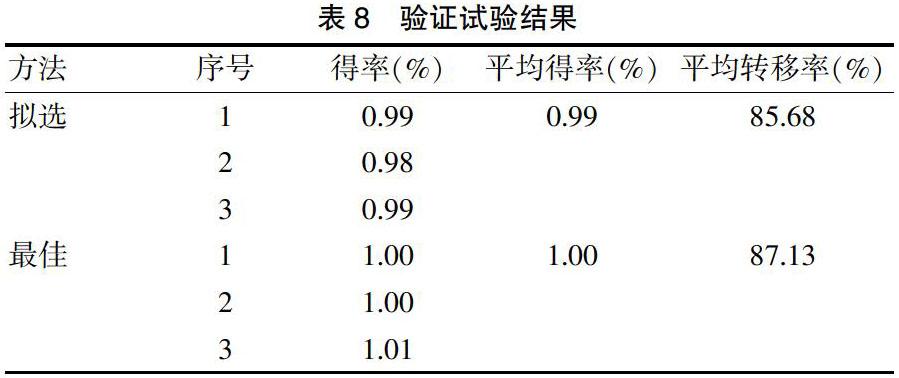
3.1.5拟选与最佳 取猕猴桃叶药材6份,每份100 g。按拟选与最佳工艺分别平行提取3份,测定AE得率及转移率,具体见表8。结果显示,拟选工艺与最佳工艺相比,AE的得率及转移率均无明显减少,提取率都达到了85%以上。相比最佳工艺,拟选工艺更适合于工业化生产。
3.2纯化工艺考察
在前期研究中发现由于猕猴桃叶的提取液富含大量的叶绿素类极容易被大孔树脂吸附且难以解吸附的成分,对树脂伤害极大,且大孔树脂的纯化效果不理想,故选择采用溶剂沉淀法进行纯化。
3.2.1猕猴桃叶提取液制备 取猕猴桃叶药材适量,加入70%乙醇提取2次,第1次15倍量提取2 h,第2次10倍量提取1 h,合并2次提取液,浓缩至无醇味。
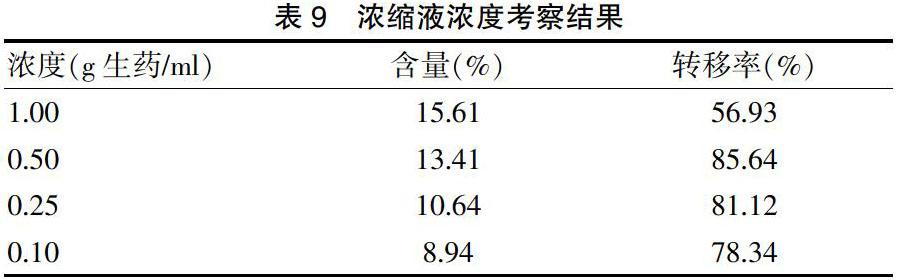
3.2.2浓缩液浓度考察 取适量猕猴桃叶提取液,分别浓缩至1.00、0.50、0.25、0.10 g生药/ml,浓缩液静置过夜后,弃去上清液,测定沉淀中AE的含量,计算转移率,具体见表9。结果显示,浓缩液浓度为1.00 g生药/ml时虽然AE的含量最高,但转移率却很低,说明损失较大。而浓缩液浓度为0.50 g生药/ml时AE转移率较高且含量也较高,故选择浓缩液浓度为0.50 g生药/ml。
3.2.3醇沉液乙醇浓度考察 猕猴桃叶在经过醇提水沉后,虽然已经将大部分水溶性杂质去掉,但一些极性中等的杂质如黄酮类成分还未除去,故还需再加入低浓度乙醇将这部分杂质去掉。
取猕猴桃叶提取液,浓缩至0.50 g生药/ml,浓缩液静置过夜后,弃去上清液,取沉淀,分别加入20%、30%、40%、50%乙醇至浓度为0.50 g生药/ml,充分搅拌,静置8 h后,弃去上清液,测定沉淀中AE的含量及转移率,具体见表10。结果显示,随着乙醇浓度的增加,AE含量也逐渐增加,但转移率却逐渐降低,乙醇浓度为30%时含量及转移率都较高,故选择醇沉液乙醇浓度为30%。
3.2.4醇沉液用量考察 取猕猴桃叶提取液,浓缩至0.50 g生药/ml,浓缩液静置过夜后,弃去上清液,取沉淀,分别加入30%乙醇至浓度为1.00、0.50、0.25、0.10 g生药/ml,充分搅拌,静置8 h后,弃去上清液,测定沉淀中AE的含量及转移率,具体见表11。结果显示,当加入30%乙醇至浓度为1.00 g生药/ml时含量较低,而另外三组含量及转移率均差别不大,为节省溶剂用量,选择醇沉液用量为加入30%乙醇至浓度为0.50 g生药/ml。
纯化工艺进行到这一步已将大部分杂质去除,但一些极性很小、黏性极大的成分如叶绿素类还未除去,从而导致沉淀极难干燥。因此最后加入适量石油醚(60-90)充分洗涤至石油醚液颜色接近澄清,从而将这部分杂质去掉。
3.2.5纯化工艺验证 取3份猕猴桃叶,每份100 g,加入70%乙醇提取2次,第1次15倍量提取2 h,第2次10倍量提取1 h,合并2次提取液,滤液浓缩至0.50 g生药/ml,浓缩液静置8 h后,弃去上清液,取沉淀,加入30%乙醇至浓度为0.50 g生药/ml,充分搅拌,再静置8 h,弃去上清液,取沉淀,加入适量石油醚(60-90)充分洗涤,测定沉淀中AE的含量及得率,具体见表12。结果显示,纯化工艺稳定、合理、可行,适合于工业化大生产。最终得到的中间体AE平均含量为36.25%,从药材到中间体的得率也达到55.96%。
4小结与展望
本实验以AE为指标成分,利用HPLC-ELSD建立了猕猴桃叶中AE的含量测定方法,该方法稳定可行。利用该方法测定了5个不同产地的猕猴桃叶中AE的含量,结果显示,不同产地之间含量差异较大,含量最高的是丽水市达到了1.15%,而含量最低的是温州永嘉县仅为0.55%,后续应收集更多产地的猕猴桃叶进行对比研究,以此确定一个或多个最佳产地。
本实验考察得到了最佳提取及纯化工艺。通过提取纯化得到的中间体AE平均含量为36.25%,从药材到中间体的得率也达到55.96%。经本实验优化得到的猕猴桃叶提取及纯化工艺在保证得率的同时兼顾简便、耗能低、工艺稳定可行等优点,更利于工业化大生产。且中间体中主要含三萜类成分,为后续的药理、毒理以及制剂研究提供坚实的基础。
[参考文献]
[1]江苏新医学院.中药大辞典[M].上海:上海科学技术出版社,1977,440.
[2]福建省医药研究所.福建中草药(第一册)[M].福建:福建省新华书店出版社,1970,575.
[3]浙江省革命委员会生产指挥组卫生局.浙江民间常用草药[M].杭州:浙江人民出版社,1970,54.
[4]郭辉辉.毛花猕猴桃氯仿层单体化合物分离及其抗肿瘤作用机制研究[D].杭州:浙江理工大学,2013.
[5]黄初升,张壮鑫,李干孙,等.毛花猕猴桃中的两个新三萜化合物[J].云南植物研究,1988,10(1):93-100.
[6]黄初升,陈希慧.毛花猕猴桃根中的一个新三萜化合物[J].天然产物研究与开发,1992,4(3):27-30.
[7]白素平,黄初升,陈希慧.毛花猕猴桃三萜化学成分的研究[J].天然产物研究与开发,1997,9(1):15-18.
[8]郑燕枝,李仁强,吴建国,等.毛花猕猴桃总黄酮的超声提取工艺[J].福建中医药大学学报,2012,22(3):50-51.
[9]Xu HS,Wu YW,Xu SF,et al.Antitumor and immunomodulatory activity of polysaccharides from the roots of Actinidia eriantha[J].J Ethnopharmacol,2009,125(2):310-317.
[10]林水花,吴建国,谢通,等.毛花猕猴桃不同部位的抗肿瘤活性比较[J].福建中医药大学学报,2013,23(1):46-47.
[11]张家敏,张骋,王鹏.白藤梨根体外抗肿瘤作用部位筛选及总三萜含量测定[J].中国现代应用药学,2019,36(10):1232-1235.
[12]Zhang D,Gao C,Li R,et al.TEOA,a triterpenoid from Actinidia eriantha,induces autophagy in SW620 cells via endoplasmic reticulum stress and ROS-dependent mitophagy[J].Arch Pharm Res,2017,40(5):579-591.
[13]Wu JG,Ma L,Lin SH,et al.Anticancer and anti-angiogenic activities of extract from Actinidia eriantha Benth root[J].J Ethnopharmacol,2017,203:1-10.
[14]林水花,吳锦忠,吴建国.毛花猕猴桃根中总三萜成分纯化工艺研究[J].海峡药学,2017,29(5):29-32.
[15]易骏,吴建国,郑燕枝,等.正交设计法优化毛花猕猴桃根三萜超声提取工艺[J].海峡药学,2018,30(3):6-8.
[16]卢泳庄.毛花猕猴桃根活性部位与活性成分制备及其抗肿瘤活性研究[D].杭州:浙江大学,2015.
[17]宫明华,李瑶函,薛玲,等.HPLC测定毛花猕猴桃根中活性成分2α,3α,24-三羟基-12-烯-28-乌苏酸的含量[J].中国药学杂志,2016,51(14):1219-1223.
(收稿日期:2020-04-02)
