同种异体移植方法小鼠子宫内膜异位症纤维化模型的建立
2020-11-10常翔宇邓梦琪张艳芹吴迪苗劲蔚
常翔宇 邓梦琪 张艳芹 吴迪 苗劲蔚
[摘要] 目的 探讨利用同种异体移植,建立子宫内膜异位症纤维化小鼠模型的可行性。 方法 将36只BALB/c小鼠随机分为实验组、对照组、供体组,每组12只小鼠。供体组小鼠摘取子宫角,剪碎制成子宫组织悬液,实验组腹腔注射子宫组织悬液,对照组注射等量磷酸盐缓冲液。注入子宫组织悬液第7、14天,开腹观察模型是否成功并进行病理验证。 结果 注入子宫组织悬液第14天,实验组建模成功且纤维化特征明显。 结论 同种异体移植方法能够成功构建鼠子宫内膜异位症纤维化模型。
[关键词] 子宫内膜异位症;纤维化;移植;鼠模型
[中图分类号] R711.71 [文献标识码] A [文章编号] 1673-7210(2020)09(a)-0015-04
[Abstract] Objective To explore the feasibility of using allogeneic transplantation to establish a mouse model of endometriosis. Methods Thirty-six BALB/c mice were randomly divided into experimental group, control group and donor group, with 12 mice in each groups. The uterine horn was extracted from donor group and cut into pieces to make the uterine tissue suspension. Experimental group was intraperitoneally injected with uterine tissue suspension, while control group was injected with phosphate buffer solution. On the 7th and 14th days after uterine tissue suspension injected, the success of the model was observed by laparotomy and pathological verification was conducted. Results On the 14th day after uterine tissue suspension was injected, the modeling of experimental group was successful and the fibrosis characteristics were obvious. Conclusion The allogeneic transplantation method can be used to construct mice model of endometriosis fibrosis.
[Key words] Endometriosis; Fibrosis; Transplant; Mice model
子宮内膜异位症(以下简称“内异症”)是育龄期妇女常见的妇科疾病,10%~14%的育龄妇女有痛经、性交困难和不孕症等症状,盆腔疼痛患者和不孕症患者的数量达到35%~50%[1-2]。目前关于内异症发生机制的研究,最被接受的是桑普森假说[3],即月经期子宫内膜组织通过输卵管逆行进入盆腔,附着并侵入腔内的组织和器官。内异症的病变范围较广,复发和侵袭能力较强。病理学特点是异位生长的子宫内膜腺体和间质周围被致密的纤维化组织包绕。过度的纤维化可引起瘢痕、慢性疼痛和组织功能改变,引起痛经、盆腔痛及不孕等临床症状,因此纤维化是该病的核心病理变化。但目前尚未有文献阐明内异症纤维化的形成机制,鉴于人类实验的明显局限性和伦理考虑,目前使用内异症啮齿动物模型来研究疾病的病理生理学要素。因此,建立成熟和适合的动物模型对于研究内异症纤维化发病机制和治疗手段十分重要。本文通过模拟经血逆流,利用同种异体移植的方法[4]建立鼠内异症纤维化动物模型。
1 对象与方法
1.1 实验动物
15~20 g BALB/c鼠36只,雌性,6~8周,购自北京维通利华动物实验中心[实验动物许可证号:SLXK(粤)2004-0011,质量合格证明编号:SCXK(京)20160006]。小鼠饲养设备由国家蛋白质中心动物实验中心提供,12 h明暗交替饲养环境,SPF级标准化环境饲养。本研究经解放军军事医学科学院实验动物中心伦理委员会批准。
1.2 主要仪器与试剂
实验动物手术台(PT100)、脱水机(JJ-12J)、包埋机(JB-P5)、病理切片机(RM2016)均购自Harvard Apparatus公司;正置荧光显微镜(NIKON ECLIPSE C1)、成像系统(NIKON DS-U3)均购自日本NIKON公司;一抗α-平滑肌肌动蛋白(α-SMA)(ab6992,1∶1000),Ⅰ型胶原蛋白(CollagenⅠ)(ab34710,1∶2000),结缔组织生长因子(CTGF)ab6992(ab6992,1∶1000)均购自美国Abcam公司;二抗HRP标记山羊抗兔(GB23303, 1∶500)购自武汉赛维尔生物科技有限公司;DMEM/F12培养液;苏木精染液;伊红染液;戊二醛;75%酒精;95%酒精;亚甲基蓝等。
1.3 动物分组与模型建立
小鼠适应性喂养1周后,按照随机数字表法将其分为实验组、对照组、供体组,每组12只。供体组CO2麻醉处死,在实验动物手术台中解剖,剪取子宫角,磷酸盐缓冲液(PBS)冲洗血迹,并剪碎形成子宫组织悬液。实验组小鼠消毒后以下腹部腹中线脐下为穿刺点,注入0.5 mL子宫组织悬液[5-8],对照组注入等量的PBS。从模型建立日起,两组给予雌激素(苯甲酸雌二醇)30 Fg/kg,1次/3 d,腿部肌内注射诱导内异症形成。
1.4 观察指标及检测方法
定期测两组小鼠的体重,并观察其皮色、饮食、大小便、活动等情况及有无生病、死亡等。第7、14天随机选取两组各6只小鼠进行开腹探查。CO2麻醉处死,采用腹中线切口,大小约3 cm,打开盆腹腔,观察异位病灶的生长情况,包括位置、大小、数目及其与周围脏器的关系、颜色、周围血管生成情况。取异位病灶标本,放入4%多聚甲醛中保存,石蜡包埋切片。
1.4.1 苏木精-伊红(HE) 将切片放入苏木精水溶液中染色数分钟,酸水及氨水中分色,各数秒钟,流水冲洗1 h后入蒸馏水片刻,70%和90%酒精中脱水各10 min,酒精伊红染色液染色2~3 min,染色后的切片纯酒精脱水,二甲苯透明,将已透明的切片滴加拿大树胶,盖上盖玻片封固。待树胶略干,观察。
1.4.2 Masson染色 切片依次经自来水和蒸馏洗涤,Regaud或Weigert苏木精液染5~10 min,充分洗涤,若组织染色过度可用盐酸酒精分化,蒸馏水洗,Masson丽春红酸性复红液5~10 min,2%冰醋酸水溶液浸洗片刻;1%磷钼酸水溶液分化3~5 min,不经水洗,直接用苯胺蓝或光绿液染5 min,0.2%冰醋酸水溶液浸洗片刻,95%酒精、无水酒精、二甲苯透明、中性树胶封固。染色后的组织镜下可见胶原纤维、黏液、软骨呈蓝色(光绿液染色为绿色),胞浆、肌肉、纤维素、神经胶质呈红色,胞核黑蓝色。
1.5 免疫组化
组织抗原修复,滴加BSA孵育30 min。切片上滴加PBS按一定比例配好的一抗,4℃孵育过夜。玻片置于PBS(PH=7.4)中,脱色摇床上晃动洗涤3次,每次5 min。切片稍甩干后在圈内滴加与一抗相应种属的HRP标记的二抗覆盖组织,室温孵育50 min。加CY3试剂,加第二种一抗,加对应HRP标记的二抗,加FITC试剂,切片上滴加PBS按一定比例配好的一抗,切片平放于湿盒(湿盒内加少量水防止抗体蒸发)内4℃孵育过夜。加对应的HRP标记的二抗,加CY5试剂自发荧光淬灭,DAPI复染细胞核,封片。切片于荧光显微镜下观察并采集图像。
1.6 实时荧光定量聚合酶链反应(RT-qPCR)
逆转录试剂盒:TIANScript RT Kit qPCR试剂盒,SYBR FAST qPCR Kit Master Mix(2×) Universal(KK4602,美国KAPA Biosystems);Trizol:invitrogen,氯仿,异丙醇等均购于北京化学试剂厂。提取样本总RNA,取8 μL RNA用1%琼脂糖凝胶进行电泳。将RNA模板、引物、5×RT mix和RNase-free Water溶解并置于冰上备用。反应管中加入20 μL反应体系的第一部分,混匀。65℃孵育5 min,迅速冰浴2~10 min,短暂离心,使管壁上的溶液收集到管底。轻轻吸打混匀,37℃孵育40 min。反应结束后70℃保温10 min。采用荧光定量PCR仪(ABI7500,美国ABI公司),2-△△ct方法进行数据的相对定量分析。
1.7 统计学方法
采用SPSS 17.0统计学软件进行数据分析,组间比较采用LSD-t检验。以P < 0.05为差异有统计学意义。
2 结果
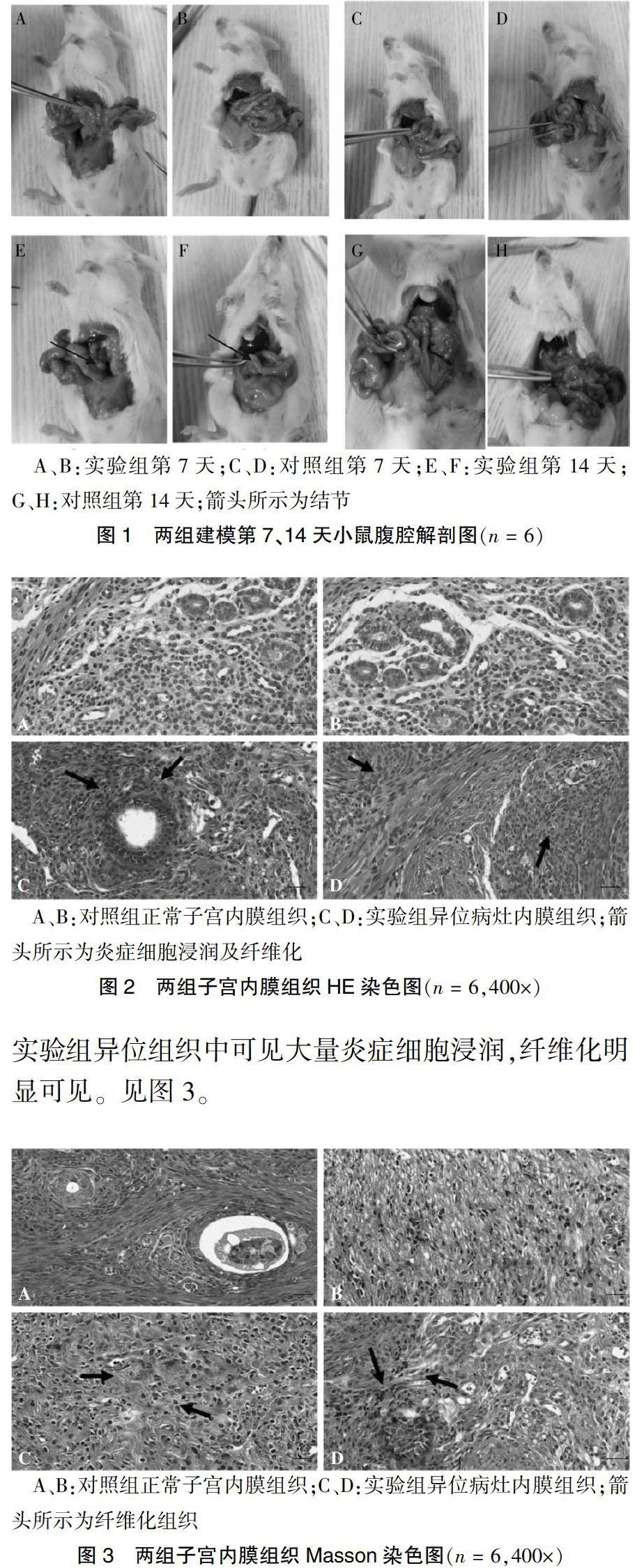
2.1 内异症模型构建的成功率及病灶组织观察
注入子宫组织悬液第7天,实验组小鼠腹腔内未见明显结节形成(图1A、B),对照组小鼠无变化(图1C、D);注入子宫组织悬液第14天,实验组小鼠腹腔内可见小块白色病灶,呈隆起小块状,多附着于肠壁,形成异位结节,质软,与周围组织轻度粘连,但能分离(图1E、F),对照组小鼠无变化(图1G、H)。建模成功率为100%。
2.2 两组组织病理分析结果
2.2.1 HE染色结果 在光镜下观察病理切片,实验组异位组织中子宫内膜样腺体和腺上皮细胞增生活跃,散在间质细胞,腺体边缘大量炎症细胞浸润。见图2。
2.2.2 Masson染色结果 在荧光显微镜下观察结果, 实验组异位组织中可見大量炎症细胞浸润,纤维化明显可见。见图3。
2.3 两组免疫组化结果
免疫组化检测纤维化相关蛋白CTGF、α-SMA、Collagen Ⅰ的表达,可见实验组异位组织中纤维化相关蛋白表达显著。见图4(封三)。
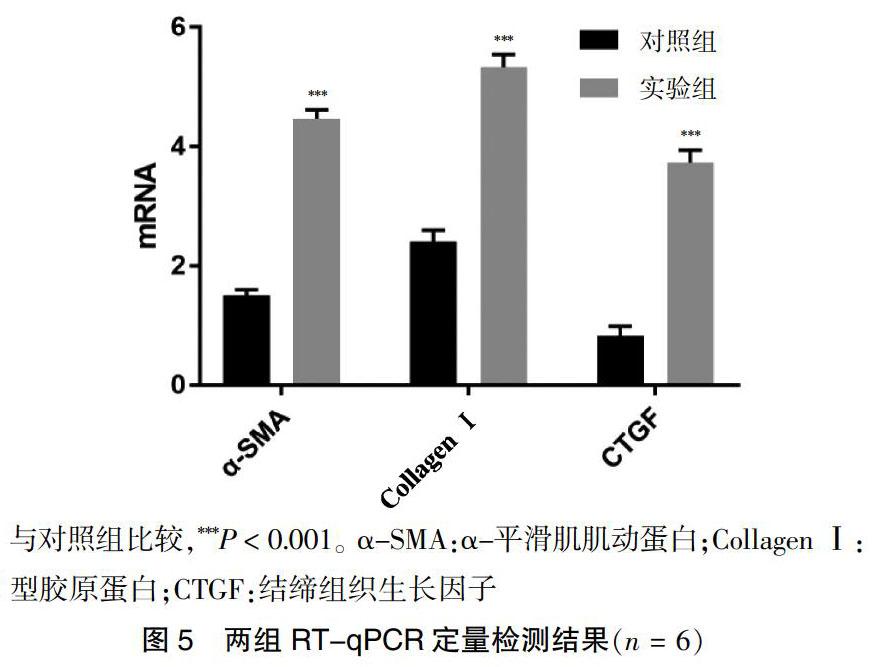
2.4 两组RT-qPCR定量检测结果
实验组α-SMA、Collagen Ⅰ、CTGF水平高于对照组,差异有高度统计学意义(P < 0.01)。见图5。
3 讨论
内异症一般认为是良性疾病,但患者经常遭受慢性盆腔疼痛、性交困难、痛经、生育能力低等痛苦。此外,大多内异症女性还表现出一种或多种合并症,如子宫腺肌病、间质性膀胱炎和炎症性肠病等[9-12]。尽管妇产科学界对该病进行了大量的研究,但仍然不能从根本上解释内异症的发病机制。因此,实验性内异症的各种动物模型的建立,是对该病有更深理解的必经过程。
内异症动物模型的选择以啮齿、灵长类为主,灵长类虽然与人类病理进程更为相似,但其价格昂贵且稀有,难以进行大样本量的实验研究,考虑到动物伦理,故其并不能成为很好的研究对象。啮齿类动物因其价格低廉、饲养方便、来源广泛而最常用。啮齿类动物繁殖能力强,动情周期短而规律,但因其没有内膜脱落,故不能自发形成异位病灶。小鼠作为内异症的动物模型有潜在的优势:首先,腹膜接种子宫碎片更类似于女性逆流经血;第二,供体或受体动物可以在诱导之前进行干预而后进行治疗性研究[13-15]。在啮齿类动物中,裸鼠及SCID小鼠是严重的免疫缺陷小鼠,也是建立内异症模型的理想动物[16]。但随着时间的推移,裸鼠和SCID小鼠免疫功能会逐渐恢复[17-18],严重限制了它的效用。
本實验选用的BALB/c鼠采用同种异体移植/腹腔注射的方法,成功建立了内异症动物模型,并对形成的腹腔结节进行检测及病理分析,病理切片显示纤维化特征明显,同时对纤维化相关蛋白CTGF、α-SMA、Collagen Ⅰ进行免疫组化及RT-qPCR检测,结果显示实验组α-SMA、Collagen Ⅰ、CTGF水平高于对照组,差异有高度统计学意义(P < 0.01)。腹腔注射方法与女性逆行性月经理论更为契合,与裸鼠比较,该类小鼠饲养条件更为宽松,动物存活率更高,一定程度上提高了建模成功率,且无需进行手术操作。造模过程中的手术操作、缝线等异物刺激,可引起炎症反应,而内异症本身是一种慢性炎症性疾病[19-20],因此腹腔注射避免了这一问题。
该方法简便且成功率高,建模周期短,成功避免了手术操作等带来的炎症问题,且异位病灶符合内异症纤维化的病理特点,可作为研究内异症纤维化的简便动物模型。通过同种异体移植模型,可对供体鼠进行基因敲除等预处理,满足纤维化的多种机制研究,在内异症纤维化的研究中广泛应用。
[参考文献]
[1] Falcone T,Flyckt R. Clinical Management of Endometriosis [J]. Obstet Gynecol,2018,131(3):557-571.
[2] Angioni S. New Insights on Endometriosis [J]. Minerva Ginecol Actions,2017,69(5):438-439.
[3] Samspon JEA. Peritoneal endometriosis due to menstrual dissemenation of endometrial tissues into the peritoneal cavity [J]. Am J Obstet Gynecol,1927,14(4):93-94.
[4] Arends MJ,White ES,Whitelaw CBA. Animal and cellular models of human disease [J]. J Pathol,2016,238(2):137-140.
[5] Peterse D,Binda MM,O DF,et al. Of Mice and Women: A Laparoscopic Mouse Model for Endometriosis [J]. J Minim Invasive Gynecol,2018,25(4):578-579.
[6] Ni HJ,Zhang Z,Dai YD,et al. Establishment of endometriosis subcutaneous model in immunodeficient nude mice [J].Zhonghua Yi Xue Za Zhi,2016,96(33):2675-2677.
[7] Greaves E,Cousins FL,Murray A,et al. A novel mouse model of endometriosis mimics human phenotype and reveals insights into the inflammatory contribution of shed endometrium [J]. Am J Pathol,2014,184(7):1930-1939.
[8] Dodds KN,Beckett EAH,Evans SF,et al. Lesion development is modulated by the natural estrous cycle and mouse strain in a minimally invasive model of endometriosis [J]. Biol Reprod,2017,97(6):810-821.
[9] Dara?觔 E,Ploteau S,Ballester M,et al. Pathogenesis, genetics and diagnosis of endometriosis [J]. Presse Med,2017,46(12):1156-1165.
[10] Struble J,Reid S,Bedaiwy MA. Adenomyosis: A clinical review of a challenging gynecologic condition [J]. J Minim Invasive Gynecol,2016,23(2):164-185.
[11] Tirlapur SA,Kuhrt K,Chaliha C,et al. The′evil twin syndrome′ in chronic pelvic pain:a systematic review of prevalence studies of bladder pain syndrome and endometriosis [J]. Int J Surg,2013,11(3):233-237.
[12] Greene AD,Lang SA,Kendziorski JA,et al. Endometriosis:where are we and where are we going?[J]. Reproduction,2016,152(3):R63-R78.
[13] Wei X,Shao X. Nobiletin alleviates endometriosis via down-regulating NF-κB activity in endometriosis mouse model [J]. Biosci Rep,2018,38(3):BSR20180470.
[14] Feng D,Menger MD,Wang H,et al. Luminal epithelium in endometrial fragments affects their vascularization,growth and morphological development into endometriosis-like lesions in mice [J]. Dis Model Mech,2014,7(2):225-232.
[15] Perelló M,González-Foruria I,Castillo P,et al. Oral Administration of Pentoxifylline Reduces Endometriosis-Like Lesions in a Nude Mouse Model [J]. Reprod Sci,2017,24(6):911-918.
[16] Wilson MR,Holladay J,Ronald LC. A Mouse Model of Endometriosis Mimicking the Natural Spread of Invasive Endometrium [J]. Hum Reprod, 2020,35(1):58-69.
[17] Bruner-Tran KL,Mokshagundam S,Jennifer LH,et al. Rodent Models of Experimental Endometriosis:Identifying Mechanisms of Disease and Therapeutic Targets [J]. Curr Womens Health Rev,2018,14(2):173-188.
[18] Porada CD,Sanada C,Kuo CJ,et al. Phenotypic Correction of Hemophilia A in Sheep by Postnatal Intraperitoneal Transplantation of FⅧ-expressing MSC [J]. Exp Hematol,2011,39(12):1124-1135.e4.
[19] 單婧,程雯,翟东霞,等.子宫内膜异位症啮齿类动物模型研究进展[J].生殖医学杂志,2017,26(5):498-501.
[20] 徐妍,何珏.子宫内膜异位症模型大鼠接受米非司酮干预后炎性因子、侵袭和凋亡基因表达的评估[J].海南医学院学报,2017,23(9):1169-1174.
(收稿日期:2019-12-17)
