沉默OIP5对肺腺癌A549细胞迁移侵袭的影响研究
2020-11-10魏明莉何森阳钦毕煜玲黄娜
魏明莉 何森 阳钦 毕煜玲 黄娜
肺癌是发病率和死亡率位居全球最高的恶性肿瘤[1]。肺腺癌是肺癌最常见的病理类型,具有浸润性强、破坏性大的特征,早期即可侵犯血管、淋巴管,常在原发肿瘤引起症状前已发生转移。大部分肺腺癌在确诊时已处于中晚期,失去了最佳治疗时机,无法获得理想疗效,5年生存率约18%[2]。因此,进一步寻找与肺腺癌转移及预后相关的生物标志物对提高肺癌的整体疗效,具有重要的现实意义和临床价值[3]。有文献报道,Opa相互作用蛋白5(Opa interacting protein 5,OIP5)在膀胱癌[4]、胶质母细胞瘤[5]、胃癌[6-7]、结直肠癌[6]、肝癌[8]、乳腺癌[9]、急性髓系白血病[10]等肿瘤的发生发展中起着致癌基因的作用。它可以作为 miRNA的靶基因参与细胞的侵袭、迁移等一系列的调控。研究报道OIP5在肺癌中呈现高表达,与不良预后相关[11],但其具体作用机制尚未完全明确。因此本研究在此基础上,进一步探讨沉默OIP5对肺腺癌A549细胞迁移和侵袭的作用及可能机制。
资料与方法
一、材料
肺腺癌A549细胞株由成都医学院第一附属医院中心实验室惠赠。胎牛血清(FBS)购自美国Thermo Scientific公司。转染试剂lipofectamine2000购置Invitrogen公司。Matrigel基质胶、8μm transwell小室均购置于美国Corning公司。BCA蛋白浓度试剂盒购置碧云天生物技术有限公司。OIP5兔多克隆抗体购自中国Proteintech 公司,β-Actin兔多抗购自美国CST公司,E-Cadherin兔多克隆抗体购自美国CST公司,Vimentin兔多克隆抗体购自英国Abcam公司。山羊抗兔二抗购自武汉博士德公司。OIP5 siRNA、siRNA control质粒由上海吉满生物公司设计提供。
二、细胞培养与转染
肺腺癌A549细胞用含有10% FBS和双抗(100U/mL的青霉素及100μg/mL的链霉素)的DMEM高糖培养基,置于37℃、5% CO2细胞培养箱中常规培养,待细胞汇合度达到40%左右时进行siRNA 转染。OIP5 siRNA、siRNA control质粒具体转染操作按lipofectamine 2000说明书进行。转染48h后,收集细胞用于后续实验。转染 OIP5 siRNA的A549细胞,记为 OIP5 siRNA组,转染siRNA control后的A549细胞记control siRNA组,未做任何处理的A549细胞记为A549组。
三、蛋白质印迹法检测OIP5蛋白水平
收取OIP5 siRNA组、control siRNA组、A549组中细胞各约1×106个,提取总蛋白。按照BCA蛋白浓度试剂盒说明书进行蛋白定量,10% SDS-PAGE凝胶电泳,浓缩胶80V,分离胶120V,100V电压转膜,5%脱脂奶粉室温封闭1h,加入OIP5抗体(1 ∶1 000稀释),4℃过夜。次日TBST洗3次,每次10min,加入β-actin抗体(1 ∶1 000稀释)室温孵育1h,TBST洗3次,每次10min,ECL显色液显影。美国Bio-Rad公司凝胶扫描成像系统成像。目的条带采用ImageJ软件进行灰度值分析。重复3次,取均值。
四、transwell检测迁移及侵袭能力
transwell下室加入650uL含10%FBS的培养基,上室加入细胞悬液100uL,细胞含量约2×104个,置于细胞培养箱中培养48h,将transwell小室置于4%多聚甲醛溶液中,室温固定20min,用0.1%的结晶紫染色10min,用棉签轻柔擦去小室内的细胞,用PBS洗3次,每次洗5min,将小室风干,在显微镜下取5个视野,分别计算每个视野细胞数量,取其平均值,以检测细胞的迁移能力。细胞侵袭与迁移能力检测的方法差不多,在检测细胞侵袭能力之前,将-20℃冰箱中的matrigel基质胶,放置于4℃冰箱中解冻,用无血清培养基以1 ∶8的比例稀释matrigel基质胶,每小室加入45uL稀释后matrigel基质胶,于37℃细胞培养箱中放置约30min,待胶凝固,按迁移能力的步骤进行后续实验。
五、蛋白质印迹法检测E-cadherin、Vimentin 蛋白水平
收取OIP5 siRNA组、control siRNA组、A549组中细胞各约1×106个,提取总蛋白。一抗(1 ∶1000)稀释,采用蛋白质印迹法测定各组细胞内E-cadherin、Vimentin蛋白表达水平,步骤同三。
六、统计学分析

结 果
一、OIP5沉默肺腺癌A549中OIP5表达水平
各组细胞中OIP5蛋白表达水平(如图1)所示,结果发现:与A549组相比,OIP5 siRNA组中的OIP5蛋白表达水平显著下降(t=11.862,P<0.05),control siRNA组中OIP5蛋白表达水平差异无统计学意义(t=1.118,P>0.05)。

图1 蛋白质印迹法检测三组细胞OIP5蛋白表达水平
二、OIP5沉默抑制肺腺癌A549细胞迁移能力
transwell实验结果(如图2)所示,OIP5 siRNA组细胞迁移能力明显弱于control siRNA组、A549组(F=44.168,P<0.05)。而control siRNA组与A549组比较细胞迁移能力差异无统计学意义(t=0.981,P>0.05)。

图2 OIP5沉默抑制A549细胞迁移能力(结晶紫染色×200)
三、OIP5沉默抑制肺腺癌A549细胞侵袭能力
transwell小室及matrigel基质胶实验结果(见图3),OIP5 siRNA组细胞侵袭能力明显弱于control siRNA组、A549组(F=37.883,P<0.05)。而control siRNA组与A549组比较细胞侵袭能力差异无统计学意义(t=0.713,P>0.05)。

图3 OIP5沉默抑制A549细胞侵袭能力(结晶紫染色×200)
四、OIP5沉默抑制肺腺癌A549细胞EMT
蛋白质印迹法检测OIP5 siRNA组、control siRNA组、A549组中E-cadherin和Vimentin表达。结果(如图4)所示,与control siRNA组、A549组比较,OIP5 siRNA组中E-cadherin 蛋白表达明显升高(F=39.787,P<0.05),Vimentin蛋白表达明显减少(F=40.164,P<0.05)。Control siRNA组、A549组之间比较,E-cadherin表达差异无统计学意义(t=0.834,P>0.05),Vimentin表达差异无统计学意义(t=1.181,P>0.05)。
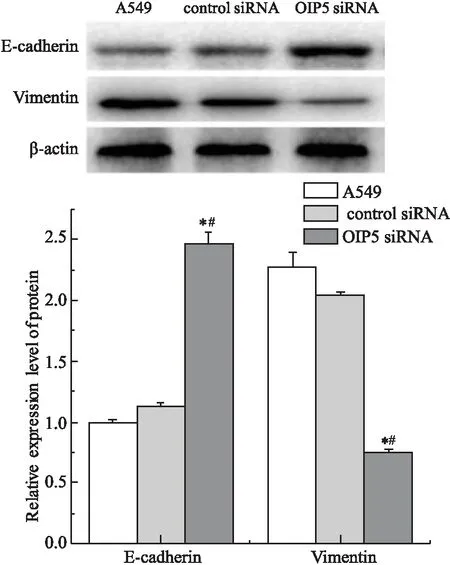
图4 蛋白质印迹法检测 OIP5沉默抑制A549细胞EMT
讨 论
近年来,肺腺癌在基因靶向治疗、肿瘤免疫治疗方面有了突破性的进展,但肺腺癌起病隐匿、进展迅速,早期症状不典型,确诊者多属于晚期患者,其治愈率及生存率仍很低。因此,从分子水平上进一步研究肺腺癌的发病机制,是提高肺癌诊疗水平的当务之急[12]。
OIP5属于癌-睾丸抗原的肿瘤特异性抗原,是一种能够与Opa蛋白相互作用的蛋白编码基因,该基因位于15号染色体上[13]。OIP5表达水平的高低与肿瘤的发生和发展密切相关,研究表明,敲除OIP5基因可抑制肝癌细胞生长和转移,可见肝脏原发性和转移性肿瘤结节减少[8]。敲除OIP5基因,膀胱癌细胞生长、转移明显受抑制[14]。OIP5表达水平与肾透明细胞癌预后呈负相关,沉默OIP5表达,肾透明细胞癌细胞的生长受抑制[15]。文献报道,在肺癌和食管癌患者中OIP5蛋白阳性患者的预后比阴性患者预后差[11],提示OIP5可能作为一个癌基因参与肿瘤发生发展的过程。
肿瘤细胞的转移是肿瘤死亡率高的主要原因,其中迁移、侵袭为转移前提,受多种机制的调控。EMT在肿瘤的侵袭、转移过程中扮演着非常重要的角色,它可以增强肿瘤的侵袭、转移能力,被认为是肿瘤早期扩散、转移的关键事件[16-18]。EMT主要表现为E-钙粘蛋白(E-cadherin)、β-连环蛋白(β-catenin)等上皮标记物的表达下调,而波形蛋白(Vimentin)、N-钙粘蛋白(N-cadherin)、纤连蛋白(Fibronectin)等间质标记物的表达上调,导致上皮细胞失去了它的极性,细胞之间的连接减少,形态接近于成纤维细胞,其粘附力下降、运动及迁移能力增强[19]。Zheng等[20]研究表明,OIP5通过调控JAK2/STAT3信号通路促细胞EMT,促进鼻咽癌细胞转移,而下调OIP5表达,则明显抑制鼻咽癌细胞的EMT、迁移和侵袭。本研究利用RNA干扰技术沉默肺腺癌A549细胞中OIP5表达,用蛋白质印迹法检测A549细胞EMT标志物E-cadherin、Vimentin表达,结果显示沉默OIP5能明显上调E-cadherin的表达,而降低Vimentin的表达,提示沉默OIP5抑制肺腺癌A549细胞EMT的发生;transwell实验结果显示沉默OIP5表达后,迁移、侵袭细胞数明显减少,说明沉默OIP5抑制了A549细胞迁移、侵袭能力。
综上所述,沉默 OIP5的表达可抑制A549细胞迁移、侵袭能力,抑制细胞EMT。OIP5可能通过抑制肺腺癌EMT而抑制其迁移、侵袭能力,这为临床肺腺癌诊治提供新思路,OIP5有望为成为肺腺癌治疗的新分子靶点。目前有关OIP5在肺癌迁移侵袭中所起的作用研究报道很少,其具体机制仍有待进一步研究。
