槲皮素调控AMPK/mTOR通路对肺癌A549细胞自噬的影响①
2020-11-10文兰香覃世运陈丽君
文兰香 覃世运 陈丽君
(海南省第三人民医院肿瘤中心,三亚 572000)
肺癌是发生于支气管黏膜上皮的恶性肿瘤,发病率居男性恶性肿瘤的首位,近年来在女性中发病率也迅速提高,严重危害人类生命健康[1,2]。临床上主要通过外科手术以及化疗治疗肺癌,但持续使用化疗药物会造成骨髓抑制,且易产生耐药性[3]。中药因具有保护骨髓、毒性较小等优势在现代医学研究中占据一定地位,因此寻求毒副作用小、肺癌治疗效果显著的中医药物质成为研究重点之一[4]。槲皮素是在植物中广泛存在的黄酮类物质,研究显示其可能通过影响癌细胞自噬,在抗肿瘤中发挥重要作用[5,6]。自噬是真核细胞中存在的生理现象,是蛋白降解的一种途径,对维持体内环境稳定十分重要,大量研究显示自噬作用与肿瘤发生发展存在密切联系[7]。但槲皮素对肺部肿瘤的作用研究较少,因此本研究初步探讨槲皮素对肺癌A549细胞自噬的影响以及可能的作用机制。
1 材料与方法
1.1材料
1.1.1细胞 人肺癌细胞系A549细胞购自中国科学院细胞库。
1.1.2药物 槲皮素购自美国Sigma公司(纯度≥98%),用0.05 mol/L的NaOH溶液配制成1 mmol/L槲皮素母液,过滤除菌后保存备用,使用前用含10% FBS的RPMI1640培养液稀释至所需浓度。
1.1.3试剂 RPMI1640培养基、10%胎牛血清、胰酶购自Thermo Hyclone公司;CCK-8相关试剂购于美国Sigma公司;蛋白提取试剂盒、BCA试剂盒购自北京全式金生物公司;鼠抗人LC3Ⅰ、LC3Ⅱ、beclin-1、p-AMPK、AMPK、p-mTOR、mTOR、p-S6K、S6K、GAPDH一抗购及二抗(辣根过氧化物酶标记羊抗鼠IgG)购自美国Santa Cruz公司;单丹磺酰尸胺(monodansylcadaverin,MDC)染色试剂盒购自金克隆(北京)生物技术有限公司;其他试剂购自国药集团,均为分析纯。
1.2方法
1.2.1细胞培养 取出冻存A549细胞系快速解冻后,添加PBS洗涤,置于离心机内3 000 r/min离心10 min 弃上清,添加含10%胎牛血清、100 U/ml青霉素-链霉素的RPMI1640培养基4 ml,置于37℃、5% CO2培养箱中培养,待细胞融合至80%时,去上清,PBS洗涤细胞,0.2%胰酶消化后加入培养基传代培养,3代后进行计数。
1.2.2实验分组 取对数生长期A549细胞,用培养基调整细胞浓度为1×104个/ml接种于96孔培养板,100 μl/孔,37℃、5%CO2条件培养。次日进行分组,分为空白对照组:含10% FBS的RPMI1640培养液;槲皮素组:低、中、高剂量组分别加入终浓度为100、150、200 μmol/L槲皮素溶液。
1.2.3CCK-8法检测槲皮素对A549增殖的影响 取1.2.2中各组细胞分别培养24 h、48 h、72 h,每组设6个复孔,加入10 μl CCK-8溶液,培养4 h后用酶联免疫检测仪测定各孔吸光值,并计算细胞增殖抑制率。细胞增殖抑制率=[1-(A药物处理组-A空白孔)/(A未处理组-A空白孔)]×100%。
1.2.4MDC染色法检测槲皮素对A549细胞自噬的影响 取1.2.2中各组细胞,培养48 h后按照MDC染色试剂盒操作说明进行染色,荧光显微镜下观察(激发滤光片波长355 nm,阻断滤光片波长512 nm),计数并拍照。检测到高亮点状荧光代表自噬泡。
1.2.5Western blot检测自噬及AMPK/mTOR通路相关蛋白表达 取1.2.2中各组细胞,培养48 h后加入细胞裂解液裂解细胞,蛋白提取试剂盒提取细胞总蛋白,BCA试剂盒测定细胞总蛋白浓度,经电泳、转模、封闭后,添加(1∶500)鼠抗人LC3Ⅰ、LC3Ⅱ、beclin-1、p-AMPK、AMPK、p-mTOR、mTOR、p-S6K、S6K一抗,以GAPDH为内参,4℃过夜后,添加二抗稀释液孵育2 h,ECL显色后,于凝胶成像仪中观察蛋白表达并保存图像。
1.2.6AMPK抑制剂对自噬的影响 收集1.2.1中细胞,加入10 μmol/L AMPK抑制剂Compound C预孵育2 h后,加入200 μmol/L槲皮素。根据1.2.4中方法检测细胞自噬形态变化,根据1.2.5中方法检测LC3Ⅰ、LC3Ⅱ、beclin-1蛋白及通路AMPK/mTOR相关蛋白表达水平。

2 结果
2.1不同浓度槲皮素对A549细胞增殖抑制影响 CCK8检测显示,与空白对照组比较,检测浓度范围内随着槲皮素浓度的增加(100、150、200 μmol/L),对A549细胞增殖抑制率显著升高,呈浓度依赖关系(P<0.05)。与作用24 h相比,作用48、72 h细胞增殖抑制率显著升高(P<0.05),作用48 h与72 h细胞增殖抑制率差异无统计学意义(P>0.05)。见表1。

表1 槲皮素对A549细胞增殖抑制的影响Tab.1 Effect of quercetin on proliferation inhibition of A549
2.2不同浓度槲皮素对A549细胞自噬的影响 MDC染色显示,空白对照组中仅有A549少量细胞检测到高亮点状荧光,槲皮素作用48 h后,槲皮素组A549细胞中各剂量组检测到高亮点状荧光的自噬泡数量依次增多。见图1。
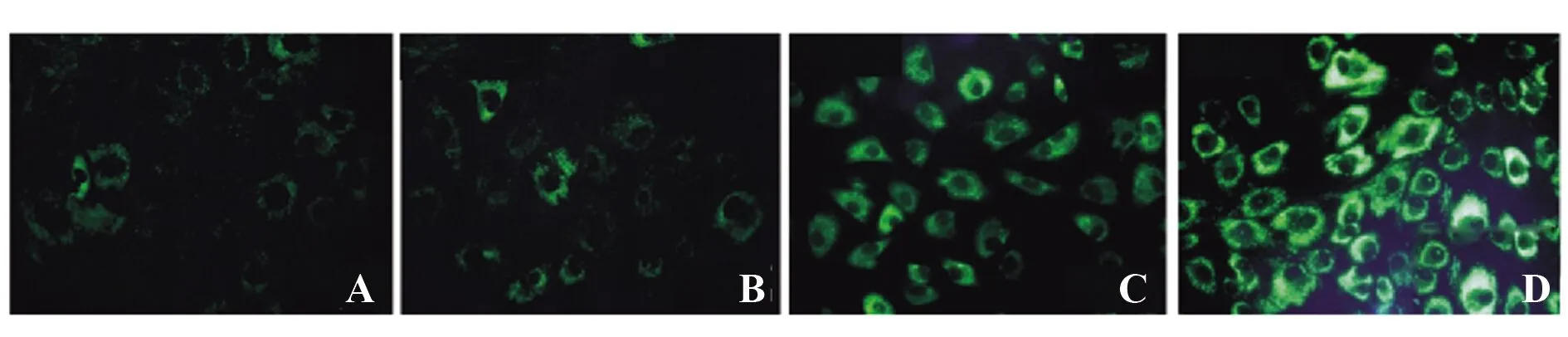
图1 不同浓度槲皮素对A549自噬的影响(×400)Fig.1 Effects of quercetin at different concentrations on autophagy of A549 (×400)Note:A.Blank control group;B.Quercetin low dose group;C.Quercetin medium dose group;D.Quercetin high dose group.
2.3不同浓度槲皮素对A549细胞中自噬相关蛋白表达影响 作用48 h后,与空白对照组相比,槲皮素组各剂量A549细胞中LC3Ⅱ/LC3Ⅰ、beclin-1表达依次升高(P<0.05)。见图2、表2。

表2 不同浓度槲皮素对A549细胞中自噬相关蛋白表达影响Tab.2 Effects of quercetin at different concentrations on expressions of autophagy-related proteins in A549
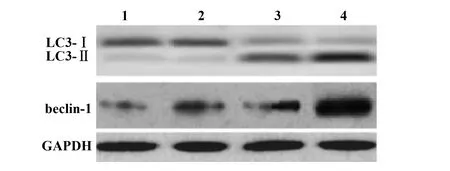
图2 不同浓度槲皮素对A549细胞中自噬相关蛋白表达影响Fig.2 Effects of quercetin at different concentrations on expressions of autophagy-related proteins in A549 cellsNote:1.Blank control group;2.Quercetin low dose group;3.Quercetin medium dose group;4.Quercetin high dose group.
2.4不同浓度槲皮素对A549细胞中AMPK/mTOR通路相关蛋白表达影响 与空白对照组相比,槲皮素组各剂量A549细胞中p-AMPK/AMPK水平依次增加(P<0.05),p-mTOR/mTOR、p-S6K/S6K蛋白表达依次降低(P<0.05)。见图3、表3。

表3 不同浓度槲皮素对A549细胞中AMPK/mTOR通路相关蛋白表达影响Tab.3 Effects of quercetin at different concentrations on expressions of AMPK/mTOR pathway related proteins in A549
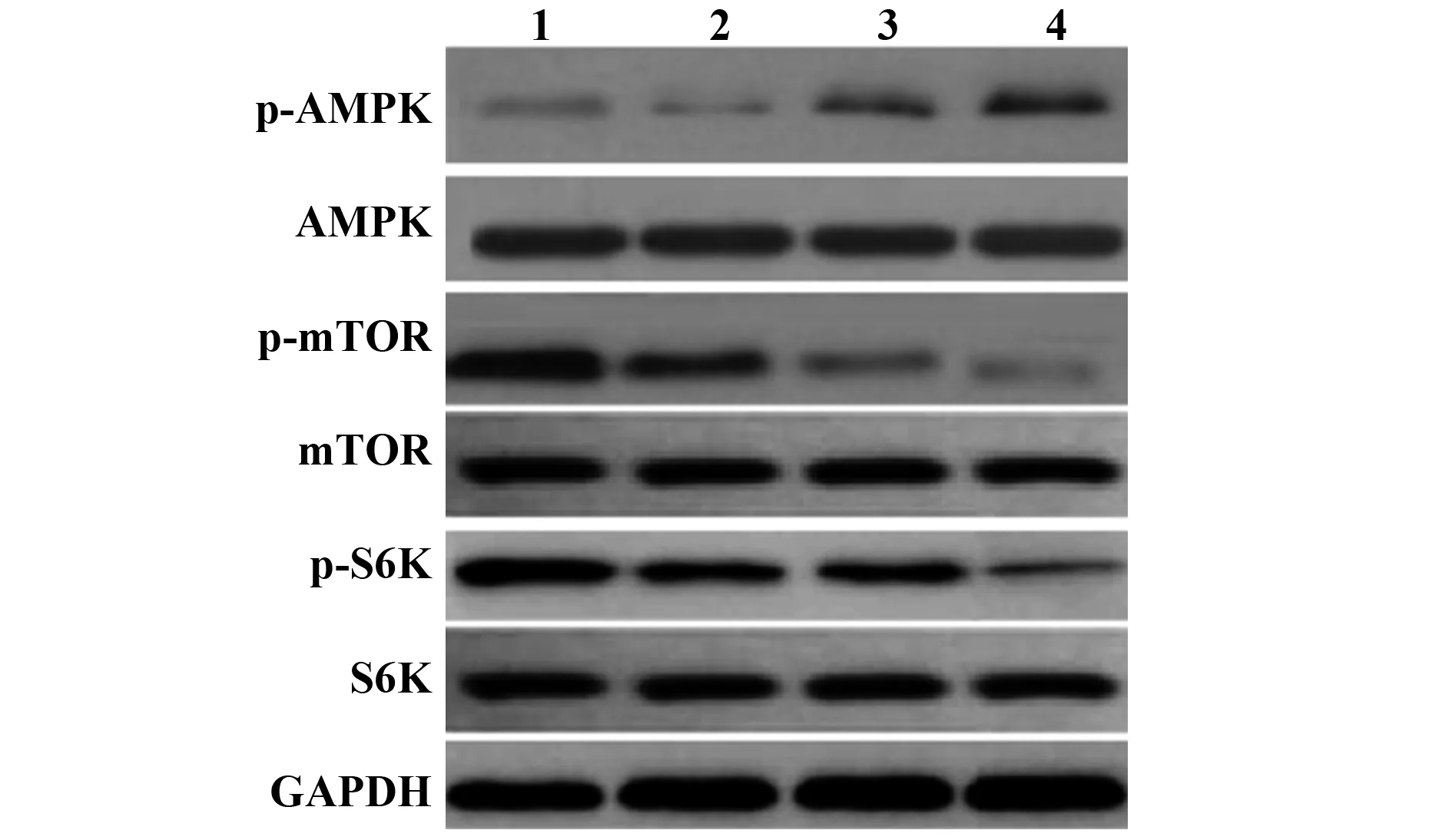
图3 不同浓度槲皮素对A549细胞中AMPK/mTOR通路相关蛋白表达影响Fig.3 Effects of quercetin at different concentrations on expression of AMPK/mTOR pathway-related proteins in A549 cellsNote:1.Blank control group;2.Quercetin low dose group;3.Quercetin medium dose group;4.Quercetin high dose group.
2.5AMPK抑制剂对A549细胞自噬及相关蛋白表达的影响
2.5.1AMPK抑制剂对A549细胞自噬的影响 细胞形态学检测显示,与槲皮素组相比,槲皮素+AMPK抑制剂组A549细胞中高亮点状荧光的自噬泡数量减少。见图4。
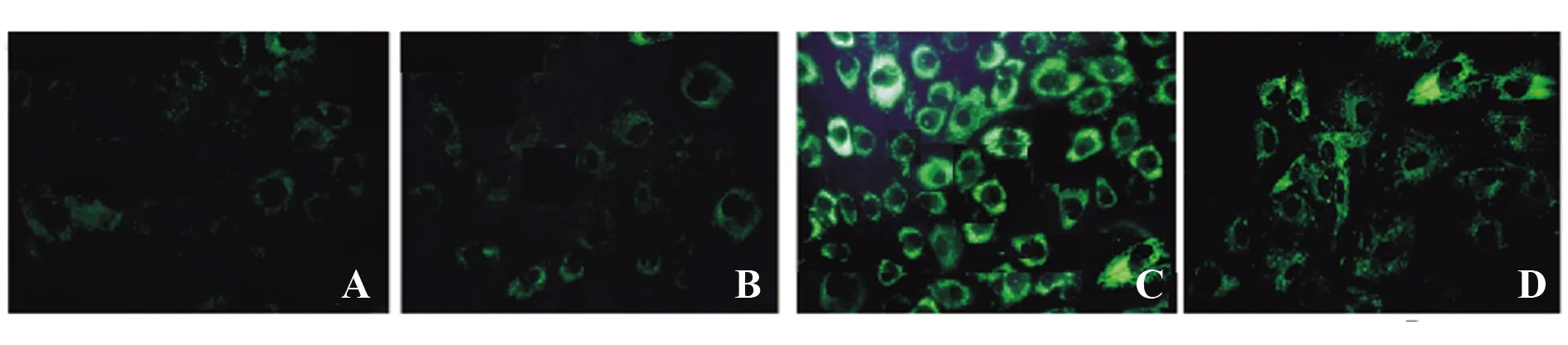
图4 AMPK抑制剂对细胞自噬影响(×400)Fig.4 Effects of AMPK inhibitors on autophagy (×400)Note:A.Blank control group;B.Quercetin low dose group;C.Quercetin medium dose group;D.Quercetin high dose group.
2.5.2AMPK抑制剂对自噬相关蛋白及AMPK/mTOR通路相关蛋白影响 与槲皮素组相比, 槲皮素+AMPK抑制剂组p-AMPK/AMPK、LC3Ⅱ/LC3Ⅰ、beclin-1蛋白表达降低(P<0.05),p-mTOR/mTOR、p-S6K/S6K表达升高(P<0.05)。见图5、表4。

表4 AMPK抑制剂对自噬相关蛋白及AMPK/mTOR通路相关蛋白影响Tab.4 Effects of AMPK inhibitors on autophagy-related proteins and AMPK/mTOR pathway-related

图5 AMPK抑制剂对自噬相关蛋白及AMPK/mTOR通路相关蛋白影响Fig.5 Effects of AMPK inhibitors on autophagy-related proteins and AMPK/mTOR pathway-related proteinsNote:1.Blank control group;2.Quercetin low dose group;3.Quercetin medium dose group;4.Quercetin high dose group.
3 讨论
槲皮素是常见的黄酮类物质,广泛存在于植物花、茎、叶、果实中,多以甙的形式存在,化学分子式为C15H10O7,在止咳、平喘、降压等方面具有重要作用[8]。近年研究发现,其具有阻滞细胞周期、抑制肿瘤细胞传导、诱导肿瘤细胞凋亡等作用,并对乳腺癌、结肠癌有较好的抑制作用[9,10]。本研究显示经槲皮素处理肺癌A549细胞后,细胞增殖抑制率显著升高,且呈剂量依赖性,提示槲皮素可抑制A549细胞增殖。
研究显示,槲皮素可诱导胃癌细胞自噬产生抗肿瘤作用,其与肺癌的发生发展密切相关[11,12]。自噬是吞噬自身蛋白质进入囊泡并依赖溶酶体降解包裹内容物的过程,在机体正常生理及病理过程中均有显示[12]。抗肿瘤药物常通过诱导肿瘤细胞凋亡或自噬发挥治疗作用[13]。Du等[14]研究表明,槲皮素通过诱导胃癌细胞自噬发挥抗肿瘤作用。本研究发现,槲皮素组A549细胞中检测到高亮点状荧光的自噬泡数量随浓度升高而增多,提示槲皮素可促进A549细胞自噬。LC3是自噬过程中标志蛋白,外源物质刺激细胞自噬启动时,胞浆型的LC3Ⅰ分解掉一小段多肽,转化为LC3Ⅱ,参与自噬体膜形成[15]。beclin-1是形成自噬体的必要分子,可介导自噬相关蛋白定位于吞噬泡,并调控自噬体的形成[16]。本研究发现,槲皮素处理后,A549细胞中LC3Ⅱ/LC3Ⅰ表达以及beclin-1水平明显上调,提示槲皮素可促进A549细胞中有自噬体膜及吞噬泡形成。
AMPK-mTOR通路在多种疾病中发挥作用。Long等[17]研究表明,AMPK-mTOR通路与细胞自噬相关。细胞接受外界刺激时,AMP/ATP水平升高,使AMPK活化,增强对AMPK下游mTOR蛋白功能的抑制作用,而mTOR是自噬发生发展的中心蛋白,可调节下游底物S6K磷酸化,抑制细胞自噬[18,19]。肖洁等[20]研究表明,槲皮素通过激活该通路诱导急性髓系白血病HL-60细胞自噬。因此本研究对AMPK-mTOR通路相关蛋白进行研究,结果发现,经槲皮素处理后,A549细胞中AMPK蛋白磷酸化水平剂量依赖性增加,mTOR蛋白磷酸化水平剂量依赖性降低,S6K蛋白磷酸化水平降低,提示槲皮素可能促进AMPK-mTOR通路活化。进一步研究显示,添加AMPK特异性抑制剂Compound C后,A549细胞中高亮点状荧光的自噬泡减少,同时细胞中AMPK蛋白磷酸化水平降低,下游mTOR、S6K磷酸化水平升高,LC3Ⅱ/LC3Ⅰ以及beclin-1蛋白表达减少,提示槲皮素可能通过促进AMPK-mTOR信号通路的激活,促进A549细胞自噬发生。
综上所述,槲皮素可能通过激活AMPK-mTOR通路,促进人肺癌细胞株A549细胞自噬,本研究为槲皮素治疗肺癌提供一定理论基础。但本研究也存在一定不足,何种自噬基因启动诱发自噬有待深入探讨。
