某奶牛场犊牛腹泻的病原诊断及防控建议
2020-11-10刘伯承王慧高帅杨俊周望平蔡文杰
刘伯承,王慧,高帅,2,杨俊,周望平,蔡文杰
(1.湖南省畜牧兽医研究所,长沙 410131,2.湖南德人牧业科技有限公司,长沙 410131)
犊牛腹泻是奶牛场常见的一种临床疾病,主要危害1月龄以内的犊牛,多表现为爆发性腹泻,病程短、死亡率高,往往在一个时期内发病率可达80%,给养牛业带来较大的经济损失[1]。引起犊牛腹泻的主要病原体有细菌、病毒和隐孢子虫,细菌性的有大肠杆菌、沙门氏菌、魏氏梭菌,病毒性的有牛病毒性腹泻病毒、牛冠状病毒、牛轮状病毒,其中由致病性大肠杆菌引起犊牛腹泻的占90%[2],隐孢子虫是牛场环境中的常见寄生虫,可单独或与其他病原混合感染[3]。另外,一些非感染性因素如环境变化、气候变化、饲养管理等也是引起犊牛腹泻的重要原因。由于犊牛腹泻病因复杂,给防控该病造成了很大的困难。2019年10月,湖南常德市某牛场26头犊牛发生腹泻,为了确诊发病原因,无菌采集病死牛的肠内容物、肠组织、粪样送实验室,采用RT-PCR技术,对牛病毒性腹泻病毒、牛轮状病毒、牛冠状病毒、隐孢子虫、大肠杆菌毒力基因及黏附素进行了核酸检测,并采用纸片法(K-B)进行药敏试验,为临床治疗提供参考。
1 临床症状
该场共有460头荷斯坦牛,88头哺乳犊牛,腹泻26头,死亡22头,发病年龄在15~40日龄间,病程在10日内。1~3日,病牛出现轻度腹泻,排白色黏稠粪便,少数出现高温(40~41℃),轻度厌食;3~4日,腹泻加重粪便呈蛋花水样(图1),体温正常;5日后出现低温(35~37℃),脱水,昏厥,精神状态极差;7日左右治疗无效死亡。
2 病理变化
解剖发现心脏有白色炎症,肺部呈黄色,易碎,有黄色黏稠液体。脾脏、肝脏无明显病变,胃内有未消化奶块与草料,小肠有水肿和出血(图2)。
3 样品采集
无菌采集4头病死牛的肠内容物、肠组织、粪样,编号45号、57号、33号、59号,放入冷藏箱,送华中农业大学动物实验室检测。

图1 粪便
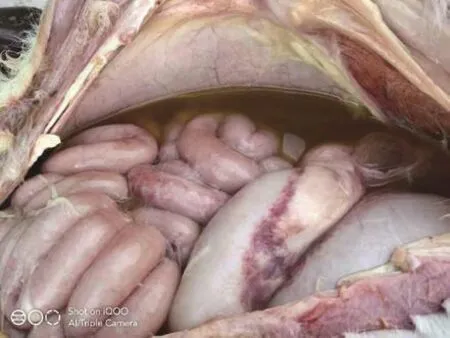
图2 小肠
4 试验方法
4.1 牛病毒性腹泻病毒核酸检测
利用病毒RNA提取试剂盒从血清中提取RNA,反转录为cDNA,然后以其为模板用牛病毒性腹泻病毒鉴定性引物通过PCR检测牛病毒性腹泻病毒,PCR产物的预期大小为201bp。
4.2 牛轮状病毒核酸检测
利用病毒RNA提取试剂盒从粪便中提取RNA,反转录为cDNA,然后以其为模板用轮状病毒鉴定性引物通过PCR检测牛轮状病毒,PCR产物的预期大小为294bp。
4.3 牛冠状病毒核酸检测
利用病毒RNA提取试剂盒从粪便中提取RNA,反转录为cDNA,然后以其为模板用冠状病毒鉴定性引物通过PCR检测牛冠状病毒,PCR产物的预期大小为488bp。
4.4 隐孢子虫核酸检测
利用粪便DNA提取试剂盒从粪便中提取DNA,然后用隐孢子虫鉴定性引物通过巢式PCR检测隐孢子虫核酸,PCR产物的预期大小为830bp。
4.5 大肠杆菌毒力基因检测
对采集的样品进行鉴别培养、鉴定大肠杆菌,核酸检测大肠杆菌毒力基因Stx1、Stx2、eae、astA、sta、stb、lt 及大肠杆菌黏附素K88、K99基因。
4.6 药敏试验
用药敏纸片扩散法(K-B)对分离鉴定的astA毒力基因大肠杆菌进行药敏试验,参考临床实验室标准协会(CLSI)标准进行判断。
5 结果
利用RT-PCR检测牛病毒性腹泻病毒核酸、牛轮状病毒核酸、牛冠状病毒核酸,均未检测到核酸阳性样本(图3~5);利用巢式PCR检测隐孢子虫核酸,检出1个阳性样本,阳性率为25%(图6);核酸检测大肠杆菌毒力基因,在57-2小肠、45-2肠组织、45-3肠组织3个样品中分别检测出astA毒力基因,未检测出其他黏附素及毒力基因;3个样品分离出的大肠杆菌对红霉素、庆大霉素等10种常用抗生素全部严重耐药,耐药率达100%(表1)。
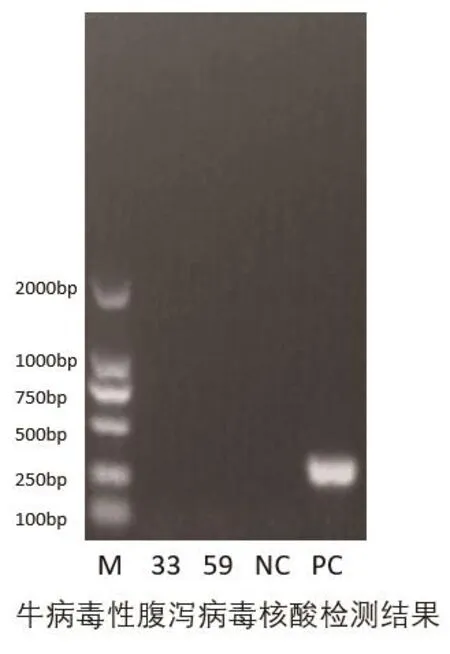
图3 牛病毒性腹泻病毒核酸检测结果
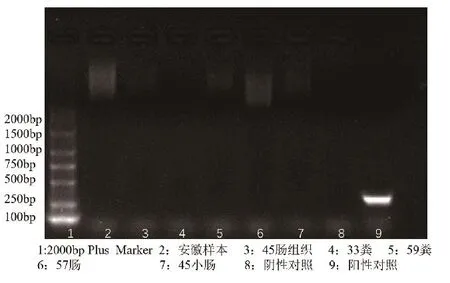
图4 牛轮状病毒核酸检测结果
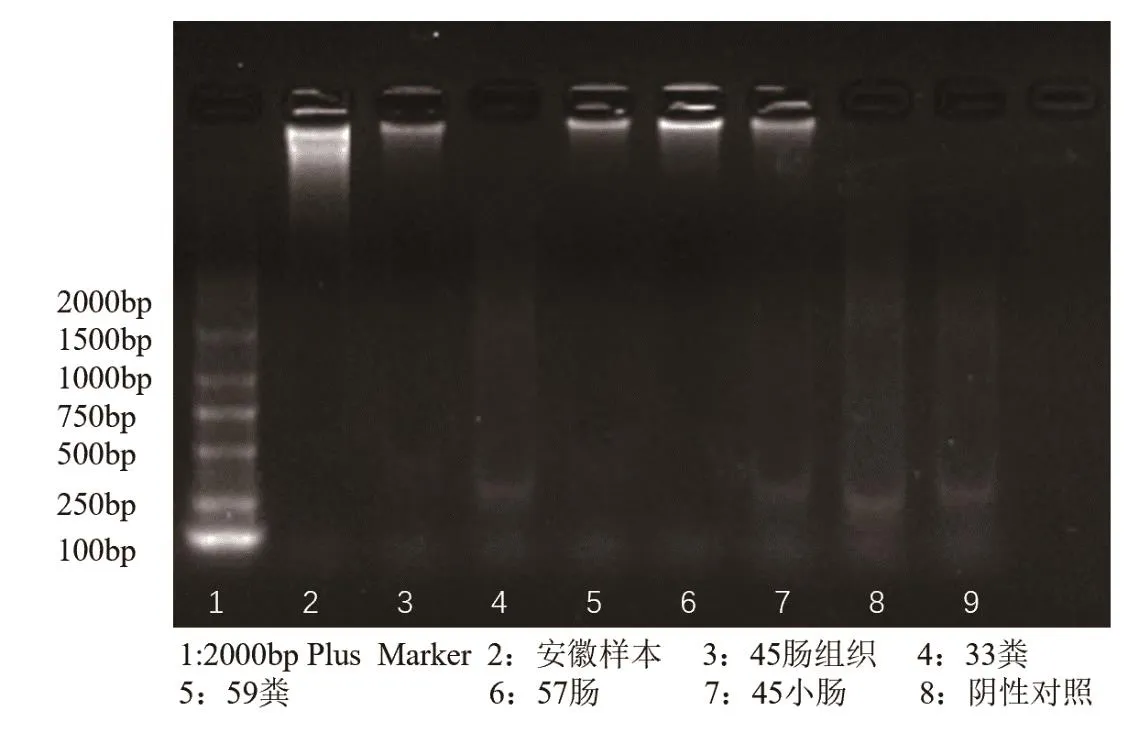
图5 牛冠状病毒核酸检测结果
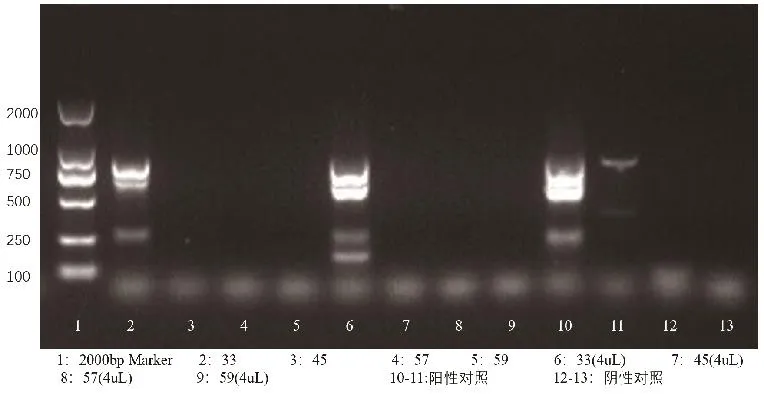
图6 隐孢子虫核酸检测结果
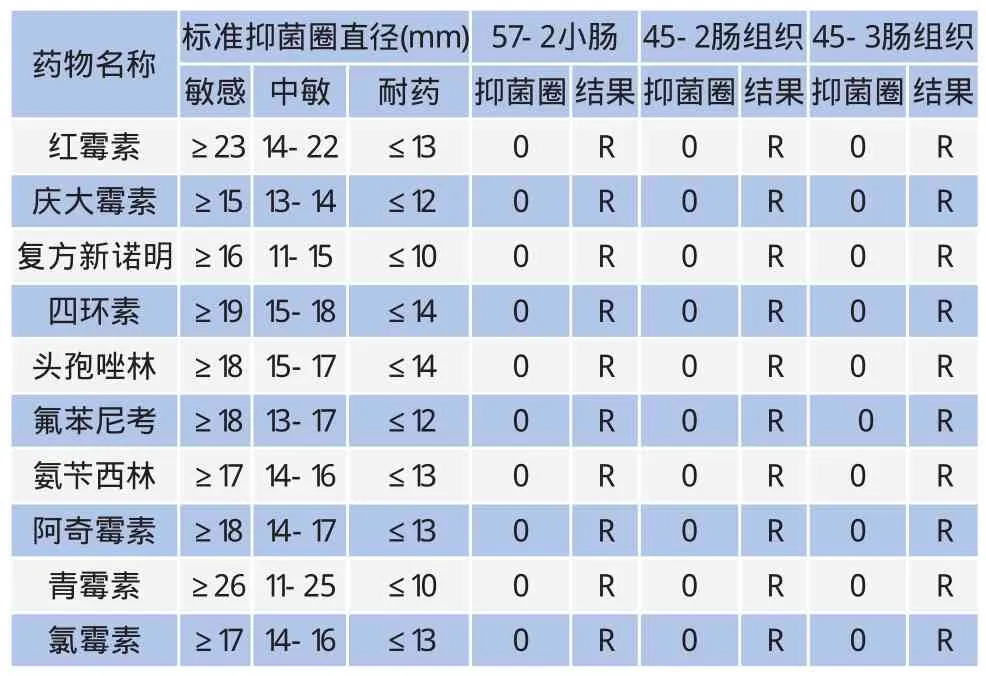
表1 astA毒力基因大肠杆菌药敏试验结果
6 讨论与分析
6.1 菌毒力基因检测分析
随着养牛业规模化扩大和集约化生产程度的提高,犊牛腹泻在养牛场中发病率和死亡也呈上升趋势[4],致病性大肠杆菌是引起犊牛腹泻的主要病原体,其致病性并不完全与血清型有关,而主要是取决于其所产生的特定的毒力因子,如菌毛、铁摄取系统、外膜蛋白以及毒素等[5],因此,毒力基因的检测已成为确定致病性大肠杆菌的常用方法[6]。从实验室检测结果可以看出,该牛场犊牛腹泻发病主要由肠聚集性大肠杆菌(EAEC)和牛隐孢子虫混合感染导致。astA基因是编码肠聚集性耐热毒素,与大肠埃希菌sta肠毒素基因有类似的性质[7]。张金宝等人的研究发现,致腹泻大肠杆菌携带的毒力基因较多,经常以两种或两种以上的毒力基因同时出现[8~10],本次致犊牛腹泻大肠杆菌样品中仅检出astA一种毒力基因,结果与前人研究差异较大。目前牛源致腹泻大肠杆菌中astA毒力基因的相关研究较少,从发病日程、临床解剖、死亡率(85%)和astA检出率(75%)来看,本次致犊牛腹泻大肠杆菌致病力较强,astA毒力基因介导的致病机理值得进一步研究。
6.2 耐药性分析
由于抗生素药物使用量的不断加大和耐药基因的扩散和传播,大肠杆菌的耐药性正变得日益严重[11],多重性耐药和耐药率也不断增高。本药敏试验表明,3个样品astA毒力基因大肠杆菌对受试的10种肠杆菌抗生素全部耐药,敏感率为0,耐药率为100%,与元振杰[12]等人对致腹泻大肠杆菌耐药性研究结果相差较大,该研究对氨苄西林、复方新诺明、庆大霉素、氯霉素、环丙沙星敏感性分别为22.5%、30.4%、40.2%、41.2%、46.1%,这可能与本研究中的牛场长期使用抗生素有关,但本次药敏试验受试样品数量过少,不能完全说明问题。目前,耐药性已经成为养殖生产中的突出问题,因此,养殖场应降低和规范使用抗生素,在防治过程中尽量用中草药制剂及抗生素替代品。
6.3 隐孢子虫
隐孢子虫是引起犊牛腹泻的重要寄生虫,通过受污染的水源和食物等途径传播。刘毅[13]对湖南省8个县隐孢子虫感染牛进行了调查,结果发现3、4月龄犊牛的感染率分别为100%、60%;Muhid等[14]对马来西亚16个奶牛养殖场的隐孢子虫感染率研究显示,隐孢子虫对断奶前和断奶后犊牛的感染率分别为30.8%和23.3%,牛隐孢子虫、瑞氏隐孢子虫和安氏隐孢子虫对断奶后犊牛的感染率分别为35%、30%和30%,说明幼龄牛比其他年龄阶段牛感染率更高。黄柳梅[15]研究表明,我国部分省份的隐孢子虫病的感染率在4.49%、24%、19.71%、19.09%、13.65%、21.5%。本次检测隐孢子虫阳性率为25%(1/4),大部分调查研究认为,牛场隐孢子虫的感染率高低与环境卫生有着重要的关系,因此,加强环境卫生管理,做好杀虫、消毒灭源等工作,对预防犊牛腹泻至关重要。
综上所述,预防犊牛腹泻建议从以下几个方面进行:①防止病畜粪便污染食物和饮水,控制传染源并注意环境卫生,做好新生犊牛隔离饲养,防止相邻犊牛粪便接触;根据牛隐孢子虫卵囊的排出规律,对带虫牛舍的消毒及清扫应选择在早晨,用10%福尔马林、5%氨水或65℃以上30min均可杀死卵囊;病畜应隔离饲养,根据病情及时补液(氯化钠、碳酸氢钠、VC),防止脱水与酸中毒,采用抗菌消炎类中药灌服,用磺胺类药物驱虫,防止隐孢子虫继发感染。②给母畜和新生幼畜提供良好的营养,保证幼畜出生2h内,最迟不超过6h,吃到自身体重5%的高质量初乳,建立最佳的非特异性免疫。③在分娩前6周或2周给妊娠母牛接种大肠杆菌疫苗。④做好牛场内带牛消毒,每天更换一次垫料。⑤适当通风,保持舍内温度,给犊牛喝烧开过的温水。
