电离辐射对肠道菌群的影响及基于菌群调节的辐射防护研究进展
2020-11-10殷祥昶陈晓娟窦桂芳马百平
郑 颖,殷祥昶,赵 阳,陈晓娟,窦桂芳,马百平
(1.军事科学院军事医学研究院辐射医学研究所,北京 100850;2.天津中医药大学,天津 300193)
电离辐射在核能发电、核医学诊疗、食品辐照灭菌、高分子材料改性以及环境治理等多个方面具有重要的应用,与国民经济发展及人们日常生活密切相关,而由此产生的电离辐射损伤及其防护逐渐成为一项重大公共卫生问题。电离辐射损伤涉及造血、免疫、胃肠道、中枢神经系统和皮肤等,在体内可单独或联合发生,损伤程度受辐射源、剂量率、暴露时间及机体敏感性等因素影响。多年来,国内外对于辐射防护剂的研究开发从未间断,筛选的活性物质多因防护效价低、作用时间短、毒副作用大等缺点而难以推广应用,目前仍然缺乏防护效果好、安全低毒、使用方便的辐射防护剂。
近年来,肠道菌群的研究受到高度关注。肠道微生态系统是人体最庞大的微生态系统。人体肠道细菌的数量约为人体自身细胞数量的10倍,种类多达1000种[1-2]。肠道菌群受环境、生活习惯、饮食和药物等多种因素影响,通过肠-脑轴和肠-肝轴、肠-肺轴等与机体互作,是机体代谢和免疫系统的重要调节器。肠道菌群、宿主和外界环境三者之间相互影响共同维持着一种平衡态,宿主在肠炎[3]、肥胖[4]、痴呆[5]和糖尿病[6]等多种疾病状态下都表现出了对这种平衡的扰动,通过干预手段促进肠道菌群的再平衡逐渐成为疾病治疗的一种新策略。
目前研究已证明,电离辐射暴露扰乱肠道微生态平衡,使肠黏膜屏障受损,条件致病菌由此侵入体内,引起肠源性感染、内毒素血症等,严重者可导致死亡。电离辐射条件下,肠道菌群的变化伴随着代谢产物的变化,并与代谢产物和机体生理病理改变相互影响。益生菌补充、粪菌移植(fecal microbiota transplantation,FMT)、活性化合物及抗电离辐射中药干预可调节肠道微生态平衡,缓解机体辐射损伤(图1)。本文对肠道菌群与电离辐射损伤的最新研究进行综述,介绍肠道菌群的研究概况,总结电离辐射条件下肠道菌群及代谢物的变化及基于肠道菌群的电离辐射损伤防治方法,以探讨肠道菌群研究待解决的问题,为电离辐射损伤防护提供一些参考。
1 电离辐射对肠道菌群组成的影响
1.1 电离辐射影响田鼠和小鼠肠道菌群组成
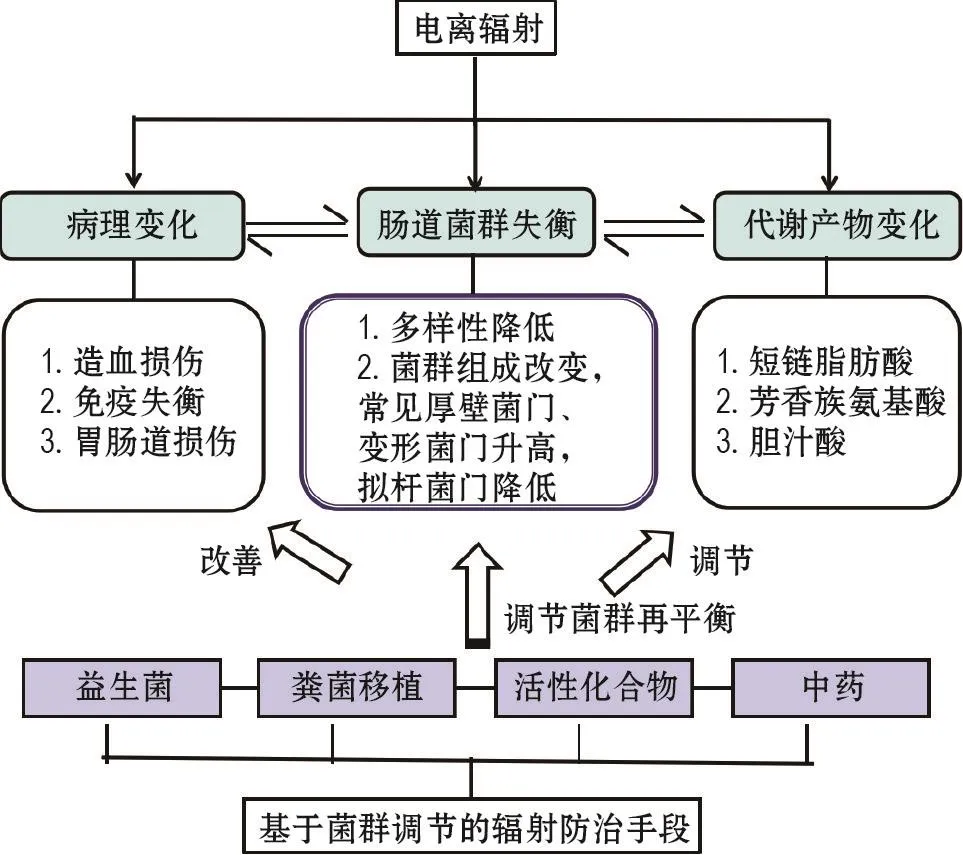
图1 电离辐射对肠道菌群的影响及基于菌群调节的辐射损伤防护示意图.
电离辐射对机体的损伤程度受辐射源、剂量率、暴露时间及机体敏感性等因素影响。胃肠道系统对电离辐射具有高度的敏感性,辐射影响胃肠道的运动、吸收和分泌功能,常见的胃肠道反应为恶心呕吐、腹泻和病理检测可见小肠绒毛断裂、隐窝塌陷、黏膜上皮受损等。电离辐射条件下,无菌动物与常规动物的对比研究直观地反映了肠道菌群对电离辐射的敏感性以及通过调节菌群进行辐射损伤防治的可能性。与常规饲养的动物相比,无菌小鼠对致死剂量辐射引起的肠炎有明显的抵抗性。机制上,这2种动物的辐射敏感性受禁食脂肪诱导因子(fasting-induced adipose factor,Fiaf)的调控;Fiaf由小肠绒毛上皮细胞分泌,在正常小鼠中受肠道微生物群抑制而缺乏,从而导致正常小鼠绒毛内皮细胞和淋巴细胞群体对辐射诱导的细胞凋亡的抵抗力下降[7]。文献报道了辐射模型动物的肠道菌群组成在照射前、后发生的一系列变化(表1)。其中,2018年一项研究表明,生活在切尔诺贝利核辐射污染环境下田鼠的肠道菌群组成发生了明显变化,未污染区域田鼠的厚壁菌门(Firmicutes)/拟杆菌门(Bacteroidetes)比值低于0.9,而核污染区的田鼠厚壁菌门显著增加,厚壁菌门/拟杆菌门比值为1.7;核污染区田鼠的菌群功能也发生了改变,以碳水化合物的降解、同化和转运、外源物质生物降解和DNA损伤通路为特征[8]。辐射可导致菌群发生促炎性失调。C57BL/6J小鼠经192Ir 22 Gy(5.5 Gy×4次)直肠内照射,6周后厚壁菌门明显减少,疣微菌门嗜黏蛋白艾克曼氏菌(Akk菌属,Akkermansia)、拟杆菌门拟杆菌属(Bacteroides)和副拟杆菌属(Parabacteroides)、变形菌门萨特菌属(Sutterella)、厚壁菌门苏黎世杆菌属(Turicibacter)丰度显著增加。辐射改变的微生物群在细菌-HT29上皮细胞共培养物中和无菌小鼠体内均刺激白细胞介素1β(interleukin-1β,IL-1β)的分泌,而IL-1是放射性直肠炎损伤的主要驱动因子,或可通过微生物群落调控或直接阻断IL-1来缓解临床辐射治疗引起的组织损伤[9]。XIAO等[10]研究表明,15 Gy全腹部照射(total abdominal irradiation,TAI)使小鼠拟杆菌门相对丰度降低,变形菌门相对丰度升高;拟杆菌纲(Bacteroidia)、β-变形菌纲(Betaproteobacteria)、红蝽菌纲(Coriobacteriia)相对丰度降低,浮霉状菌纲(Planctomycetia)、鞘脂杆菌纲(Sphingobacteria)等相对丰度增加,富氢水灌胃逆转了这种改变并通过MyD88对肠道菌群的效应缓解照射引起的胃肠道损伤。机制上,灌胃富氢水主要上调了miRNA-1968-5p水平而平行下调TAI暴露后小肠组织中MyD88的表达水平,进而通过MyD88对肠道菌群的效应改善辐射引起的胃肠道毒性。LU等[11]报道了在15 Gy全腹部照射下,小鼠肠道菌的Chao 1指数和Shannon多样性指数未发现显著性差异,但仍改变了菌群组成。辐射导致拟杆菌门相对丰度降低,变形菌门相对丰度增高,拟杆菌科和肠球菌科(Enterococcaceae)丰度降低,但拟杆菌科S24_7属明显富集。3,3′-二吲哚甲烷(3,3′-diindolyl⁃methane,DIM),可减轻辐照引起的小鼠死亡或体质量减轻,维持小肠干细胞的增殖和分化,恢复菌群的结构变化,并可能通过这种菌群调节作用减轻辐射损伤。
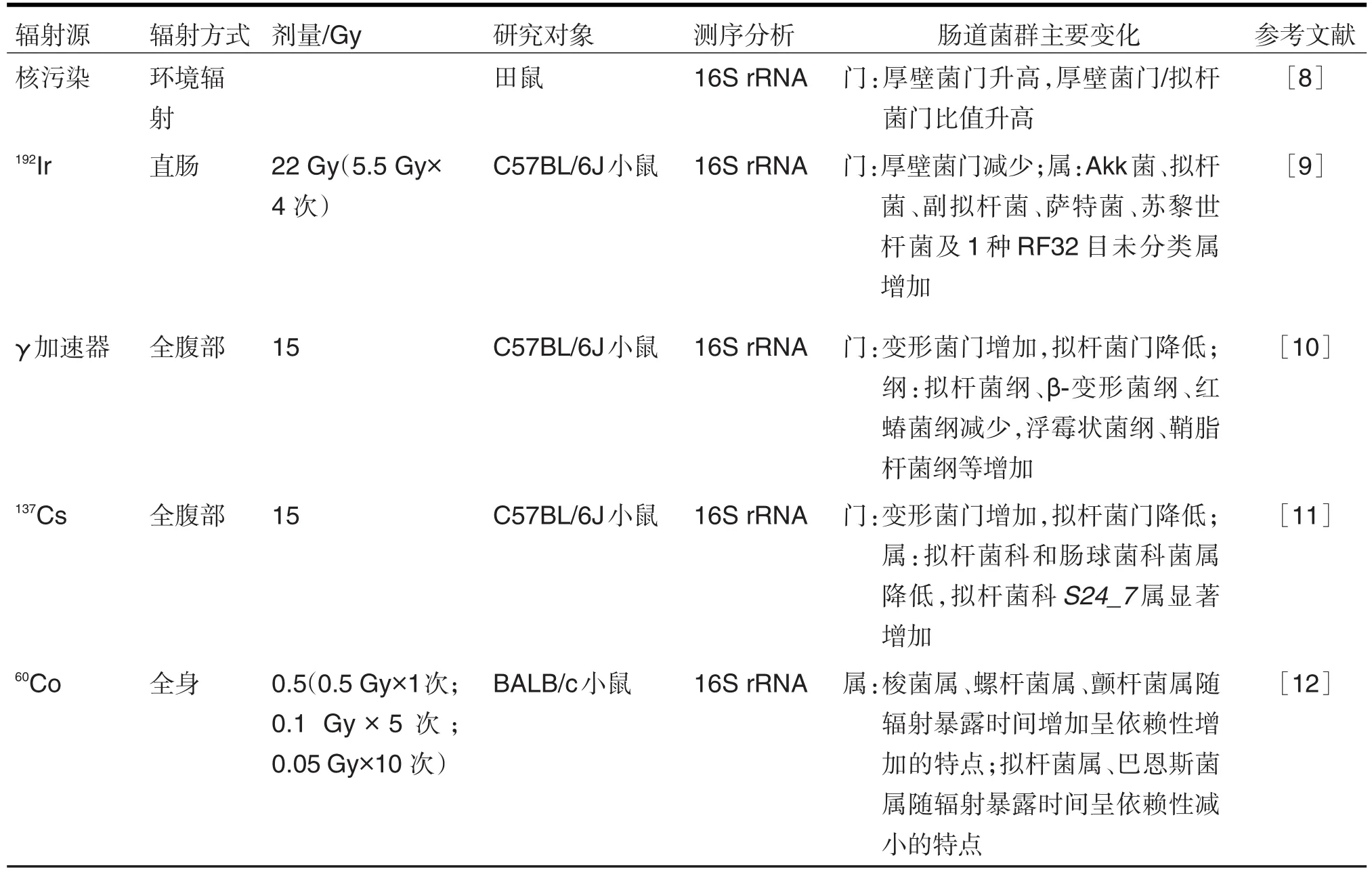
表1 电离辐射对田鼠和小鼠肠道菌群组成的影响
除了高剂量急性辐射损伤,越来越多的研究开始关注低剂量电离辐射对机体健康的慢性影响,由此也引发了关于肠道微生物在其中所起作用的思考。LIU等[12]报道,BALB/c小鼠经0.5 Gy不同方式(0.5 Gy×1次;0.1 Gy×5次;0.05 Gy×10次)γ射线照射后,肠道菌群结构发生了改变,其中,梭菌属(Clostridium)、螺杆菌属(Helicobacter)、颤杆菌属(Oscilibacter)相对丰度随辐射暴露时间增加而升高,拟杆菌属和巴恩斯菌属(Barnesiella)相对丰度则随暴露时间增加依赖性降低;功能代谢通路分析反映了肠道菌群在属水平上的差异对代谢途径的影响,其中拟杆菌主要与细菌毒素和类胡萝卜素合成及上皮细胞信号转导等呈正相关;葡萄球菌与细菌毒素、类胡萝卜素生物合成、上皮细胞信号、药物代谢、DNA修复等呈负相关。辐射导致肠道菌群的变化与代谢物的扰动相关,揭示了低剂量电离辐射诱导的肠道代谢途径的共生稳态的破坏,并为进一步研究低剂量电离辐射下肠道菌群对机体的作用机制和菌群干预研究提供了分析基础。
1.2 电离辐射影响人体肠道菌群组成
2019年发表的一项关于微生物群与急性/晚期放射性肠病相关性的大型临床研究[13],收集了134名受试者的粪便样本,基于高通量16S rRNA基因测序技术对放疗过程中肠道菌群的总体情况进行了分析。结果表明,随着放疗进行,患者的肠道菌群多样性逐渐降低,并且表现出与晚期放射性肠病程度成正相关的特征。放射性肠病患者的罗斯菌属(Roseburia)、梭菌属Ⅳ、粪杆菌属(Faecalibacterium)相对丰度明显增加;与微生物群调节和肠壁维持相关的稳态肠黏膜细胞因子(IL-7,IL-12/IL-23p40,IL-16,IL-15)明显减少,其中IL-15与罗斯菌属和丙酸杆菌属(Propionibacterium)的丰度呈负相关,表明肠道微生物可能与腹部或盆腔照射引发的急性和晚期放射性肠病有关。另一项研究报道了盆腔放疗患者粪便中几种菌属的变化与放射性肠炎的发生密切相关,并可根据几种特定肠道菌属对患者放疗后可能发生肠炎的风险进行预测。在该研究中,放射治疗导致粪便中菌群α多样性降低,β多样性增加。门水平上,放射性肠炎患者变形菌门相对丰度显著增加;属水平上,拟杆菌属相对丰度明显降低。巨单胞菌属(Megamonas)、新鞘氨醇杆菌(Novosphingobium)、普雷沃菌属(Prevotella)3种菌属在肠炎患者中显著富集,或可作为反映放射性肠炎的特征性菌属。在放疗后发展为放射性肠炎的患者其照射前粪便样品中的粪球菌属(Copro⁃coccus)和脱硫弧菌属(Desulfovibrio)明显富集,这2种菌属或可作为特征性菌属对患者进行放射性肠炎发生风险的预测。放射性肠炎患者粪菌液与上皮细胞共培养,诱导了上皮细胞的炎症和屏障功能障碍,使肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)和IL-1β表达增加,进一步说明辐射诱导的肠道菌群失调可能助推放射性肠炎的发展进程[14]。
辐射与肠道菌群的现有研究表明,肠道微生物影响宿主对电离辐射的敏感性和病理反应。在大剂量急性辐射损伤模型和低剂量慢性辐射损伤模型中,均可见肠道菌群组成发生明显变化。其中,厚壁菌门和变形菌门增加、拟杆菌门降低较为常见,肠球菌、乳酸菌和双歧杆菌等通常被认为对宿主有益的菌属也被报道丰度降低。辐射导致部分菌属的丰度变化与促炎因子的表达量密切相关,可作为反映放射性肠炎发生发展的特征性菌属。在此次文献整理过程中,我们发现文献中采用的辐射源、辐射方式和辐射剂量各不相同,辐射后菌群的变化特点也存在不一致的情况,一些显著变化的菌的功能及在机体损伤中发挥作用的机制阐述不够。相信这些复杂问题会在未来研究中逐渐解决。
2 肠道菌群代谢物的功能及对电离辐射的影响
肠道菌群也被认为是一个内分泌器官,产生的代谢分子参与宿主的生理功能,并在局部和远端水平上触发反应。肠道菌群的改变往往伴随多种代谢产物的变化,大量的代谢物驱动着宿主和菌群之间的交流[15],从代谢层面更好地理解宿主与肠道菌群的相互作用可为基于肠道菌群的治疗干预提供启发。目前,短链脂肪酸(short-chain fatty acids,SCFA)、芳香氨基酸(aromatic amino acid,AAA)和胆汁酸等已被发现作为菌群和宿主对话的信号分子,参与辐射条件下宿主生理功能的调节过程。
2.1 短链脂肪酸
肠道菌群发酵非消化性多糖产生的SCFA一直受到研究者的高度关注,常被作为阐述肠道菌群与疾病关系的核心物质。SCFA主要包括乙酸、丙酸、异丁酸、丁酸、异戊酸和戊酸,在体内多以盐的形式存在,通过与G蛋白偶联受体(G protein coupled recoptor,GPCR)结合或抑制组蛋白去乙酰酶(histone deacetylase,HDAC)调节下游信号通路发挥抗炎、免疫调节等作用[16-17](图2)。其中,丁酸盐通过与GPR43结合,提高转化生长因子β(trans⁃forming growth factor-β,TGF-β)和IL-10等抗炎细胞因子的产生,上调Foxp3+调节性T细胞(regulatory cell,Treg)数量,也可通过抑制HDAC的活性下调NF-κB介导的促炎反应;乙酸盐与GPR43结合,有利于B细胞和杯状细胞分泌黏液素和IgA,增强屏障功能;丙酸盐和丁酸盐联用,可降低脂多糖(lipo⁃polysaccharide,LPS)诱导的促炎过程。丁酸盐通过抑制HDAC诱导肠细胞生理缺氧,进而稳定低氧诱导因子1(hypoxia inducible factor-1,HIF-1),调节改善上皮屏障功能的基因,发挥促进肠屏障功能的作用[18-19]。最新研究表明,由肠道菌群代谢产生的戊酸灌胃后提高了辐照小鼠的生存率,保护造血器官损伤和胃肠道功能;高通量测序、同位素相对标记和绝对定量(isobaric tags for relative and absolute quantitation,iTRAQ)结果显示,戊酸可恢复小鼠肠道菌群的分类比例,重建小肠组织的蛋白表达谱[20]。
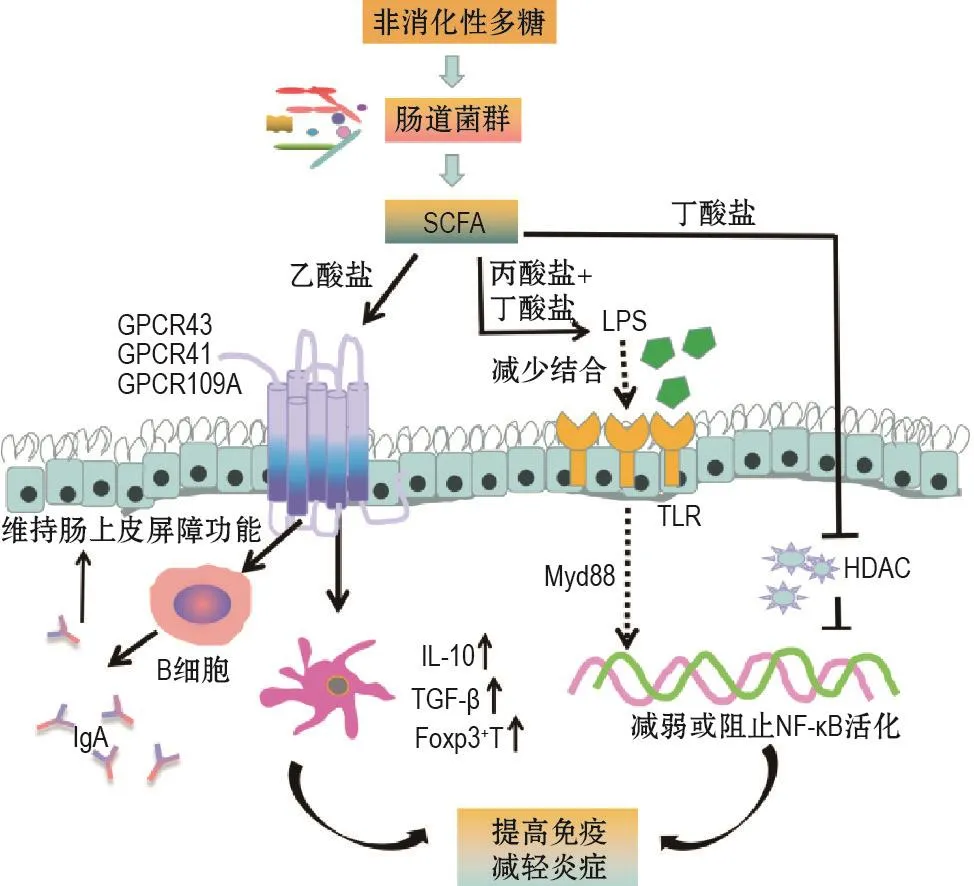
图2 短链脂肪酸(SCFA)抗炎及免疫调节作用机制.GPCR:G蛋白偶联受体;LPS:脂多糖;TLR:Toll样受体;Myd88:髓样分化因子88;HDAC:组蛋白去乙酰酶;IL-10:白细胞介素10;TGF-β:转化生长因子β;Foxp3+T:叉头状转录因子P3阳性T细胞;IgA:免疫球蛋白A
2.2 芳香氨基酸
AAA可由宿主本身和肠道菌群代谢产生。其中肠道菌群分解代谢产生的大量AAA代谢物,可能作为宿主生理信号分子,在局部和远处调节宿主的免疫、代谢和神经元反应。大量文献报道了色氨酸吲哚类代谢物对肠道功能和远处器官的调节作用。色氨酸在胃肠道中有3条主要的代谢途径[21]:①饮食色氨酸可被肠道微生物群直接转化为芳香烃受体(aryl hydrocarbon receptor,AhR)的配体;②免疫细胞和上皮细胞中吲哚胺2,3-双加氧酶(indoleamine 2,3-dioxygenase,IDO)的犬尿酸通路;③肠嗜铬细胞5-羟色胺(5-hydroxytryptamine,5-HT)合成途径。AhR信号被认为是肠道屏障免疫反应的关键组成部分,对肠道内稳态至关重要。肠道菌群色氨酸代谢产生的吲哚类化合物可激活AhR,生成IL-22,维持黏膜表面宿主微生物的稳态[22-23]。在肠道中,一些吲哚类衍生物可通过AhR/IL-22轴调节上皮完整性和黏膜免疫应答[24]。吲哚也可通过芳基烃受体激活上调固有层淋巴细胞的IL-22分泌,加速肠干细胞(intestinal stem cells,ISC)上皮细胞的增殖,从而保证组织的稳态[25]。
电离辐射干扰小鼠肠道的微生物代谢。由于与色氨酸相关的吲哚化合物起源于肠道菌群,随后进入肝,因此吲哚化合物浓度的改变可作为辐射损伤的血浆标记。BROIN等[26]利用气相色谱-质谱联用仪(GC/MS)和液相色谱-串联质谱仪(LC/MS/MS)分析了不同辐射剂量的血浆差异性代谢物,证明了电离辐射对肠道微生物色氨酸代谢的抑制作用,表明或可根据辐照后特定时间内给定血液样本中吲哚类化合物浓度来推断可能的全身辐射剂量,这对于核事件后快速评估个人辐射剂量具有重要意义。
2.3 胆汁酸
胆汁酸是胆甾醇来源的天然表面活性剂,在肝中产生,随胆汁分泌到十二指肠,在肠道中由细菌介导转化,生成次级胆汁酸,成为宿主与微生物沟通的信号分子。胆汁酸在肠内的转化主要由拟杆菌属、真杆菌属(Eubacterium)、梭菌属(XIVa和XI)中的厌氧菌以及放线菌门和变形菌门中的少量需氧菌完成[27]。辐射影响肠道内胆汁酸水平。WANG等[28]报道,大鼠盆腔照射可诱发胆汁酸吸收不良引发腹泻,主要原因是放射治疗影响大鼠胆汁酸稳态和顶膜钠依赖性胆汁酸转运体(apical sodiumdependent bile acid transporter,Asbt),回肠 Asbt表达下调或Asbt功能降低导致胆汁酸吸收不良,肠道胆汁酸积累导致腹泻。在溃疡性结肠炎患者体内,肠道菌群失调引发肠道次级胆汁酸水平降低,加重肠道炎症[29],而放射性肠炎及肠道菌群失调是腹盆腔肿瘤放射治疗的常见不良反应,肠道内胆汁酸的水平主要靠菌群调节,提示通过调节菌群带来胆汁酸水平的变化或直接阻断胆汁酸受体可能对减轻辐射损伤有作用。
3 基于肠道菌群调节的辐射防护及其机制
肠道菌群研究的不断发展开拓了对辐射防护手段的全新的认识视角与开发思路。肠道菌群可通过调节Toll样受体(Toll-like receptors,TLR)信号通路、免疫平衡、炎症反应以及调控肠黏膜机械屏障等发挥辐射防护作用[30]。益生菌补充及菌群移植等手段可调节肠道菌群结构,改善肠道免疫功能,在一定程度上起到预防或减轻辐射损伤的作用。基于肠道微生态的宿主-肠道菌群-活性成分的相互作用研究模式也为传统辐射防护剂的作用靶点发现带来了新的启示。
3.1 益生菌补充
益生菌是一类能改善宿主微生态平衡、对肠道有益的活性微生物的总称。很多文献报道了乳酸菌的补充可减少辐射引起的肠损伤。如小鼠全身照射12 Gy前,连续3 d灌胃鼠李糖乳杆菌(Lacto⁃bacillus rhamnosusGG,LGG)及培养上清液,可提高小鼠生存率,辐射对照组小鼠在照射后6 d开始死亡,第11天全部死亡。相比之下,用LGG预处理的小鼠在照射后10 d开始死亡,部分小鼠存活到第14天。此外,LGG提高小肠隐窝存活数量,减少上皮细胞凋亡。LGG是以TLR2或环氧化酶2(cyclooxygenase 2,COX-2)依赖的方式发挥辐射保护作用的[31]。LGG能通过释放脂磷壁酸、巨噬细胞活化和间充质干细胞迁移来保护肠上皮免于辐射损伤[32]。嗜酸乳杆菌能有效减轻腹盆区域照射10 Gy和15 Gy大鼠小肠黏膜损伤,但对于20 Gy照射无明显改善作用[33]。pprI基因转染的清酒乳杆菌(L.sakei),能预防或减轻放射性肠炎;机制上,该菌主要是通过产生高水平的PPRI蛋白调控抗氧化酶(超氧化物歧化酶和过氧化氢酶)来清除ROS,影响Treg细胞和Th细胞调控的抗炎因子IL-10的表达,抑制促炎因子IL-6和TNF-α的表达[34]。从果蝇中筛选出的乳酸乳球菌乳酸亚种(L.lactissubsp.cremoris),对放射性细胞损伤有很强的保护作用;全身照射12 Gy前连续3 d经胃该菌小鼠生存率提高,减少体质量下降,降低结肠隐窝基底细胞的凋亡,并能有效缓解葡聚糖硫酸钠(dextran sulfate sodium,DSS)诱导的结肠炎症状[35]。宫颈癌患者盆腔放疗前7 d和放疗期间每天口服活的嗜酸乳杆菌和两歧双歧杆菌降低了辐射引起的腹泻的发生率,可减少抗腹泻药物的使用,并能改善患者的大便状态[36]。LIU等[37]开展的一项随机对照试验荟萃(meta)分析也说明了益生菌对于放疗所致腹泻的保护作用,并对益生菌可能的作用机制进行了总结。首先,益生菌可能会改变宿主菌群的组成及其代谢活性,通过降低肠道pH值来设置屏障。其次,益生菌通过产生抗菌肽,增强黏膜屏障功能,防止细菌过度生长。此外,益生菌可能通过触发和调节免疫细胞的功能,下调肠道炎症反应,有利于肠道黏膜的恢复和稳态。
3.2 粪菌移植
FMT是通过移植健康供体的肠道微生物群使患病者的肠道微生态重建,缓解或治疗疾病;动物实验主要采用灌胃方式,临床上主要通过结肠镜或饲管、灌肠及胶囊等方法输送粪液。FMT是纠正菌群紊乱的新型治疗手段,对难治性艰难梭菌感染治愈率较高,目前FMT已应用于辐射损伤动物救治及放射性肠炎患者的治疗。2017年,CUI等[38]首次报道了FMT可缓解辐射导致的的小鼠放射性肠炎。辐照小鼠自6.5 Gy照射当天开始连续10 d灌胃健康小鼠粪便上清液,明显提高受照小鼠30 d的存活率,缓解辐射导致的体质量下降及脾体积减小,改善胃肠道功能。FMT以性别特异性的方式,维持小鼠肠道菌群组成及小肠中mRNA和非编码RNA的表达谱。FMT对辐射引起的造血系统损伤也有一定的促恢复作用,6.5 Gy照射下FMT对外周血白细胞数量降低有轻微的改善作用,但不影响血红蛋白水平,当照射剂量提高为致死剂量8.0 Gy时,FMT合并骨髓移植提高受照小鼠存活率效果明显优于二者单用效果。DING等[39]首次报道了针对常规治疗方法无效的慢性放射性肠炎(chronic radiation enteritis,CRE)患者的FMT临床研究,在接受FMT治疗的5名CRE患者中,有3名患者肠道不良反应减轻,其卡氏评分降低,且无FMT相关的死亡和感染并发症,为FMT作为CRE临床治疗的可行性提供了评估证据。
3.3 活性化合物和中药干预
辐射化学防护是辐射防护与辐射后治疗的重要手段。文献报道了一些活性化合物具有抗辐射及调节辐射后肠道菌群再平衡的作用。染料木黄酮是大豆异黄酮中的主要活性成分,具有良好的辐射保护作用以及极低的毒副作用,因而成为抗辐射药物研究的热点。目前,美国与俄罗斯对其在电离辐射损伤防护的相关研究已推进至临床试验阶段。而其与肠道菌群的相关研究也发现,染料木黄酮能显著调节肠道菌群结构,并广泛影响宿主的免疫稳态与众多疾病的发展,为其新作用靶点的发现开拓了新视角[40-41]。DIM是一种天然的小分子化合物,可减轻全腹部辐照引起的小鼠死亡或体质量减轻状况,提高辐照小鼠Lgr5+小肠干细胞的存活率及抗氧化酶Nrf2的表达,清除ROS,缓解小肠内DNA损伤和细胞凋亡;DIM也可恢复辐射引起的肠道菌群失调现象,并表现出了通过调节菌群减轻辐射损伤的作用[11]。LU等[42]报道了藻青蛋白(phyco⁃cyanin)可调节小鼠肠道微生物群组成,增加有益菌,减少有害细菌,进而降低LPS水平和抑制TLR4/Myd88/NF-κB通路的激活,下调炎性细胞因子的表达,使小鼠免受高剂量辐射损伤。此外,也有报道传统中药可通过调节肠道菌群发挥辐射防护作用。如王毓国等[43]报道了中药复方凉血固元汤能有效调节11 Gy60Co-γ全身照射引起的大鼠肠道菌群结构失调,改善大鼠生存质量。
同时,菌群的一些代谢产物也被发现对辐射损伤有着良好的预防与治疗作用。如戊酸补充被发现显著提高了辐照小鼠的存活率,保护了造血器官,改善了辐照小鼠的胃肠道功能和肠上皮完整性;戊酸对雌性、雄性小鼠肠道辐射损伤均有保护作用,对于肠炎的保护作用也不局限于放射性肠炎,还可用于DSS等化学物诱导的其他类型肠炎的保护[20]。由Bacillussp.分离得到的次级代谢产物半醌葡糖苷衍生物被证明可通过增强有丝分裂、促增殖和凋亡抑制活性来补充受损细胞,从而可能通过调节G1/S期细胞周期阻滞来逆转辐射诱导的退行性变化[44]。而从Bacillussp.分离得到的N-乙酰基色氨酸吡喃葡萄糖苷也被发现可能通过调节氧化应激与免疫抑制等方式挽救了辐射诱导的J774A.1小鼠巨噬细胞的凋亡[45-46]。
4 结语与展望
本文综述了辐射条件下肠道菌群及其代谢产物的变化,以及益生菌、FMT等通过调节肠道菌群减轻辐射损伤的方法。哺乳动物胃肠道中含有大量的共生菌,对电离辐射具有高度的敏感性,特别是辐射条件下肠道菌群与代谢产物、机体生理病理的协同变化和相互影响,更加显示了肠道菌群在维持机体健康稳态方面的作用,及以菌群作为辐射损伤防治靶点的可行性。
对于肠道菌群的研究也同时面临很多待解决的问题。首先,对于辐射与肠道菌群的研究,大多只是看到菌群的变化现象,并未阐明肠道菌群失衡是疾病的诱因还是结果。其次,利用生物分析手段,研究中通常被关注的是发生显著变化的菌,但某些显著变化的菌本身可能不具有疾病治疗作用,而是促进或抑制了其他共生菌间接发挥了作用。因此,肠道微生物彼此之间存在怎样的相互关系值得深入探讨。再者,FMT虽是比较有前途的治疗策略,但其临床应用还存在一些问题。首先,不同国家的FMT政策差别较大,缺乏统一的有效监管。如美国FDA认为,除治疗艰难梭菌感染,FMT应按照新药申请流程进行;奥地利则认为FMT是治疗手段而非药物[47]。其次,由于个体之间肠道菌群高度多样化,最佳供体或最佳菌群以及移植最佳剂量难以确定。而且,FMT要克服供体粪便异质性的挑战以及血液感染和耐药细菌传播等风险。此外,FMT也涉及患者意愿、收益和推广以及与公共卫生的关系等伦理问题。随着技术障碍的克服,FMT有望在未来获得推广应用。
辐射与肠道菌群的研究多采用啮齿类动物模型,距应用到人体辐射防护还有很长的路要走。虽然许多常见的菌属在人类和动物肠道中共同存在,但在数量和基因层面差异较大,肠道的生理结构和生化环境也不同[48],动物实验研究结果不能代表人体菌群研究,但作为人体肠道菌群研究的前期基础,模型动物肠道菌群的可塑性及其对辐射损伤的作用充分说明了肠道菌群研究对人体辐射损伤防治具有极大的可能性。此外,小鼠肠道菌群存在明显的性别差异,影响对辐射损伤的治疗效果[49],提示了未来以菌群为基础的精准医疗的必要性。
研究辐射条件下肠道菌群的变化特点及基于菌群调节的辐射防护机制对于中药抗辐射制剂的开发具有十分重要的意义。中药是中华民族的瑰宝,多种中药成分被报道具有抗辐射作用,如多糖类、黄酮类、香豆素类、皂苷类、多酚类等,而中药制剂生物利用度低,相当一部分口服后“穿肠而过”,大量暴露于粪便中,其抗辐射效应物质、作用机制不甚清楚。探讨辐射条件下中药对肠道菌群的调节作用,对于解释中药抗辐射作用的起效机制提供了分析基础,也为新型中药辐射防护剂的研究开发带来了新的机遇。
总之,我们有理由相信,随着肠道菌群研究的深入,未来益生菌/益生元、菌群药物以及菌群移植等产品及治疗方法,不仅能助健康人和(或)患者建立良好的肠道微生态,也有可能达到减轻辐射损伤的目的。
