小补心汤总黄酮调节肠道菌群与脑免疫炎症的抗抑郁机制
2020-11-10黄梦丽张亭亭张有志
黄梦丽,张亭亭,薛 瑞,邓 云,张有志
(1.安徽理工大学医学院,安徽 淮南 232001;2.军事科学院军事医学研究院毒物药物研究所,抗毒药物与毒理学国家重点实验室,北京 100850;3.首都医科大学宣武医院,北京 100053)
抑郁症的发病机制复杂,假说众多[1],当前临床抗抑郁药疗效难以令人满意,抑郁症发病机制的研究及治疗药物的研发尚有许多问题亟待解决。诸多研究表明,抑郁症与肠道疾病(如肠易激综合征)共患比率高,约50%~94%的肠易激综合征患者同时患有抑郁、焦虑等精神障碍[2-3]。近年来,肠道菌群-肠-脑轴在精神疾病中的重要作用受到广泛关注,研究表明,肠道菌群与抑郁症的发病和治疗密切相关[4]。
肠道菌群可能通过神经、免疫和内分泌途径与中枢神经系统产生联系。炎症在抑郁症病理机制中的作用一直以来备受关注,抑郁症患者血清中炎症标志物如肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)、白细胞介素6(interleukin-6,IL-6)和c反应蛋白等的水平往往高于正常人,这可能与肠道菌群有关[5]。细菌的表面抗原可与表达在单核细胞、巨噬细胞和小胶质细胞表面的Toll样受体(Toll-like receptors,TLR)相互作用,如TLR-4识别革兰阴性菌表面的脂多糖(lipopolysaccharide,LPS)等抗原,诱发一系列促炎症因子(如IL-6和TNF-α)的释放[6-7],动物脑内注射LPS能直接引发中枢炎症和抑郁症状,且常作为一种制备抑郁症动物模型的手段[8]。应激刺激还可能导致肠道通透性增加,乃至“肠漏”。因此,在抑郁状态下,肠道细菌还可自肠腔进入循环系统而诱发炎症反应[5]。MCNABNEY等[9]发现肠道有益菌群具有抗炎作用,可降低促炎症细胞因子水平,进而降低抑郁症的发病率。
小补心汤方由代赭石、旋覆花、竹叶和淡豆豉4味中药组成,前期研究证明其具有良好的抗抑郁作用[10],其总黄酮提取物(代号XBXT-2)是其抗抑郁作用的主要有效部位[11],但其抗抑郁作用机制尚不明确。本研究采用经典的慢性不可预知性应激(chronic unpredictable stress,CUS)大鼠抑郁模型,探究XBXT-2的抗抑郁作用与肠道菌群的关系,并从肠-脑轴相关免疫炎症角度进一步探究其作用机制。
1 材料与方法
1.1 药品、试剂和仪器
XBXT-2由传统中药复方小补心汤提取制备,中药饮片均购自北京同仁堂药店,代赭石∶旋覆花∶竹叶∶淡豆豉以2∶2∶1∶1(m/m)比例混合,采用以芦丁为标准的比色法测定XBXT-2中的表观黄酮含量为76.0%,具体提取制备和检测方法见文献[12]。盐酸氟西汀(fluoxetine,FXT)由常州制药有限公司惠赠,批号:20100801;BCA蛋白定量试剂盒购自美国Pierce公司;牛血清蛋白(borineserum albu⁃min V,BSA)购自美国Biotopped公司;小鼠抗大鼠TLR-4单克隆抗体购自美国Santa Cruz公司;兔抗大鼠离子钙接头蛋白分子1(ionized calcium bind⁃ingadaptor molecule-1,IBA-1)单克隆抗体购自美国CST公司;大鼠抗大鼠IL-10单克隆抗体购自英国Abcam公司;大鼠IL-1β,IL-6和TNF-α ELISA试剂盒购自美国Invitrogen公司。脱色摇床由海门其林贝尔仪器制造有限公司生产;电子天平由德国Sartorious公司生产;Mill-Q超纯水系统由美国Millipore公司生产;蛋白电泳装置由美国Bio-Rad公司生产;化学/荧光发光成像系统由美国Alpha Innotech公司生产;超声波破碎仪由美国Sonic公司生产;DYY-7C型电泳仪电源由北京六一仪器厂生产;Victor3型全自动酶标仪由美国Molecular DeviceS公司生产;冷冻式高速离心机由日本KUBOTA(3500)公司生产。
1.2 实验动物
Wistar大鼠,雄性,SPF级,220~240 g,购自北京维通利华实验动物有限公司,许可证:SCXK(京)2016-0006。饲养于军事医学研究院行为学实验动物中心。饲养环境温度21~24℃,湿度40%~70%,该动物实验通过军事科学院军事医学研究院毒物药物研究所行为药理学研究中心实验动物伦理审查。动物在饲养环境适应2 d后开始实验。
1.3 糖水偏爱实验
实验前先进行糖水训练:首先同时给予装有1%蔗糖水的2个相同的水瓶,每8 h互换瓶子位置,共3次;而后动物禁食,将其中一个水瓶内换成同体积纯净水,每8 h互换两瓶子的位置,共5次。训练后开始测试:大鼠禁食禁水8 h,而后同时给予装有1%蔗糖水和同体积纯净水的2个水瓶,令大鼠自由饮用1 h,通过称取测试前后水瓶的质量,分别检测大鼠对糖水和纯净水的饮水量(g),计算糖水偏爱率。糖水偏爱率(%)=糖水的饮用量/(糖水的饮用量+纯净水的饮用量)×100%)。应激程序结束后同方法再次测量大鼠糖水偏爱率[13]。
1.4 CUS大鼠抑郁模型的制备
参考PAPP等[14]的方法制备大鼠CUS模型。连续35 d每天给予1~2种刺激,并尽量使应激刺激符合不可预测性的特点。大鼠适应2 d后,按1.3测定基础糖水偏爱率水平,并依据该指标均衡分为正常对照组、模型组、FXT 10 mg·kg-1组和XBXT-2 100 mg·kg-1治疗组,每组10只。正常对照组给予正常食物和水,随机给予模型组、FXT组、XBXT-2组大鼠以下刺激:夹尾2 min、45°倾斜笼饲养24 h、禁食24 h、禁水24 h、电击2次(每次时长20 s,间隔20 s)、制动2 h、孤独饲养12 h、通宵照明12 h、连续避光24 h、潮湿饲养24 h、冷水游泳(水温8~10℃)5 min等。于应激第一天开始ig给药,每日1次。每天称量大鼠体质量,应激程序结束后观察大鼠抑郁样行为变化,而后处死,取海马和结肠组织样本进行相应检测。
1.5 旷场实验
应激程序结束后3 d进行旷场实验。采用圆形敞箱,直径80 cm,高30 cm,底面用黑线分为18个面积相近的扇形。实验时将大鼠从敞箱相同一角放入,记录大鼠5 min内的爬行格数(穿越底部方格数,穿越1格为1分)、站立次数(两前肢离地或爬墙壁)及首次进入中心区的潜伏期。
1.6 新奇抑制摄食实验
应激程序结束后5 d进行新奇抑制摄食实验。采用方形敞箱(76 cm×76 cm×46 cm),中心放有30个大小相等的食丸。观测时光线明亮。大鼠禁食48 h后从敞箱相同一角放入,记录5 min内的摄食潜伏期(开始咬食食丸,而不是仅嗅或玩弄食丸)。
1.7 ELISA法检测海马IL-1 β和IL-6及结肠IL-1 β和TNF- α表达水平
分别将大鼠海马和结肠组织样品研磨、离心,制备组织匀浆液,按试剂盒说明书步骤操作,用酶标仪于450 nm波长测定吸光度值(A450nm),通过标准曲线计算各组样本炎症因子浓度。
1.8 Western印迹法检测海马IBA-1和TLR-4及结肠IBA-1,TLR-4和IL-10表达水平
分别将大鼠海马和结肠组织研磨、离心、定量,制备组织匀浆液,加入5×上样缓冲液,沸水浴变性5~10 min,-80℃冻存备用。30 μg组织总蛋白在12%的SDS-聚丙烯酰胺凝胶中电泳分离,半干式电转印至PVDF膜,5%脱脂奶粉室温封闭1 h,加一抗〔IBA-1(1∶1000);IL-10(1∶500);β肌动蛋白(1∶5000)〕,4℃孵育过夜,加酶标二抗〔山羊抗兔IgG(1∶3000);山羊抗小鼠IgG(1∶3000);山羊抗大鼠IgG(1∶1000)〕室温孵育1 h,用Alpha Innotech凝胶成色系统显色成像。采用AlphaView SA软件进行分析处理,以目标蛋白与内参蛋白积分吸光度比值表示目标蛋白相对表达水平。
1.9 Illumina Miseq PE300高通量测序与微生物多样性分析检测结肠内容物菌群组成
于抑郁行为学实验结束后将大鼠处死,立即解剖下腹部,取结肠部位成形粪便分置于无菌冻存管中,迅速置液氮中,后转移冻存于-80℃冰箱。由上海美吉生物医药科技有限公司利用Illumina Miseq PE300高通量测序完成。MiSeq测序得到的PE reads首先根据overlap关系进行拼接,同时对序列质量进行质控和过滤,区分样本后进行OTU聚类分析和物种分类学分析,基于qiime软件进行主成分分析、β-多样性和物种丰度等分析。
1.10 统计学分析
实验结果数据以±s表示,用GraphPad Prism 6.0软件进行统计分析,组间比较采用Students′t检验,P<0.05表示差异具有统计学意义。
2 结果
2.1 XBXT-2对CUS模型大鼠抑郁行为的影响
行为学实验结果(图1)显示,与正常对照组相比,慢性应激刺激5周后,模型组大鼠糖水偏爱率和旷场实验站立次数显著降低(P<0.05),首次进入旷场中心区的潜伏期和新奇抑制摄食潜伏期显著延长(P<0.05)。与模型组相比,FXT组和XBXT-2组大鼠糖水偏爱率和旷场实验站立次数显著增加(P<0.05);首次进入中心区的潜伏期和新奇抑制摄食潜伏期显著降低(P<0.05)。提示XBXT-2在大鼠CUS模型中具有显著的抗抑郁和抗焦虑作用。
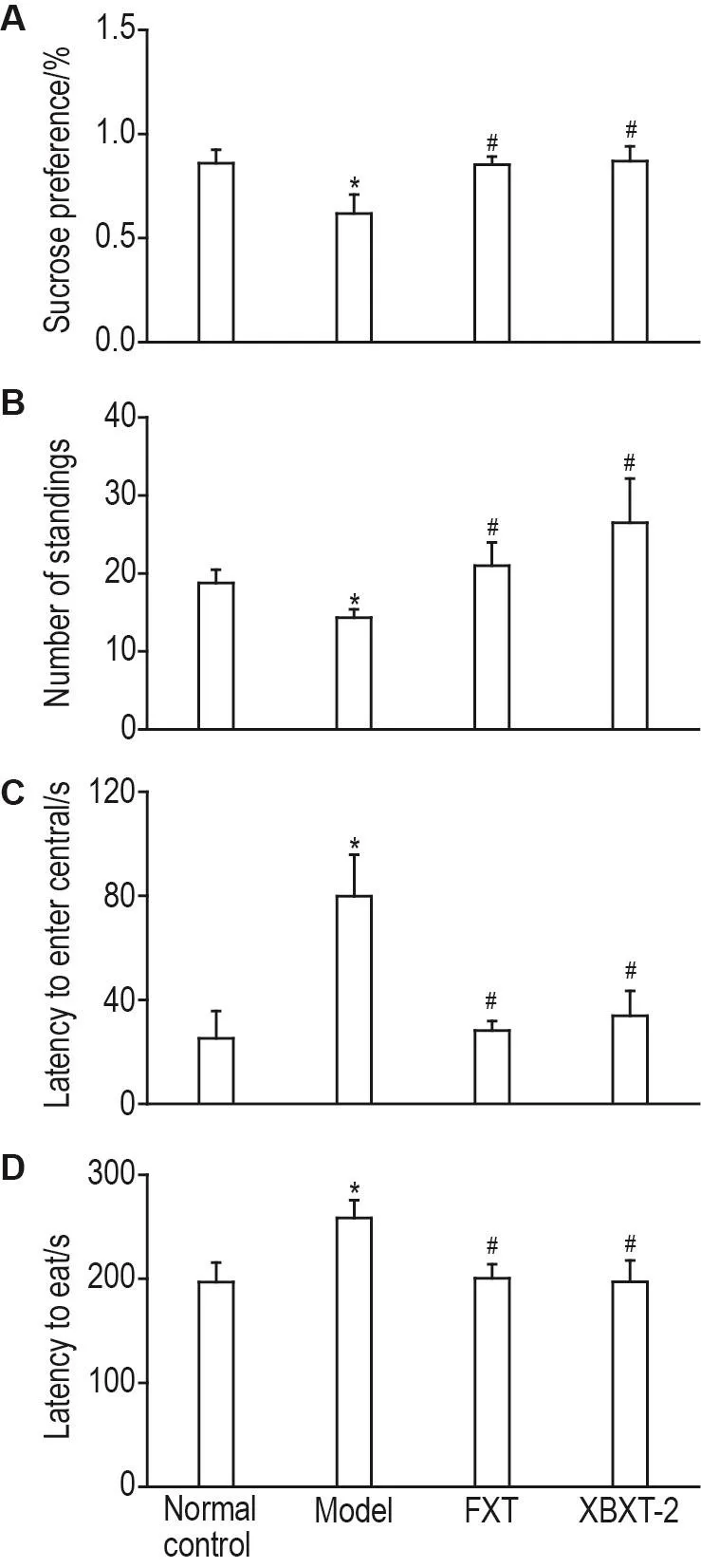
Fig.1 Effect of total flaconoids extracted from Xiao⁃buxin-Tang(XBXT-2)on depression-like behaviors in chronic unpredictable stress(CUS)rats by sucrose preference test(A),open field test(B and C)and novelty suppressed feeding test(D).The rats were subjected to separation and multiple stressors such as fasting,water depriva⁃tion and dampness for 35 d to establish the CUS model.The rats were ig given water(control and model group),FXT 10 mg·kg-1(FXT group)or XBXT-2 100 mg·kg-1(XBXT-2 group)once per day for consecutive 35 d.±s,n=8-10.*P<0.05,compared with normal control group;#P<0.05,compared with model group.
2.2 XBXT-2对CUS模型大鼠肠道菌群组成的影响
肠道菌群测序分析结果(图2)显示,与正常对照组相比,模型组大鼠肠道厚壁菌门(Firmicutes)/拟杆菌门(Bacteroidetes)的相对丰度比值增大,乳酸杆菌科(Lactobacillaceae)、毛螺菌科(Lachno⁃spiraceae)细菌比例升高,鼠杆菌科(Muribacula⁃ceae)、瘤球菌科(Ruminococcaceae)细菌比例降低;与模型组相比,FXT和XBXT-2组大鼠肠道厚壁菌门/拟杆菌门的相对丰度比值减小,XBXT-2组大鼠肠道乳酸杆菌科和毛螺菌科细菌比例降低,鼠杆菌科和瘤球菌科细菌比例升高,FXT组大鼠肠道鼠杆菌科和乳酸杆菌科细菌比例升高,毛螺菌科细菌比例下降。β-多样性分析结果(图3)显示,各组大鼠各样本菌群结构有明显的聚类特点。

Fig.2 Effect of XBXT-2 on gut microbiota composi⁃tion at phylum level(A)and family level(B)in CUS rats by species composition analysis.See Fig.1 for the rat treatment.n=8-9.
结果(表1)显示,与正常对照组相比,模型组结肠有益菌如红椿菌科(Coriobacteriaceae)、杜博斯拉菌属(Dubosiella)显著减少(P<0.05),致病菌紫单孢菌属(Muribaculum)显著增加(P<0.05);与模型组比较,XBXT-2组有益菌红椿杆科、杜博斯拉菌属显著增加(P<0.05),紫单胞菌属显著减少(P<0.05);FXT-10组有益菌显著增加(P<0.05),紫单胞菌属显著减少(P<0.05)。

Fig.3 Effect of XBXT-2 on β-diversity analysis in CUS rats by species comparative analysis.See Fig.1 for the rat treatment.Principal coordinate analysis(PCoA)based on unweighted UniFrac distances of gut microbiota from the four rat groups is shown.The percentage of PCoA1 and PCoA2 ordinate reflects the relative level of species composi⁃tion in each sample area.If the species composition of the sample is more similar,the distance reflected in the PCoA map will be closer.n=8-9.
2.3 XBXT-2对CUS模型大鼠海马中IBA-1,TLR-4,IL-1 β和IL-6表达水平的影响
Western印迹结果(图4)表明,与正常对照组相比,模型组大鼠海马IBA-1和TLR-4水平显著升高(P<0.05);与模型组比较,XBXT-2组大鼠海马IBA-1和TLR-4水平显著降低(P<0.05)。ELISA实验结果(图5)表明,与正常对照组相比,模型组大鼠海马IL-1β和IL-6水平显著升高(P<0.05);与模型组比较,FXT和XBXT-2组大鼠海马IL-1β和IL-6水平显著降低(P<0.05)。
2.4 XBXT-2对CUS模型大鼠结肠中IBA-1,TLR-4,IL-10,IL-1 β和TNF- α表达水平的影响
Western印迹结果(图6)表明,与正常对照组相比,模型组大鼠结肠中IBA-1和TLR-4水平显著升高(P<0.05),IL-10水平显著降低(P<0.05);与模型组比较,XBXT-2组大鼠结肠中IBA-1和TLR-4水平显著降低(P<0.05),IL-10水平显著升高(P<0.05)。ELISA实验结果(图7)表明,与正常对照组相比,模型组大鼠结肠IL-1β和TNF-α水平显著升高(P<0.05);与模型组比较,XBXT-2组大鼠结肠IL-1β和TNF-α水平显著降低(P<0.05)。
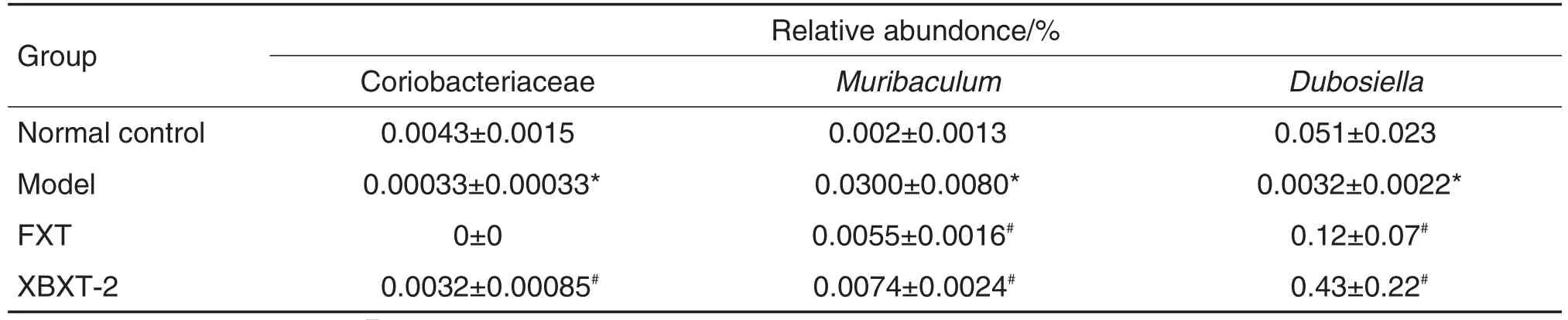
Tab.1 Effect of XBXT-2 on gut microbiota composition at gene level in CUS rats by species composition analysis
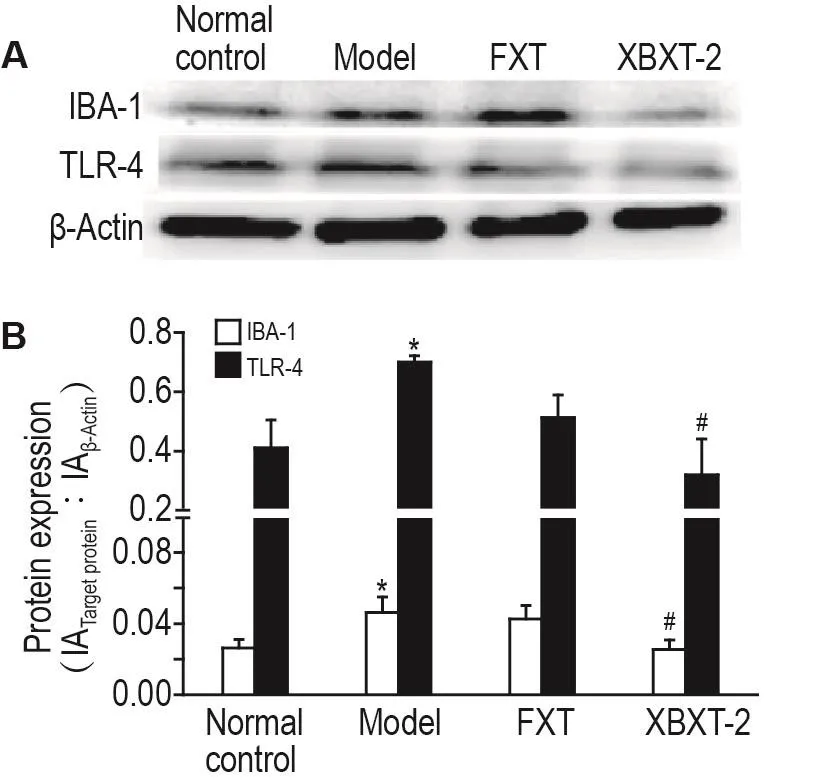
Fig.4 Effect of XBXT-2 on levels of ionized calcium bindingadaptor molecule-1(IBA-1)and Toll-like recep⁃tor 4(TLR-4)in hippocampal of CUS rats by Western blotting.See Fig.1 for the rat treatment.B was the semi-quan⁃titative result of A.±s,n=3-4.*P<0.05,compared with normal control group;#P<0.05,compared with model group.

Fig.5 Effect of XBXT-2 on levels of interleukin-1 β(IL-1 β)and IL-6 in hippocampal of CUS rats by ELISA.See Fig.1 for the rat treatment.±s,n=3-4.*P<0.05,compared with normal control group;#P<0.05,##P<0.01,compared with model group.
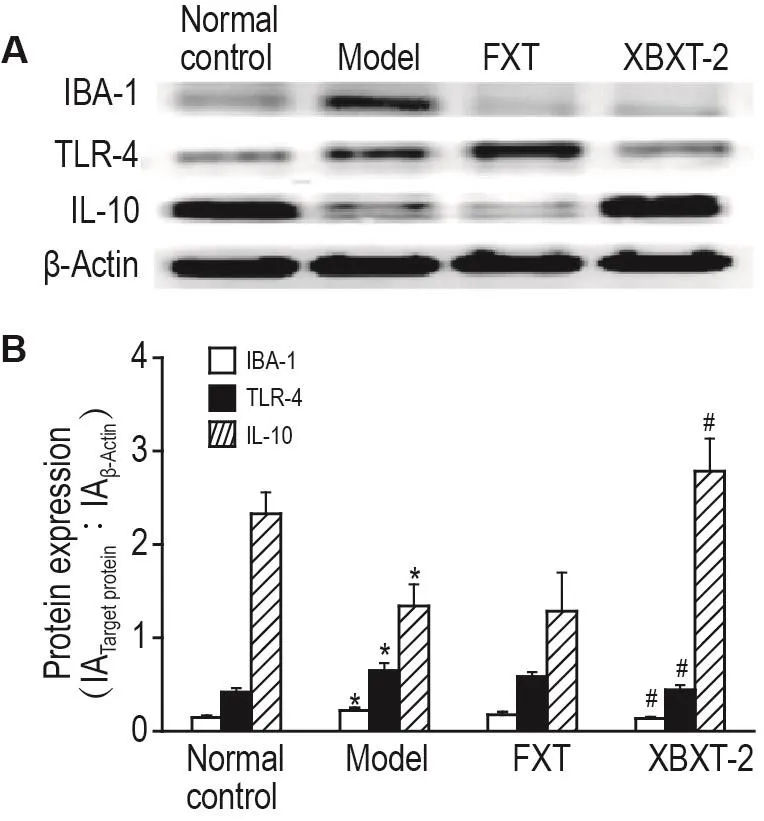
Fig.6 Effect of XBXT-2 on levels of IBA-1,TLR-4 and IL-10 in colon of CUS rats by Western blotting.See Fig.1 for the rat treatment.B was the semi-ququantitative result of A.±s,n=3-4.*P<0.05,compared with normal control group;#P<0.05,compared with model group.

Fig.7 Effect of XBXT-2 on levels of IL-1 β and TNF- α in colon of CUS rats by ELISA.See Fig.1 for the rat treat⁃ment.±s,n=3-4.*P<0.05,compared with normal control group;#P<0.05,compared with model group.
3 讨论
XBXT出自南北朝陶弘景所著的敦煌莫高窟《辅行诀脏腑用药法要》,原方用于气血不足导致心包络虚。本课题组前期发现,该方具有抗抑郁作用[12],其乙醇提取物XBXT-2是其抗抑郁的活性成分。本研究结果显示,XBXT-2可显著升高CUS模型大鼠糖水偏爱率和旷场实验中站立次数;降低CUS模型大鼠的新奇抑制摄食潜伏期、旷场实验中首次进入中心区的潜伏期,进一步明确了XBXT-2的抗抑郁和抗焦虑作用。
中药以植物成分为主,多数以口服形式进入消化道,肠道菌群对中药的代谢吸收有着重要的作用,同时许多中药对肠道菌群的平衡产生影响,因此,中药的起效机制可能与肠道菌群关系密切。多项研究提示,黄酮类植物成分可影响肠道菌群。GAO等[15]通过超临界二氧化碳萃取罗布麻中黄酮化合物发现其具有抗菌活性;CHEN等[16]研究发现,青钱柳黄酮能有效促进肠道中有益细菌(双歧杆菌和乳酸菌)的增殖,调节人体肠道菌群。XBXT-2是XBXT发挥抗抑郁作用的药效部位,以口服形式进入消化道。本研究结果显示,XBXT-2可增加CUS模型大鼠有益菌数量,减少致病菌数量,使物种组成趋于正常,且XBXT-2对CUS模型大鼠肠道菌群的改善效应优于FXT。提示XBXT-2发挥抗抑郁作用与调节肠道菌群有关。
AHMED等[17]发现,增加具有黏附肠道上皮能力的病原菌(如黏附侵袭性大肠埃希菌)可改变肠道的通透性,造成肠道微菌群的组成和功能发生改变,并通过调节炎性因子的表达诱发炎症反应。JIAH等[18]采用社交失败抑郁模型,发现应激易感大鼠可表现出更显著的抑郁样行为,移植应激易感大鼠肠道菌群的正常大鼠,其腹侧海马中的IBA-1和IL-1β的表达水平升高,而移植非应激易感大鼠肠道菌群的正常大鼠,未表现出抑郁行为和海马炎症因子水平的变化,提示肠道菌群可通过肠-脑轴诱导抑郁样行为和炎症的产生,进而影响大鼠受应激刺激导致抑郁的易感性。LPS是细菌细胞壁的组成成分,也是一种典型的TLR-4激动剂,LPS是介导肠道菌群影响机体免疫的关键信号物质,可在肠道屏障受损状态下导致局部炎症,升高炎症因子水平,而外周TNF-α和IL-1β等炎症因子可随血液循环到达脑组织,影响脑内炎症水平[19]。STEVENS等[19]通过对抑郁症患者和健康志愿者的肠道菌群进行16S rRNA测序,发现抑郁症患者革兰阴性杆菌丰度增加,LPS生物合成基因过量表达,两者共同作用导致血浆中内毒素水平升高,引起炎症反应。以上研究提示,LPS激活TLR,是介导肠道菌群影响机体免疫的关键途径,实际上其免疫激活模型是重要的抑郁动物模型。本研究结果表明,XBXT-2可降低CUS模型大鼠结肠和海马促炎因子水平,还可降低结肠和海马免疫细胞活性和TLR-4水平,提示XBXT-2调节肠道菌群抗抑郁的作用可能与减少致炎菌与机体相互作用,进而减少肠道和脑内炎症的免疫途径有关。ZHANG[20]研究发现,黄酮类化合物可抑制小鼠体内TNF-α和IL-1β等炎症因子的分泌,并促进小鼠血清中抗炎因子IL-10的分泌,增强机体免疫功能,该研究为黄酮类药物的免疫调节作用提供支持。
本研究的结果显示,FXT在抗抑郁作用的同时,也可减轻结肠和海马免疫炎症水平,这与文献报道一致。ZHAO等[21]发现,FXT可降低抑郁大鼠血清中TNF-α和IL-6水平。JIANG等[22]发现,FXT可降低抑郁患者TNF-α和IL-6水平,即FXT在发挥抗抑郁作用的基础上可能具有抗炎作用。本研究结果发现,FXT对CUS模型大鼠结肠和海马TLR-4的表达均无显著影响,提示其减轻炎症的作用机制与XBXT-2不同,可能与肠道菌群无关。FXT减轻炎症的作用在其抗抑郁效应中的贡献尚不明确,有待进一步研究。
综上所述,XBXT-2抗抑郁作用与调节肠道菌群有关,其作用机制与减少肠道菌群与机体免疫细胞相互作用、进而减轻外周巨噬细胞和脑内小胶质细胞活化诱发的肠-脑轴免疫炎症有关。
