L-卡尼汀预防脑缺血再灌注性损伤的机制研究*
2020-11-10孙春平陈浩宇张常娥
但 丁,孙春平,陈浩宇,2,梁 路,2,徐 佳,2,张常娥,2**
(1.广州医科大学蛋白质修饰与降解实验室,广东 广州 511436;2.广州医科大学病理生理学教研室)
脑血管疾病已成为首要危害人类生命与健康的常见病和多发病之一,其中最常见的是脑卒中,分为缺血性(脑梗死)和出血性(脑出血)脑卒中两种类型,前者在临床病例中约占70%以上。研究表明,脑卒中诱因复杂且多样,多为可防控的后天性因素,如高血压、糖尿病、血脂异常、吸烟、肥胖等[1]。随着临床溶栓疗法的应用开展,发现因氧反常、pH反常、钙反常等因素[2],血流再灌注有时会加剧脑组织损伤。但恢复血流灌注是防止缺血脑组织进一步损伤的主要措施[3],如何减轻这种矛盾性的问题,目前仍是该领域研究的热点。
L-卡尼汀(L-carnitine,LC)[4]是机体内源性小分子,辅助线粒体内膜肉毒碱脂酰转移酶,参与细胞内脂质β-氧化过程产生ATP,提供生命活动所需能量。研究表明LC有预防心肌缺血性损伤的作用。本课题组曾采用Zea-Longa[5]改良线栓法构建大鼠右侧大脑中动脉脑缺血再灌注模型,对比研究了LC对大鼠局灶性脑缺血再灌注的预防和治疗作用,发现LC对脑缺血再灌注性损伤有预防作用优于治疗效果。本实验在前期的基础上,进一步研究LC对脑缺血再灌注性损伤的预防机制,为阐明脑缺血再灌注损伤的预防或治疗提供实验依据,并为相关药物开发提供一定的理论基础。
1 材料与方法
1.1 材料
1.1.1 主要仪器及型号
Denver instrument电子天平,Eppendorf 5810R型离心机,Leica 2000振荡切片机,Olympus BX51型显微镜,尼康照相机,FLOKO匀浆器,Thermo全波长多功能酶标仪,Bio-Rad电泳-转膜仪。
1.1.2 实验动物及分组
3月龄SPF级成年雄性SD大鼠72只,体质量(260±20)g。由广东省实验动物中心提供,合格证号:44007200000384/440720929。随机分成3组,每组24只,即假手术组(Sham组)、脑缺血再灌注组(I/R组)和L-卡尼汀预防组(LC组)。所有大鼠在广州医科大学动物中心正常饲养,室温(24±1)℃,湿度正常,保持12h光照/12h黑暗的光照规律。
1.1.3 药品与主要试剂
LC购自Sigma公司,DAB显色液购自南京建成生物工程研究所,大鼠白细胞介素IL-1β及肿瘤坏死因子TNF-α的ELISA检测试剂盒购自南京凯基生物公司,Bax和Bcl-2等抗体购自CST公司。其它试剂均为进口分装或国产化学分析纯。
1.2 方法
1.2.1 大鼠脑缺血再灌注(I/R)损伤模型的复制
根据Zea-Longa法进行改良,利用线栓复制大鼠右侧大脑中动脉脑缺血再灌注模型。具体手术操作方法及实验要求参照文献[6]。
1.2.2 LC药物的注射[6]
LC采用生理盐水配置成20mg/mL浓度,4℃储存备用。Sham组与I/R组,大鼠在I/R手术操作前2h和再灌注前2h腹腔注射生理盐水;LC预防组大鼠在相同时间点注射LC,剂量为200mg/kg。
1.3 检测指标
1.3.1 脑梗死体积的测量
根据改良Longa线栓法进行大鼠大脑中动脉缺血2h再灌注24h后,对所有大鼠进行进行神经行为学评分,以确定脑缺血再灌注模型是否成功,具体结果参见本课题组前期报道的文献[6]。每组随机取6只大鼠进行脑梗死体积的测量,具体操作和计算方法与文献[6]一致。
1.3.2 血清及脑组织炎症介质测定
所有大鼠用10%水合氯醛麻醉后,开胸经左心室取血,室温静置2h后,如果有溶血现象就不纳入,4℃ 3000r/min离心10min,分离血清,-20℃储存待测。大鼠取血后,断头取脑,冰生理盐水漂洗,分离右侧大脑皮质,用生理盐水制成10%脑组织匀浆,4℃,10000g离心10min,取上清液,-20℃冻存待测。ELISA法检测血清及脑组织中的TNF-α和IL-1β含量,操作方法严格按照试剂盒说明书进行。
1.3.3 脑水肿含量测定
每组取6只大鼠断头后取出全脑,去掉嗅球脑干和小脑,沿正中矢状线分开左右两侧脑半球,右侧脑组织生理盐水洗净并滤纸吸干,称脑组织湿重后,置于60℃电热恒温鼓风干燥箱中,烘干2~3d,待脑组织恒重后称其干重,计算脑组织含水量。含水量(%)=(湿重-干重)/湿重×100%。
1.3.4 脑组织形态学检测
每组取3只大鼠,4%多聚甲醛灌流固定后,取出全脑组织后固定24h。切取颞叶对应全脑区域,进行连续震荡冠状切片,厚度为20μm,置于含0.05% NaN3的0.1M PB缓冲液盐溶液中,4℃冰箱中储存备用。每只大鼠取3片切片,梯度酒精脱水,尼氏染色,常规透明、封片,光镜下观察组织病理改变并拍照分析。
1.3.5 免疫组化检测
上述每只大鼠脑组织连续切片中,每隔5片取1片,每只共取5片,用ABC法进行Bax和Bcl-2的免疫组织化学染色,DAB显色,后续拍照并进行灰度OD值分析。
1.3.6 Western-Blot检测
每组取3只大鼠取血后,断头取脑,冰生理盐水漂洗,分离右侧颞叶皮质。用蛋白裂解液提取脑组织蛋白,蛋白匀浆提取液置于-20℃冰箱中储存备用。BCA法测定组织蛋白含量,Western-Blot检测脑组织Bax和Bcl-2的表达量,并进行灰度分析。
1.4 统计学方法
2 结 果
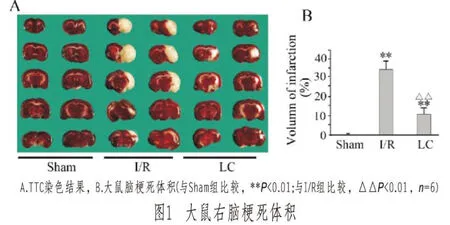
2.1 脑梗死体积结果
大鼠经过缺血2h再灌注24h后,每组取6只全脑进行TTC染色。I/R组所有大鼠右侧大脑皮层出现大面积梗死灶。通过Image J图形处理软件对梗死灶计算:假手术组无梗死,I/R组梗死灶体积百分比约为(34.50±4.32)%,两组比较差异有非常显著性(P<0.01);用LC预防后,大鼠脑梗死体积显著减少,平均为(11.13±3.13)%,与I/R组比较差异有非常显著性(P<0.01),见图1(封二)。
2.2 大鼠血清及脑组织炎症介质变化
大鼠经右侧大脑中动脉缺血2h再灌注24后,ELISA检测血清和脑组织炎症介质IL-1β及TNF-α含量。结果显示:I/R组血清和脑组织IL-1β及TNF-α含量上升,与Sham组比较有显著性差异(P<0.05或P<0.01)。LC预处理能显著降低血清和脑组织炎症介质IL-1β及TNF-α含量,LC组与I/R组比较差异有显著性(P<0.05)。见表1。
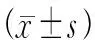
表1 各组大鼠血清、脑组织炎症介质及脑含水量变化
2.3 大鼠脑组织含水量变化
缺血再灌注损伤引起脑组织含水量增加及水肿。大鼠经过右侧大脑中动脉缺血2h再灌注24h后,取出脑组织,肉眼观察可见I/R组大鼠右侧脑组织因明显的水肿导致体积增大,颞叶区出现缺血性灰白色变化;LC组大鼠经过2次LC 200mg/kg注射后,脑组织水肿和颜色变化程度比I/R组大鼠明显减轻。脑组织经过60℃烘烤,分析和计算其湿重和干重之比,发现I/R组大鼠脑组织含水量显著增加,与Sham组比较有显著性差异(P<0.05),经LC预处理后,脑组织含水量显著减少,与Sham组比较差异无显著性(P>0.05),与I/R组比较差异具有显著性(P<0.05),见表1。
2.4 尼氏染色结果
每组选取3只大鼠,每只选取3片进行尼氏染色。普通光镜下,尼氏小体为紫色。右侧颞叶皮质神经元的尼氏结果显示:Sham组尼氏小体染色均一,神经元结构完整,排列整齐,无坏死,细胞间隙致密无水肿。I/R组神经元数量显著减少,排列紊乱,神经元胞体变小,尼氏小体减少,胞质染色变浅或浓缩,胞核出现固缩、碎裂或溶解等。LC组大部分神经元细胞结构完整,部分细胞存在肿胀,可见散在的坏死组织,细胞间轻微水肿。见图2(封二)。
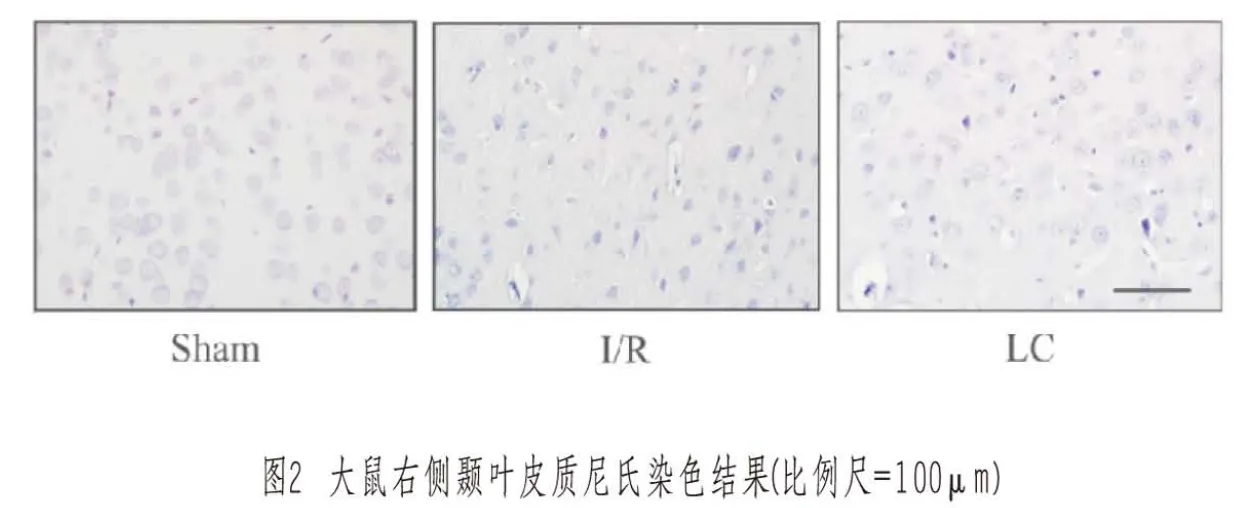
2.5 大鼠脑组织Bax和Bcl-2的变化
每只大鼠选取5片脑组织切片,用Bax和Bcl-2抗体进行免疫组化染色,拍照进行分析。Bax抗体的免疫组化结果显示:Sham组大鼠脑皮质神经元结构清晰完整,细胞排列密集整齐,细胞浆无棕色染色,细胞核居中,核仁清楚;I/R组大脑皮层颞叶部位神经元数量减少,神经元结构紊乱,排列不整齐,大部分神经元可见深棕色染色,部分区域出现核固缩、碎裂、细胞溶解等坏死现象,间质水肿严重,经脱水后出现大量的空洞。LC组可见部分神经元呈现浅棕色染色,神经元结构排列较整齐,细胞核比较完整,可见少量神经元损伤和坏死现象,间质存在少量水肿。Bcl-2抗体的免疫组化染色结果与Bax相反,神经元的结构排列和损伤则相类似。见图3(封二)。
每组随机选取3只大鼠右颞叶皮质,用组织蛋白裂解液制成10%的脑组织匀浆,Western-blotting法检测脑组织Bax和Bcl-2的变化。结果显示:与Sham组比较,I/R组脑组织Bax表达量显著增多,Bcl-2表达则显著性减少,经灰度分析两组有显著性差异(分别为P<0.01,P<0.05);而用LC预防后,显著性改变了上述Bax和Bcl-2在脑组织中的表达水平。见图4。
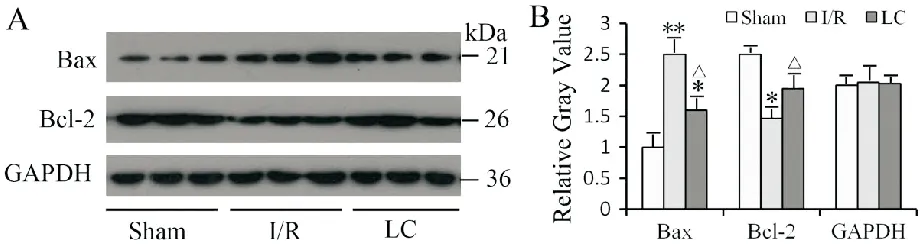
A.Western-blotting法检测脑组织Bax和Bcl-2结果;B.Western-blotting法检测脑组织Bax和Bcl-2结果相对灰度值(与Sham组比较,*P<0.05,**P<0.01;与I/R组比较,△P<0.05;n=3)
3 讨 论
在临床脑血管病中,缺血性脑血管病具有高发病率、致残率及死亡率的特点,是人类三大死亡原因之一[7],给社会和家庭带来了沉重的经济负担。脑缺血超过一定时限后发生缺血性损伤,严重时出现脑梗死,恢复缺血脑组织的血流是防止脑梗死的必要措施。临床研究指出,灌注液的流量、Na+/Ca2+比值、pH值及线粒体膜的稳定性[8]等多种条件均能影响I/R所引起的损伤程度。因此,预防脑缺血后再灌注引起的后续损伤在脑卒中防治方面具有重要意义。
LC在机体内主要提高组织器官脂肪酸代谢水平[4]。据报道[9]:LC能促进心肌细胞能量代谢,降低Ca2+超载水平,对心肌缺血再灌注损伤有一定的预防和治疗作用。LC在肾脏中也能促进脂肪酸氧化供能过程[10],但较少报道LC在脑组织中的作用。本课题组曾报道[6],大鼠右侧大脑中动脉线栓法构建脑缺血再灌注模型,缺血2h后拔出线栓,大脑中动脉血流由大脑前动脉供应恢复再灌注,大鼠出现严重皮质神经元损伤,右眼睑肌张力下降,无法直线行走,出现咬尾或转圈现象;恢复血液灌注24h后,大鼠的行为表现持续存在。经检测血浆和脑组织各项指标检测发现:对比I/R组,LC组脑组织中ATP含量显著升高,血浆和脑组织中SOD活力增加,MDA的含量下降。这些结果说明LC预防性给药后,大鼠脑组织能量代谢水平和抗氧化能力增强,这可能是LC预防大鼠脑I/R损伤的部分机制。
为了探讨LC预防大鼠脑缺血再灌注性损伤是否存在其它机制,本实验在前期动物模型和给药方法的基础上,做了进一步研究。发现大鼠脑缺血再灌注24h后,I/R组大鼠脑组织炎症反应和含水量显著增加,尼氏染色和免疫组化结果显示:梗死灶的中央区域有大量的细胞坏死溶解,部分细胞出现明显的凋亡特征, Western-blotting结果进一步证实脑组织促凋亡相关蛋白Bax表达增多,而抑凋亡相关蛋白Bcl-2减少。这些结果说明了大鼠局灶性脑缺血后,脑组织缺血缺氧引起的组织损伤,并不能因为血液再灌注而改善,反而容易触发炎症反应导致脑水肿,增加神经元凋亡程度,表明再灌注加重大鼠脑组织的缺血性损伤。LC组通过脑缺血前2h和再灌注前2h分别腹腔注射200mg/kg的LC,相比于I/R组,脑组织的炎症反应和水肿轻度明显减轻,尼氏染色和免疫组化结果均表明LC组脑间质水肿及梗死区域减轻,凋亡神经元减少,WB显示促凋亡蛋白Bax表达水平减少,而抗凋亡蛋白Bcl-2表达升高。上述结果表明LC有抗炎、减轻脑组织水肿和抗凋亡作用,从而进一步阐明了LC预防大鼠脑缺血再灌注性损伤的机制。
综合本课题组的研究发现可以阐明:LC对脑缺血再灌注性损伤的预防机制可涉及到提高能量代谢、抗氧化、抗炎、抗水肿和抗凋亡等几个方面。至于LC预防脑缺血再灌注损伤更深层的分子生物学机制,如代谢相关通路的激活以及其调控凋亡相关通路的方式,尚需要进一步研究来阐明。本研究可以为临床上LC预防脑缺血再灌注损伤提供一定实验依据,为LC是否可以作为脑缺血的治疗药物提供一定理论指导。
