高压氧联合脑苷肌肽对创伤性颅脑损伤患者血清NSE、sFas的影响
2020-11-10孟彦丽董自平李哲敏胡洁宋海红宋建亭李滨
孟彦丽 董自平 李哲敏 胡洁 宋海红 宋建亭 李滨
随着现代化生活中不可避免的出现交通意外、外伤、乃至地区战争冲突等因素,导致创伤性颅脑损伤(traumatic brain injury,TBI)发生率居高不下。TBI是指由钝性、穿透性、加速或减速力源性导致的颅脑损伤,除其作为全球40岁以下人群致死的主要因素之外,还表现出意识水平下降、意识不清、记忆力减退或遗忘及其他神经心理异常等症状[1]。TBI由于疾病的病理生理学特征,使其一直以来都是急诊外科、神经外科领域内的急重症。患者的人群特征虽然以中青年较多,但仍具有随机分布特征。且TBI具有高致死率、高致残率使得虽然对于它的病理生理学认识和治疗策略不断进步,但针对TBI的救治对于临床医生仍旧是难题[2,3]。作为神经疾病的治疗手段之一,高压氧治疗(hyperbaric oxygen therapy,HBOT)在颅脑损伤治疗方面,其有效性与安全性被众多临床研究所证实[4-6]。HBOT对于神经疾病的疗效包括能抑制细胞凋亡、抑制炎症、保护血脑屏障的完整性、并促进血管生成和神经发生等多方面[7,8]。脑苷肌肽为多种神经节苷脂以及多肽组成的复方制剂,作为脑神经细胞再生发育的必需物质之一,神经节苷脂在临床实践中也表现出对脑神经损伤修复的有效临床效果[9,10]。在临床实践中,将两种治疗方法应用于TBI患者的救治中是否会产生更好的临床疗效,能否将这一疗法广泛应用,笔者所见并没有有效证据对其支撑。因此,本研究回顾性总结2018年1~12月我院收治的86例TBI患者临床资料,收集患者入院治疗期间的血液样本,研究不同治疗方案下患者血清神经元特异性烯醇化酶(neuron-specific enolase,NSE),可溶性凋亡相关因子(soluble factor-related apoptosis,sFas)在患者治疗过程中的变化,同时通过病例对照的方法评价HBOT联合脑苷肌肽治疗TBI患者的临床疗效,报告如下。
1 资料与方法
1.1 一般资料 本研究共纳入86例患者,其中治疗组44例,对照组42例。在TBI治疗过程中采用HBOT联合脑苷肌肽治疗的患者为治疗组,单纯使用脑苷肌肽患者为对照组。2组患者年龄、性别比、体重指数(BMI值)、受伤时间差异无统计学意义(P>0.05),具有可比性。本研究所有患者资料均由患者本人或患者家属签署知情同意书,本研究通过医院伦理委员会审核。见表1。

表1 患者基本资料
1.2 纳入标准 (1)疾病诊断为TBI,包括硬膜下血肿、硬膜外血肿、混合性血肿、脑内血肿、脑挫裂伤等。(2)年龄≥18岁。(3)受伤前无其他严重心、脑、肾等疾病以及癌症等严重慢性疾病。(4)病历资料完整。
1.3 治疗方法 2组患者均采用降颅压、抗感染、解痉挛、维持生命体征等常规治疗。根据病情选择是否进行外科手术。2组患者均使用脑苷肌肽注射液(吉林四环制药有限公司)治疗,10 ml脑苷肌肽注射液于500 ml 0.9%氯化钠溶液中静脉滴注,1次/d。治疗组患者接受HBOT治疗,治疗条件:治疗组患者进入空气加压舱,治疗压力为2.0 ATA,加压过程20 min,患者病情稳定且无气管切开患者戴面罩吸氧70 min(中间不休息,氧浓度99.5%);患者行气管切开或气管插管治疗,接受开放式头罩或舱内呼吸机进行HBOT治疗;减压过程30 min。患者每天治疗1次,10次为1个疗程,住院期间接受3个疗程治疗。患者发生病情不稳定,如感染加重等情况时,暂停HBOT治疗。
1.4 观察指标 比较2组患者住院时间;入院治疗30 d后进行格拉斯哥昏迷评分(glasgow coma scale,GCS)评分,与入院时GCS评分进行比较,比较2组患者30 d内GCS评分变化。GCS评分包括睁眼反应、言语反应和运动反应3项指标。患者反应以各项数字总和来表示,轻度13~15分,中度9~12分,重度3~8分。
1.5 患者血液采集与储存 采集患者入院时、治疗2 d、治疗7 d、治疗14 d时静脉血液样本。
1.6 实验材料 酶标仪(Olympus公司);离心机(Eppendorf公司);人NSE ELISA检测试剂盒(北京方程生物科技有限公司);人Fas ELISA检测试剂盒(北京方程生物科技有限公司);离心管;冻存管;移液器等。
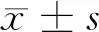
2 结果
2.1 2组患者疾病种类 TBI损伤主要包括硬膜外、硬膜下和混合型血肿,脑内血肿和脑挫裂伤。见表2。

表2 患者的TBI分类 例
2.2 2组患者入院时GCS评分情况 2组患者入院时GCS评分差异无统计学意义(χ2=1.733,P值=0.267)。见表3。
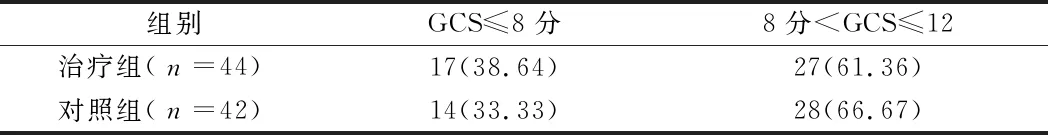
表3 2组患者入院时GCS评分情况 例(%)
2.3 2组患者血清NSE变化情况 2组患者入院时NSE水平差异无统计学意义(P>0.05);治疗2 d、7 d、14 d时;治疗组NSE水平明显高于对照组,差异有统计学意义(P<0.05)。见表4。

表4 2组患者血清NSE变化情况
2.4 2组患者血清sFas变化情况 2组患者入院时sFas差异无统计学意义(P>0.05);治疗2 d、7 d、14 d时,治疗组sFas水平明显高于对照组,差异有统计学意义(P<0.05)。见表5。

表5 2组患者血清sFas变化情况
2.5 2组患者住院时间比较 治疗组患者住院时间较对照组明显缩短,差异有统计学意义(P<0.05)。见表6。
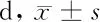
表6 2组患者住院时间比较
2.6 2组患者GCS评分变化比较 根据GCS评分,参照GCS患者病情程度划分标准,将所有患者分为<8分,8~12分,>12分3个级别。根据评分规则分别为严重(GCS评分≤8分),适中(8分
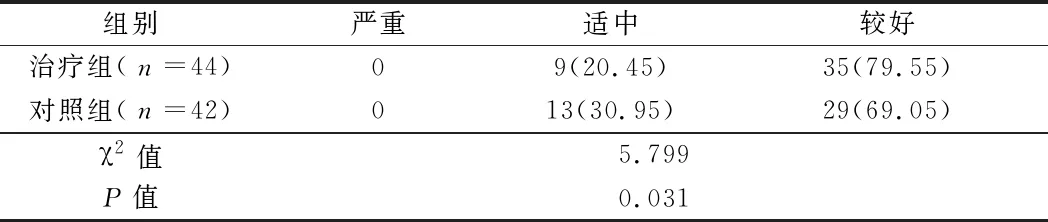
表7 2组患者入院治疗30 d后GCS评分变化比较 例(%)
3 讨论
随着人类社会活动、交通事故的增加,TBI患者的致死率、致残率较高,住院周期长,幸存者也可能因为颅脑损伤而在肢体活动、认知心理等方面存在生活障碍,为患者家庭,社会带来负担[3,10]。在这一背景下,针对TBI的有效治疗意义重大。
TBI发生后,脑组织缺血缺氧诱发一系列病理生理过程,包括脑血管痉挛、脑组织氧分压降低、血氧弥散距离缩短和脑水肿,进而炎性因子和氧自由基的释放、炎性反应与氧化应激损伤的发生,兴奋性氨基酸的产生进一步加剧脑组织损伤等。而采用HBOT可以对上述过程起到抑制甚至逆转的效应[11]。颅脑损伤后的血管再生有助于促进侧支循环建立,改善脑组织缺血缺氧。有动物实验表明,HBOT促进了VEGF mRNA的表达,增加模型动物海马区新生血管密度,从而缓解脑组织损伤[12]。亦有动物实验表明HBOT对于TBI模型动物会产生70kDa热休克蛋白(HPS-70)过表达,并减轻脑水肿,海马区的氧化损伤和模型动物的认知功能障碍[13]。脑苷肌肽的主要成分为神经节苷脂和小分子多肽。神经节苷脂易通过血脑屏障,通过提高神经细胞表面的Na+-K+-ATP酶活性,减轻细胞内钙超载和脂质过氧化作用起到稳定神经细胞膜结构的作用[14];同时,可以抑制神经细胞释放兴奋性氨基酸,加速受损脑细胞修复,减轻脑细胞水肿。有研究发现脑苷肌肽可以降低TBI大鼠血清中相关炎性因子的水平,抑制炎性反应与神经细胞凋亡的发生,起到保护神经细胞的作用[15-18]。同时,亦有研究显示在我国的临床实践中,脑苷肌肽在治疗脑卒中、脑血管疾病的安全性与有效性[19-21]。
本研究在TBI治疗过程中,将HBOT和脑苷肌肽联合应用作为治疗手段,观察患者治疗过程中血清NSE、sFas的变化趋势,同时对比该治疗方法在患者疾病恢复过程中的效果。NSE是神经元特异性烯醇化酶,是主要参与糖酵解过程的烯醇化酶之一,在脑组织中活性最高。NSE的升高广泛见于小细胞肺癌和神经内分泌肿瘤,除此之外,NSE在血清中的升高可以反应脑部缺氧状态的大量脑组织受损导致的NSE释放入血。sFas是可溶性凋亡相关因子。生理状态下,细胞凋亡参与体内细胞数量的调节,维持组织正常功能和细胞群体的稳态;病理生理条件下,由于机体受到损伤病理因素导致死亡信号释放,激活相关的凋亡信号通路,使得凋亡被不断增强。本研究结果表明,高压氧治疗联合脑苷肌肽对于TBI患者可以更好地抑制TBI造成的细胞死亡发生;及时的使用高压氧联合脑苷肌肽治疗可以有效地提升GCS评分,缩短患者住院时间。
本研究仍存在一定的局限性和不足之处,仅通过ELISA法对患者血清中NSE和sFas蛋白进行了测定,受到实验周期和经费等多因素限制没有更深入地对患者生物样本进行实验,针对于患者临床数据的研究类型为单中心回顾性的病例对照研究。受到研究周期以及入组患者数量的限制,并没有做多层多因素的统计学分析。针对TBI这一全球性的公共卫生问题,和目前亟待提高的患者治疗结局,治疗的手段和方法涵盖了常规药物治疗,HBOT,亚低温治疗,中成药治疗,针灸以及电刺激等疗法。各种治疗手段都以解除脑组织病理生理过程,留存脑组织和神经细胞存活为目的。针对TBI的各种联合疗法究竟哪一种能够使得患者获得早期以及中长期的临床受益以未来生活质量的不断提高,仍然是今后包括急诊外科、神经外科、重症医学科研究的热点和重点。
综上所述,对于TBI患者HBOT联合脑苷肌肽的治疗手段可以有效抑制神经细胞的死亡、更好地改善患者GCS评分,使病情得到更快缓解。相对于单纯使用脑苷肌肽,可以缩短患者住院时间,产生更好的临床疗效。
