水稻早衰突变体wl4的鉴定和病程相关基因表达分析
2020-11-09朱永生徐靖蒋家焕郑燕梅陈丽萍蔡秋华王爱荣张建福
朱永生 徐靖 蒋家焕 郑燕梅 陈丽萍 蔡秋华 王爱荣 张建福

摘要:[目的]叶片早衰影响水稻的产量和品质,早衰突变体是研究水稻衰老机制的良好载体,鉴定、分析早衰突变体的表型特征,有助于了解突变体的遗传规律,为相关基因的克隆和功能研究奠定基础。[方法]人工接种鉴定了早衰突变体wl4的稻瘟病和水稻白叶枯病抗性,同时通过对离体叶片的黑暗诱导和叶绿素含量测定,鉴定了突变体wl4的早衰表型;再分别对早衰突变体w14和野生型梗稻品种云引(简称'YY')中水稻早衰相关基因和病程相关基因的表达进行分析,研究早衰突变体wl4的早衰类型及与野生型在防御系统上的差异。[结果]黑暗诱导处理24h后,突变体w14的叶绿素含量显著低于野生型YY(P《0.05)。黑暗诱导处理48h以上,突变体wl4的叶绿素含量极显著低于野生型YY(P《0.01)。突变体wl4中衰老相关基因sGR、Osh36、Osh69、PAO、NYC3和RCCRl的表达均显著高于野生型YY。分别接种水稻白叶枯和稻瘟病后,突变体wl4均表现为比野生型YY更感病,且病程相关基因PRla、PR4、CthI、PR1b、PBZ1、PR3等的表达在突变体中显著上调。[结论]突变体wl4具有典型的衰老和感稻瘟病、水稻白叶枯病的表型,与野生型相比,在突变体中与病程相关基因的表达发生了显著改变,即突变体防御系统的改变导致其出现感病的表型。
关键词:水稻;突变体;早衰;叶绿素;抗病性;基因表达
中图分类号:S511
文献标志码:A
文章编号:1008-0384(2020)06-0626-07
0引言
[研究意义]水稻是单子叶模式植物,也是全世界最主要的粮食作物之一,在农业生产中,水稻等禾谷类作物的产量95%来自叶片光合作用。水稻功能叶一旦在其灌浆的中后期出现早衰,将极大影响到种子发育过程中的糖类和其他碳水化合物的积累,从而对产量和品质均造成较大的影响。通过深人研究水稻叶片早衰的分子机理,特别是水稻发生早衰后的一些重要性状的遗传和生理特性的变化,不仅可以从分子水平阐释植物的生长发育和衰老的规律,探寻可行的延缓植物衰老的方法,也能通过基因工程等手段调控影响水稻重要性状(如抗病性等)的基因,对培育抗病、高产、优质水稻新品种具有重要的应用价值。[前人研究进展]衰老是植物生長发育的最后一个阶段,同时受到遗传基因与外界环境的影响。在植物衰老过程中,叶片等器官中的营养物质会转移到生殖器官,这是植物在漫长的进化过程中建立的一种自我保护形式。后时,植物的自然衰老也可提高对环境的适应能力,是其生长发育的重要生命历程。目前的研究结果表明,植物衰老是一个较为复杂的生命过程,涉及多种代谢途径”。近年来,通过基因定位与克隆、全基因组分析等方法,已构建了植物衰老分子调控网络的部分结构,但其复杂的内在机理还不够明晰。植物叶片衰老除了受到环境因素,如受光、温、千旱、盐碱等各种非生物胁迫因素的影响外,也受脱落酸、乙烯、细胞分裂素等植物自身激素的调节。从植物叶片早衰数据库查询结果显示,在水稻中已鉴定出150多个与叶片衰老相关的基因,其中经遗传转化验证或互补验证的与叶片早衰相关的调控基因仅有50多个。在其中21个已克隆的水稻叶片早衰相关基因中,多数基因参与激素合成及信号传导、叶绿素降解、过氧化反应四及逆境胁迫叫等途径。这些研究结果显示,早衰突变体多数是因为植物抗氧化系统功能下降,导致叶片衰老。因此,早衰突变体往往与某些防御反应相关基因存在一定的联系,在植物防御机制中也具有重要的调控作[1]拟南芥hysl(hypersenescence 1)突变体在暗诱导条件下表现出早衰症状,而同时HYSl基因也是病程相关基因以,在该突变体表现早衰症状的同时,出现了防卫反应相关的表型,证明某些植物的早衰症状与防御反应具有相同的遗传基础。[本研究切人点]目前,对早衰或者类病斑突变体的研究主要是通过遗传学方法克隆相关基因后从生理生化的角度解释造成植物早衰的分子机理,而从植物病程相关基因的表达差异与其防御系统的相关性研究鲜见报道。[拟解决的关键问题]本研究通过对水稻早衰突变体w14进行农艺性状调查、相关生理指标及病程相关基因的表达分析,以期明确早衰突变体与野生型YY之间存在的主要表型差异,为下一步遗传群体的构建、遗传学分析和基因功能的研究奠定基础。
1材料与方法
1.1试验材料
1.1.1水稻品种野生型品种云引(YY)由云南省农业科学院提供,本研究所用的早衰突变体wl4由野生型品种YY经0.8%EMS诱变处理后,经多代筛选、鉴定直至自交稳定而获得;普感品种丽江新团黑谷(LTH)由中国农业科学院作物研究所提供。
1.1.2菌株用于稻瘟病抗性鉴定的24个稻瘟病菌生理小种由福建省农业科学院植物保护研究所提供,用于水稻白叶枯病抗性鉴定的菌株浙173、C5等均由中国农业科学院植物保护研究所提供。
1.2主要试剂
MES,购自国药公司;植物总RNA提取试剂Trizol,购自全式金生物技术有限公司;cDNA链反转试剂盒(ReverAidFirstStrandcDNASynthesisKit),购自Fermentas公司;荧光定量试剂盒RoxReferenceDyII(50X),购自罗氏(Roche)公司;2XPowerPfuPCRMasterMix,购自北京百泰克生物技术有限公司。
1.3试验方法
13.1田间种植和表型观察混收经化学诱变的M代种子,均匀播种于秧田,待秧龄28d后移栽。本田的肥力中等偏上,田间种植规格:23cmX23m,每行插7株,每10行中按相同规格移裁1行同时播种的野生型对照。按照常规大田的水肥和病虫害管理。分别于移栽后30d、60d、90d和120d观察并记载M,代植株的表型,选择有典型衰老表型的单株挂牌标记,单株收种,套袋自交加代繁殖直至稳定。
13.2水稻离体叶片抗衰老及叶绿素含量测定
别将野生型和突变体分蘖盛期的剑叶剪成1cm左右的小段,将剪断的叶片叶脉朝下放置在0.3mol-L的MES溶液的培养皿中,盖上培养皿盖,放置于相对湿度90%、温度25C的人工气候箱连续96h黑暗培养,期间分别于24、48、72、96h进行离体叶片衰老表型的观察,并拍照记录结果。叶绿素含量测定按照南京建成叶绿素含量测定试剂盒说明书进行操作。
1.3.3稻瘟病抗性鉴定和调查分别将野生型和突变体种子播种于温室内秧盘,以普感稻瘟病品种丽江新团黑谷(LTH)为对照,播种量为20粒左右,3次重复。接种前一周浇施2%尿素1次,使秧苗叶色浓绿、叶片下垂,待秧苗长至3叶1心时,洗脱和制备稻瘟病菌孢子悬浮液(孢子浓度调整至每亳升1X10个),加入吐温20至终浓度0.25%o,使用人工喷雾接菌,保温保湿7d后调查并记载发病情况,调查标准按照国际水稻研究所制定的分级标准。
1.3.4水稻白叶枯病抗性鉴定和调查从超低温冰箱取出甘油菌,在NA培养基上活化后备用。待接种水稻长至分蘖盛期,通过剪叶法对水稻最上层完全展开的叶片进行接种。将浙173、C5菌株分别配制成菌液浓度为oDBo0mm=0.5,等体积混匀后接种。接种后15d左右调查和记载发病情况,按照Gu等叫的调查标准进行。
1.3.5水稻叶片RNA提取及反转录RNA提取参照Trizol试剂盒提供的方案进行操作。提取的RNA经NANODROP2000C测定检测其质量(A260:280=2.0左右,且A260:2301.8),同時经过琼脂糖凝胶电泳检测其完整性。随后将质量合格的RNA进行65C热变性5min后,立即置于冰上冷却,再按照逆转录
试剂盒操作说明,清除gDNA后再反转录合成cDNA,稀释20倍后于-20C保存备用。
13.6荧光定量PCR以水稻肌动蛋白基因Actin为内参基因,进行SYBRGreenI荧光定量PCR,反应体系参照试剂盒说明书操作。抗病相关基因OsJARl、OsAOS2、CEBiP、Chtl、OsPAL1、OsPAL2、PR3、PR4、PRS和PBZI的荧光定量PCR引物序列参照文献[15]的方法,水稻衰老相关基因SGR、Osh36、Osh69、PAO、NYC3和RCCRI的荧光定量PCR引物序列参照文献[6]、[16]的方法。反应在ABI7500荧光定量PCR仪上进行,反应程序为:95C,10min;95C、l5s,60C、60s,40个循环。反应结束后进行熔解曲线分析,熔解曲线按照ABI7500仪器标准程序进行。最后导出数据,并采用Excel2007进行数据分析和作图。
2结果与分析
2.1突变体wl4的早衰表型鉴定
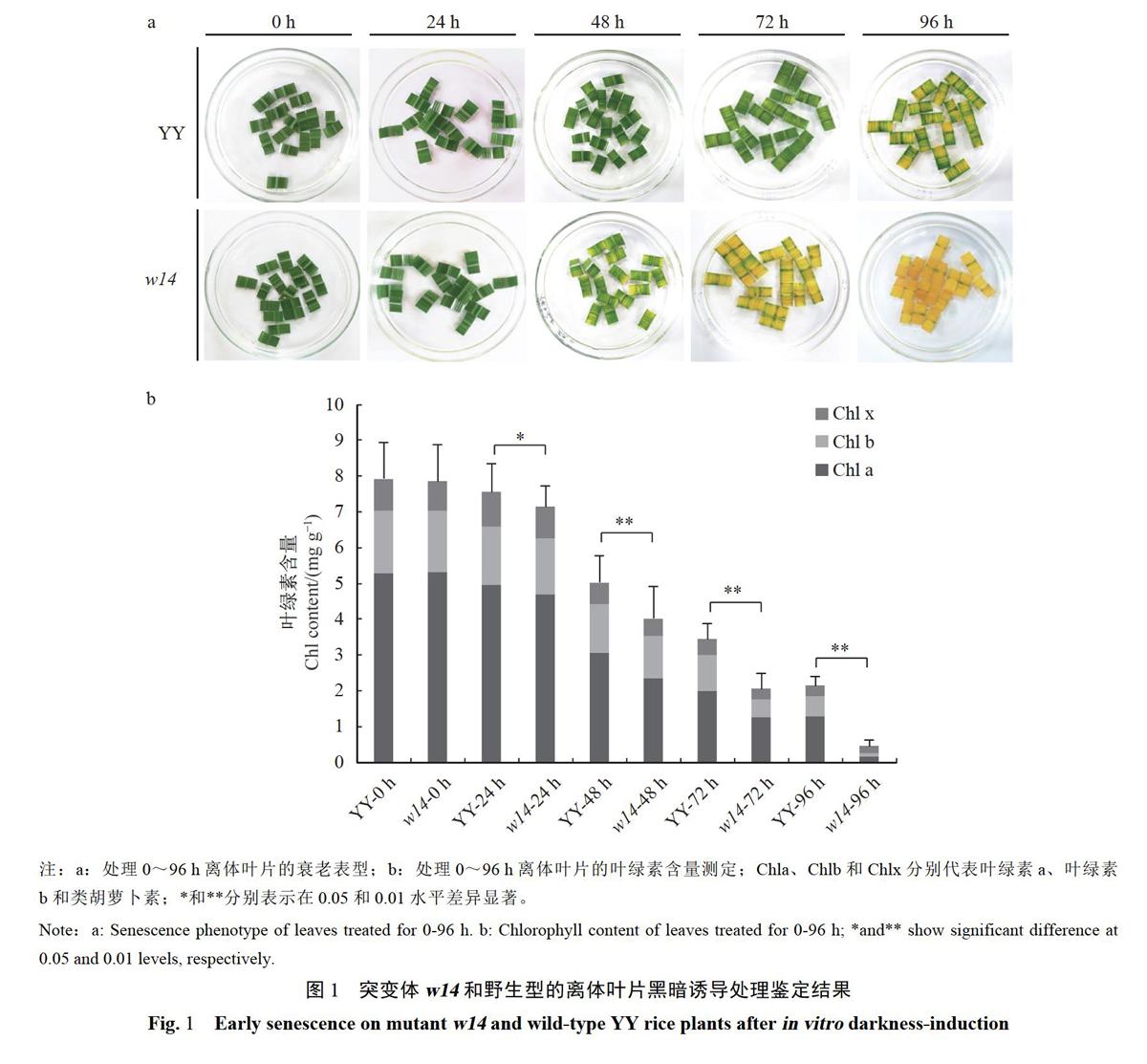
对突变体wl4和野生型YY进行全生育期表型观案,发现突变体自分蘖盛期开始,基部倒二、倒三叶开始出现明显的衰老表型,表现为叶片褪绿、萎蔫、卷曲。为了进一步验证早衰突变体与野生型的差异,分别对分蘖初期突变体(未出现明显衰老表型)和野生型的离体叶片进行人工黑暗诱导处理,结果显示:处理前和处理24h时,突变体和野生型表型上并无显著差异;处理48h时,突变体开始出现较为明显的褪绿表型,而此时的野生型仅有轻微的褪绿;处理72h时,突变体衰老表型更为典型,叶绿素降解加速,野生型开始出现褪绿;至处理96h时,突变体儿乎完全失绿,衰老表型明显,野生型尚有明显的绿色部分(图1-a)。
各个处理阶段叶绿素含量的测定结果与表型结果相一致,未处理前野生型和突变体叶绿素含量无显著差异;处理24h时,突变体叶片中叶绿素含量(叶绿素a、叶绿素b和类胡萝卜素的总含量,下同)比野生型降低了5.43%,差异显著(P《0.05);处理48h时,突变体叶片中叶绿素含量比野生型降低20.00%,差异极显著(P《0.01);处理72h和96h时,突变体叶片中叶绿素含量比野生型分别降低40.41%和78.97%,差异均达到极显著水平(P《0.01)(图1-b)。试验结果表明,在人工黑暗诱导处理条件下,突变体叶绿素降解更快,更易衰老。
2.2突变体wl4的抗病性鉴定
众多有关水稻类病斑和早衰突变体的研究多涉及其防御反应和抗病性增强的报道。本研究的野生型亲本YY是一个具有广谱稻瘟病抗性的地方品种,为了证实本研究的早衰突变体材料wl4的稻瘟病抗性是否发生改变,选用从福建省各稻瘟病重发区分离的24个强致病力的稻瘟病菌生理小种进行室内喷雾接菌,抗性鉴定结果:在用于鉴定的24个菌株中,野生型YY接菌后表现为抗病表型的菌株有16个,抗菌株率为66.67%;突变体w14接菌后表现为抗病表型的菌株有8个,抗菌株率为33.33%。突变体w14的抗菌株率明显低于野生型,其中:突变体wI4对菌株SM17019-2、NH13093、NH17028、JY15015、NH15040、NH15040、NJ08022、NH17026-4的表型由抗病变为感病,表明突变体wl4的稻瘟病抗性水平明显降低(表1)。
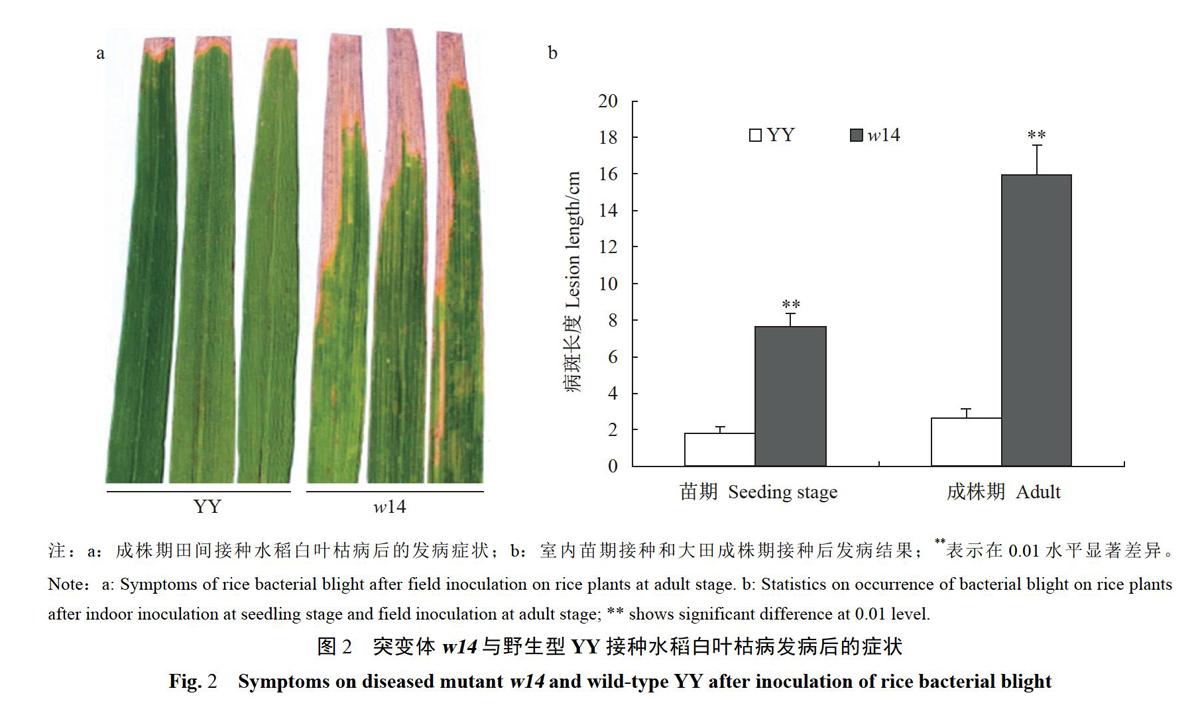
田间和室内接种水稻白叶枯病的抗性鉴定结果(图2)表明:与野生型YY相比,突变体wl4均表现更为感病。室内人工接种15d时,野生型YY的平均病斑长度为1.82cm(抗病水平),而突变体w14接种15d时的平均病斑长度为7.72cm(中感水平),突变体的病斑长度极显著长于野生型YY(P《0.01)。大田分蘖盛期田间接种15d时,野生型YY的平均病斑长度为2.65cm(抗病水平),突变体w14接种15d时的平均病斑长度为15.96cm(感病水平),突变体病斑长度极显著长于野生型YY(P《0.01)。
2.3突变体w14与植物衰老相关基因的表达
与野生型YY相比,突变体w14在苗期至分蘖盛期在农艺性状和表型上并无显著差异,前人的研究结果表明,水稻发生衰老症状时会有一些保守基因或者标志性基因的表达水平发生变化”,为了检测本研究的突变体w14是否与前人的研究材料之间存在这些衰老关键基因的表达差异,笔者从文献中选取了一些水稻早衰相关基因P40、NYC3、SGR、Osh36、Osh69和RCCR1作为检测对象,以相同生育期的野生型品种YY为对照,用RT-PCR方法分别对突变体wI4和野生型YY进行表达分析,结果显示:与野生型YY相比,突变体wl4中与叶绿体发育相关的基因PA0、NYC3均显著上调表达;促进衰老的基因Osh36和RCCRl在突变体wl4中的表达量均显著上调,其中Osh36的上调表达的差异性达到极显著水平(P《0.01)。此外,在突变体w14中,控制叶绿素降解的相关基因SGR的表达量显著上调,水稻衰老的标志基因Osh69也出现了显著的上调表达。本试验中所检测的6个衰老相关基因均表现为在突变体w14中的表达量显著高于野生型YY(图3),表明突变体的表型是一个较为典型的衰老过程。
2.4突变体w14病程相关基因的表达
笔者前期分别对突变体w14和野生型YY进行的稻瘟病和水稻白叶枯病抗性鉴定结果表明,突变体比野生型更为感病。因此,选取了水稻中11个病程相关基因进行了表达分析,结果表明:与野生型YY相比,在相同的生育期,除了防卫相关基因CEBip和PR5在突变体中的表达比野生型低之外,其他9个基因均表现为上调表达,其中:PRla和PR4在突变体中的表达上调13.5~25.4倍;Cthl在突变体中的表达,苗期上调了8.5倍,但成株期却下调93.4%;PR1b、PBZ1、PR3均在成株期即出现衰老表型的时候出现显著上调表达(图4a、b)。以上结果说明,突变体中这些主要的病程相关基因的表达均发生了改变,这说明突变体可能因为本身某些关键基因的突变造成了抵御病原菌的能力减弱,使防御体系变得更为敏感。突变体中许多病程相关基因的表达显著上调,这与前期抗病性鉴定结果一致。
3讨论与结论
衰老是植物生长发育的自然过程,也是最后阶段。在植物组织衰老的过程中,体内的营养物质会逐渐由衰老器官转移到代谢旺盛的生殖器官等部位叼。因此,植物的正常衰老不管对生殖生长还是营养生长而言都十分重要18。众所周知,早衰会造成作物产量降低,延缓衰老能够保证作物的产量。有研究表明,水稻叶片推迟1d衰老,产量可增加2%左右!。因此,深人研究水稻衰老的机制,并探寻可行的延缓衰老的方法对于提高水稻产量具有积极的意义。
近年来,科学家们利用水稻突变体,通过对其进行遗传学和基因工程技术的研究,克隆获得了大量的叶片衰老相关基因20。但在这些克隆的早衰相关基因中,多数是因基因突变造成的代谢过程中过氧化物累积从而造成水稻叶片细胞坏死而出现早衰,虽然有些突变体能够因为体内过氧化物的累积抵制某些病原微生物,从而表现出一定的抗病性,但与相同遗传背景的野生型品种相比,这些突变体多数表现为形态变差,产量低,均不适合直接用于对栽培品种的改良,难以达到在提高作物抗病性的同时保障其产量和品质的目的。本研究获得的突变体wl4,与野生型YY相比较,其突变后表现为分蘖盛期出现早衰表型,通过进一步对水稻衰老相关基因的表达分析表明,突变体wl4中这些衰老相关基因出现了显著的上调表达,表明突变体wl4经历了典型的衰老过程。但是与前人研究的早衰突变体材料不同的是,w14在早衰表型出现后表现出过氧化物等一些代谢产物的积累,但在抗病性上却表现出更为感病的表型;对11个水稻病程相关基因的表达分析结果也显示,突变体wl4中病程相关基因PRla、PR4、Cthl、PRlb、PBZ1、PR3等均表现出显著的上调表达,表明突变体中防御反应体系与野生型YY相比发生了较为显著的改变。在本研究中,如果控制突变体w14早衰的基因是因功能丧失造成了其感病的表型,则可以通过过量表达该基因,使其恢复或超过野生型抗性水平;如果控制突变体w14早衰表型的基因是因基因突变激活了下游基因造成了其感病的表型,则可以通过基因编辑的方法敲除相应基因,使其获得抗病的表型,从而实现在生产上的利用价值。如储成才等”发现,植物衰老信号通路的重要成分OsNAP受ABA特异性诱导,通过直接调控叶绿素降解、营养再转运及其他衰老相关基因的表达,调控叶片的衰老进程。通过降低OsNAP基因表达可显著延缓水稻叶片衰老,延长灌浆时间,从而提高水稻结实率和千粒重,最终使水稻产量得到显著提高。但是,由于植物衰老机制复杂,同时受到植物体内信号因子的精确调控,因此其生产利用为期尚早。且单一基因对于揭示水稻的衰老机制意義有限,只有通过对上、下游基因和互作基因进行深人研究,同时构建这些基因的遗传网络才能够系统地解释植物衰老的内在机制,从而进一步利用其遗传规律对育种和生产提供帮助和指导。
参考文献:
[1]LIMPo,KIMHJ,GILNAMH.Leafsenescence [J]. AnmualReview ofPlant Biology, 2007, 58 (1) : 115-136.
[2]杨波,夏敏,张孝波,等.水稻早衰突变体es16的鉴定与基因定位[J].作物学报,2016,42(7):976-983.
[3]YOSHIDA S. Molecular regulation of leaf senescence [J]. Current Opinion in Plant Biology, 2003,6 (1) : 79-84.
[4]赵春德,张迎信,刘群恩,等.一个水稻早衰突变体基因的精细定位[J].中国农业科学,2014,47(11):2069-2077.
[5]SCHIPPERS J H M, SCHMIDT R, WAGSTAFF c, et al. Living to die and dying to live: The survival strategy behind leaf senescence [J]. Plant Physiology, 2015, 169: 914-930.
[6]王备芳,陈玉宇,张迎信,等.水稻早衰突变体es5的鉴定及其突变基因的精细定位[].中国农业科学,2018,51(4):613-625.
[7] LIANGC Z, WANG Y Q, ZHU Y N, et al. OsNAP connects abscisicacid and leaf senescence by fine-tuning abscisic acid biosynthesis and directly targeting senescence-associated genes in rice [J]. Proceedings of the National Academy of Sciences of the United States of America,2014, 111 (27) : 10013-10018.
[8]SAKURABA Y, RAHMAN M L, cHo S H, et al. The rice faded green leaf locus encodes protochlorophyllide oxidoreductase B and is essential for chlorophyll synthesis under high light conditions [J]. The Plant Journal, 2013, 74 (1) : 122-133.
[9]LIN A H, WANG Y Q, TANG J Y, et al. Nitric oxide and protein S-nitrosylation are integral to hydrogen peroxide-induced leaf cell death in rice [J]. Plant Physiology, 2012, 158 (1) :451-464.
[10] KONG Z S, LI M N, YANG W Q, et al. A novel nuclear-localizedCCCH-type zinc finger protein, OsDOS, is involved in delaying leafsenescenceinrice [J]. PlantPhysiology, 2006, 141 (4) :1376-1388.
[11] CHAK W, LEE Y J, KOH H J, et al. Isolation, characterization, andmapping of the stay green mutant in rice [J]. Theoretical and Applied Genetics, 2002, 104 (4) :526-532.
[12] YOSHIDA s, ITO M, NISHIDA I, et al. Identification of a novel geneHYS1/CPR5 that has a repressive role in the induction of leafsenescenceand pathogen-defenceresponses in Arabidopsisthaliana [J]. The Plant Journal, 2002, 29 (4) :427-437.
[13] AKI T, KONISHI M, KIKUCHI T, et al. Distinct modulations of thehexokinasel-mediated glucose response and hexokinasel-independentprocessesbyHYS1/CPR5 in Arabidopsis [J]. Journal ofExperimental Botany, 2007,58 (12) : 3239-3248.
[14] GU K, TIAN D, YANG F, et al. High-resolution genetic mapping ofXa27(t), a new bacterial blight resistance gene in rice, Oryza sativa L. [J]. Theoretical and Applied Genetics, 2004, 108 (5) : 800-807.
[15] YOUQ Y, ZHAIK R, YANG D L, et al. An E3 ubiquitin ligase-BAGprotein module controls plant innate immunity and broad-spectrum disease resistance [J]. Cell Host & Microbe, 2016, 20 (6) : 758-769.
[16] LENG Y J, YANG Y L, REN D Y, et al. A rice PECTATE LYASE-LIKE gene is required for plant growth and leaf senescence [J]. Plant Physiology, 2017, 174 (2) : 1151-1166.
[17]張涛,孙玉莹,郑建敏,等.水稻早衰叶突变体PLS2的遗传分析与基因定位[J].作物学报,2014,40(12):2070-2080.
[ 18] BUCHANAN-WOLLASTON V, PAGE T, HARRISON E, et al.Comparative transcriptome analysis reveals significant differences in gene expression and signalling pathways between developmental and dark/starvation-induced senescence in Arabidopsis [J]. The Plant Journal, 2005, 42 (4) : 567-585.
[19]左海龙,肖珂,张永娟,等.控制水稻叶片叶绿素含量及其离体叶片
叶绿素降解速度相关的QTL定位(简报)[J].分子细胞生物学报,2007,40(5):346-350.
[20]郑建敏,张涛,郑家奎水稻叶片衰老相关基因的研究进展[J].基因组学与应用生物学,2009,28(5):1010-1019.
(责任编辑:杨小萍)
朱永生,徐靖,蒋家焕,等.水稻早衰突变体w14的鉴定和病程相关基因表达分析[J].福建农业学报,2020,35(6):626-632.
