MS2噬菌体介导展示猪繁殖与呼吸综合征病毒线性表位的嵌合纳米颗粒制备及免疫原性
2020-11-09王国强李欣欣苏运芳曾华辉马红芳刘保光尚立芝张振强
王国强 李欣欣 苏运芳 曾华辉 马红芳 刘保光 尚立芝 张振强


摘要:[目的]以MS2噬菌体外壳蛋白为载体,构建展示猪繁殖与呼吸综合征病毒GP5蛋白上线性表位的嵌合纳米颗粒,并研究其免疫原性,为猪繁殖与呼吸综合征病毒或其他病毒表位展示提供新的方法和思路。[方法]利用重叠延伸PCR将GP5上优势线性表位基因序列插入到MS2噬菌体外壳蛋白基因上,构建重组载体,通过原核表达系统表达嵌合蛋白,目的蛋白经过硫酸铵沉淀和凝胶过滤层析纯化,用动态光散射和电镜对嵌合蛋白进行物理表征,通过蛋白印迹和动物免疫试验研究表位嵌合颗粒的免疫原性。[结果]成功将线性表位基因插人MS2噬菌体外壳蛋白基因,嵌合蛋白在原核表达系统中以水溶性表达,目的蛋白经过纯化,纯度达85%以上。嵌合蛋白在体外自组装形成了均一的、直径为25~31nm的嵌合表位纳米颗粒,该嵌合颗粒免疫动物后,产生可以和灭活病毒反应的高水平抗体,具有良好的免疫原性。[结论]MS2噬菌体外壳蛋白可以耐受9个外源多肽(猪繁殖与呼吸综合征病毒GP5上线性表位)的插人,在体外自组装形成嵌合病毒样颗粒。该颗粒将外源多肽高密度展示在表面,免疫动物可产生针对该表位的抗体。该技术可为猪繁殖与呼吸综合征病毒其他表位或更长串联表位的展示奠定基础。
关键词:MS2噬菌体;线性表位;嵌合纳米颗粒;猪繁殖与呼吸综合征病毒
中图分类号:Q78
文献标志码:A
文章编号:1008-0384(2020)06061808
0引言
[研究意义]猪繁殖与呼吸综合征(PorcineReproductiveandRespiratorySyndrome,PRRS)是由高度遗传多样性的RNA病毒猪繁殖与呼吸综合征病毒(PorcineReproductiveandRespiratorySyndromeVirus,PRRSV)引起的以妊娠母猪厌食、繁殖障碍、各年龄段猪的呼吸道疾病和新生及断奶仔猪高病死率为特征的高度接触性传染病,是危害我国养猪业发展的重要呼吸传染病之一口。2006年,我国首次爆发高致病性PRRS(Highly-pathogenicPRRS,HP-PRRS),与传统的PRRS相比,HP-PRRS可引起更高发病率和死亡率。目前,PRRSV没有有效的治疗药物,免疫接种是预防该病的有效措施。国内上市的灭活苗或弱毒苗对控制PRRSV流行做出了贡献,但由于灭活苗不能复制,需多次免疫,弱毒苗具有病毒返强的潜在安全性,以及现行技术均不能区分感染动物和免疫动物、存在抗体依赖性增强作用(AntibodyDependentEnhancement,ADE)等问题,PRRS在国内仍没有完全控制,猪场感染率依旧很高。因此,开展PRRS新型表位疫苗以及提高表位疫苗稳定性和免疫原性的研究具有重要意义。[前人研究进展]囊膜糖蛋白(GP5)、基质蛋白(M)及核衣壳蛋白(N)为PRRSV病毒的主要结构蛋白”。N蛋白高度保守,在感染动物血清中相应抗体出现较早,被广泛用于PRRSV抗体的血清学诊断,但N蛋白的抗体均为非中和抗体,不适合作为疫苗候选蛋白5-。GP5蛋白是PRRSV最重要的免疫原性蛋白,参与病毒人侵宿主细胞的过程,含有病毒中和作用和免疫保护相关的抗原表位,在感染PRRSV后康复的猪血清中,大部分中和抗体主要针对GP5蛋白一。在2002年,Ostrowski等9利用噬菌体随机12肽展示技术从PRRSV的GP5蛋白上鉴定出SHF/LQLIYNL,是一个主要线性表位。陈如敬等选取PRSVGP5蛋白的抗原表位(aa31~37)和(aal92~198)进行串联后表达,Westernblotting显示具有良好的免疫学活性。Peabody等将HIVgpl20的V3环多肽和HV共受体CCR5的ECL2环多肽以单链二聚体插人MS2外壳蛋白的ABLoop,免疫动物后,展示的多肽显示强的免疫原性;Zhai等2-13在噬菌体MS2病毒样颗粒(VLP)的表面上展示了串联的HPVL2肽(aa17~31),嵌合颗粒免疫的小鼠产生了针对单个L2表位的高滴度抗体,抗血清提供了攻毒保护。Dong等叫将FMDVVP1上第141~160位氨基酸展示在MS2病毒樣颗粒外表面,同时将FMDV的3D基因的反义RNA包装在MS2内部,该双重效能的嵌合病毒样颗粒疫苗可保护40%的乳鼠和85%(17/20)的豚鼠免受口蹄疫病毒的侵害。[本研究切人点]目前关于将PRRSVGP5线性表位展示在MS2噬菌体外壳蛋白表面,在体外通过自组装形成嵌合表位病毒样颗粒以及嵌合颗粒免疫原性的研究尚未见报道,通过原核系统表达和制备嵌合表位病毒样颗粒并验证展示表位的免疫原性,对PRRSV表位的研究和应用具有重要意义。[拟解决的关键问题]本研究通过构建包含MS2噬菌体外壳蛋白和PRRSVGP5蛋白线性表位的原核表达载体,利用原核表达系统表达重组蛋白,该重组蛋白能够不受外源多肽插入的影响,在体外自组装形成嵌合病毒样颗粒,建立纯化方法,为进一步研究、制备和应用其他嵌合表位病毒样颗粒提供思路和奠定基础。
1材料与方法
1.1试验材料
1.1.1菌株、质粒和主要试剂表达菌株Rosetta(DE3),质粒pET28a(+)和pUC57载体(包含大肠杆菌噬菌体MS2结构基因成熟酶蛋白和衣壳蛋白基因)为本实验室保存;限制性内切酶BamHI和NheI、TsDNA连接酶购自NEB(北京),DNAMarker和ProteinMarker购自北京索莱宝科技有限公司;其他化学试剂均为分析纯,购自国药集团化学试剂有限公司。
1.1.2试验动物和阳性血清豚鼠购自郑州大学实验动物中心,PRRSVCH-IR弱毒株和PRRSV猪感染强阳性血清由河南省生物工程技术研究中心提供,辣根过氧化物酶(HRP)标记的兔抗豚鼠二抗购自北京百奧莱博科技有限公司。
1.1.3引物根据pUC57载体(包含大肠杆菌噬菌体MS2结构基因成熟酶蛋白和衣壳蛋白基因)基因序列设计扩增MS2蛋白外壳(CP)基因的引物,上下游引物分别加NheI和BamHI酶切位点以及相应的保护性碱基。根据GenBank:AAD12129.1和GenBank:U87392.3上GP5线性表位Bl(aa37~45)氨基酸序列和核苷酸序列设计两对引物,用于扩增插入的9个多肽(B1)序列,引物见表1,由生工生物工程(上海)股份有限公司合成。
1.2试验方法
1.2.1重组载体构建利用OE-PCR技术,参考前期试验吗,扩增出目的嵌合片段CP-B1。片段CP-B1和质粒pET28a(+)分别经NheI和BamHI双酶切、回收和连接,转化到大肠杆菌JM109感受态细胞,涂布卡那霉素抗性平板,37C培养过夜,挑选单克隆并扩大培养,菌落PCR、提取质粒双酶切和测序鉴定正确的质粒命名为pET28a(+)/CP-B1。
1.2.2嵌合重组蛋白的表达与纯化测序正确的质粒pET28a(+)/CP-B1转化大肠杆菌表达菌株Rosetta(DE3)感受态细胞,37C培养过夜,挑取单克隆于含有卡那霉素抗性的液体培养基中37C培养2~3h,至OD600值为0.5~0.7,加人异丙基-D-硫代半乳糖苷(IPTG)至终浓度0.2mmolL,20C振荡诱导表达18h。10000r*min,离心10min收集菌体,pH8.0、50mmolLTris缓冲液重悬菌体,冰浴条件下超声破碎,12000rmin离心10min,收集上清。
在4C冰浴搅拌条件下,往上清中缓慢加入饱和硫酸铵至最终质量浓度为30%,继续搅拌30min。12000rmin离心20min,弃上清,pH8.0、50mmolLTTris缓冲液重悬沉淀,0.45ym针头滤器过滤,过滤样品通过Sephacryls-1000凝胶过滤层析柱纯化:3倍柱床体积的50mmolLrTris缓冲液平衡柱子,加入相当于柱床体积1%~5%的蛋白质样品,根据A280收集每个流出峰,每个峰加入5X蛋白上样Buffer,沸水煮10min,进行SDS-PAGE。
1.2.3嵌合蛋白的物理表征纯化的目的蛋白通过
透射电子显微镜和电位及粒度分析仪进行物理表征。嵌合颗粒用JEM-1400(日本)透射电子显微镜,在2%磷钨酸复染,100kV加速电压条件下,观察颗粒粒径和均一度,用布鲁克海文仪器电位及粒度分析仪(美国90PlusPALS)测量颗粒的粒径和分布。1.2.4嵌合颗粒的免疫原性分析免疫印迹检测:将菌体破碎上清、硫酸铵沉淀重悬液和凝胶过滤层析纯化第一个峰值蛋白浓缩液经sDS一PAGE电泳后,湿转至PVDF膜上。0.5%脱脂牛奶37C封闭2h,PBST洗涤5次,每次5min,加入稀释的猪抗PRRSV高免血清,置37C,孵育2h弃抗体。PBST洗涤5次。加人辣根过氧化物酶(HRP)标记的羊抗猪血清(1:2000稀释),37C,孵育1h,弃抗体,洗涤5次,通过增强化学发光法ECL显色液显色。
随机将20只200~250g的豚鼠分为4组,试验组、阴性组对照组和阳性对照组(不同剂量),每组5只。阴性对照组用PBS和佐剂(ISA206)乳化制备,阳性对照组用灭活疫苗进行免疫,试验组分别用10yg:只一和20yg:只1嵌合颗粒与佐剂(ISA206)乳化制备,制备好的疫苗于豚鼠后肢外侧肌肉注射,免疫两次,0d和14d各免疫1次。分别在免疫前(0d)、7d、14d、21d、28d、35d和42d對豚鼠前腿内侧采血。全血37C放置2h,4C静置4h,4000r.min离心7min,分离血清待用。用病毒作为抗原包被的ELISA板检测待测血清(1/100稀释)抗体水平。
2结果与分析
2.1重组质粒构建
2.1.1嵌合片段扩增以pUC57载体(包含大肠杆菌噬菌体MS2结构基因成熟酶蛋白和衣壳蛋白基因)为模板,以CP-F和IN-R为引物,扩增上游片段,大小为80bp左右;以IN-F和CP-R为引物,扩增下游片段,大小为350bp。上下游片段扩增产物回收后,作为模板,以CP-F和CP-R为引物扩增全长CP-B1,全长大小为430bp。片段大小和预期相符(图1)。
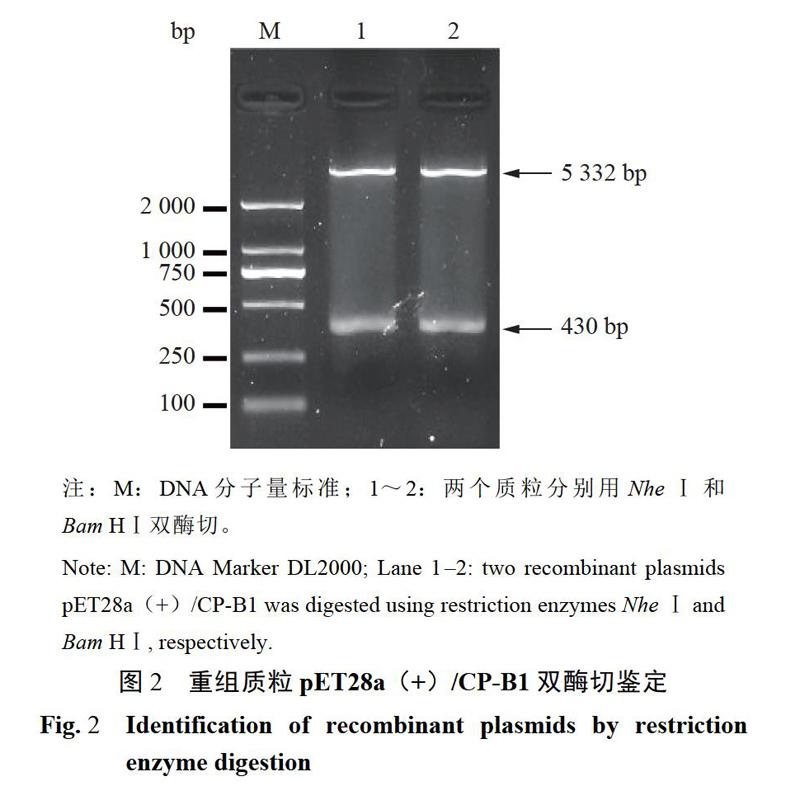
2.1.2重组载体连接和鉴定全长CP-B1和质粒pET28a(+)分别经过NheI和BamHI双酶切,回收后的线性化载体和片段以1:5摩尔比进行连接,转化大肠杆菌JM109感受态细胞。菌落PCR鉴定后,提取质粒双酶切(图2)和测序鉴定,正确的重组质粒命名为pET28a(+)/CP-Bl。
2.2嵌合重组蛋白的表达和纯化
表达菌株Rosetta(DE3)/pET28a(+)/CP-Bl经过IPTG在20C低温诱导后,超声破菌,上清经30%的硫酸铵沉淀,去除了一部分杂蛋白(图3-a),沉淀重悬,过分子筛。通过分子筛在线检测可以看出,目的蛋白最先流出(第一个峰),说明目的蛋白是一个大分子聚体(图3b)。
2.3嵌合表位纳米颗粒的物理表征
凝胶过滤层析纯化的大分子嵌合蛋白样品用粒度分析仪检测蛋白粒径和均一度,结果显示:粒径为28nm左右,且均一度良好(图4-a)。同时,目的蛋白5倍稀释后,磷钨酸染色滴膜,观察期颗粒形成情况和粒径大小,电镜观察结果表明嵌合蛋白在体外自组装形成了VLP,且粒径为25~31nm,与动态光散射(DLS)一致(图4-b)。
2.4嵌合表位纳米颗粒的免疫原性分析
2.4.1嵌合蛋白免疫印迹菌体破碎上清、硫酸铵沉淀重悬液、凝胶过滤层析纯化蛋白与PRRSV高免血清进行Westernblotting,结果显示含目的嵌合蛋白的菌体超声上清和纯化后目的嵌合蛋白均可以和PRRSV高免血清发生特异性反应,在14kDa出现免疫印迹条带(图5-a),表明嵌合PRRSVGP5蛋白,上线性表位B1的纳米颗粒具有良好的反应原性。
2.4.2嵌合纳米颗粒的免疫原性取0、7、14、212835和42d豚鼠血清,PBS(1/100)稀释后,用包被有PRRS灭活病毒的酶标板,通过间接ELISA检测。检测结果显示:10ug和20yg嵌合有GP5蛋白上线性表位的纳米颗粒,在一次免疫豚鼠后第14d分离的血清可以和灭活PRRS病毒发生反应,二免后7d(一免后第21d)产生了可以和病毒反应更高水平的特异性抗体;相较于10yg:只,20yg:只T嵌合纳米颗粒刺激产生了更高水平的抗体,具有剂量依赖效应。阳性对照在一免和二免后均产生了可以和灭活病毒反应的高水平抗体,且高于嵌合纳米颗粒(图5-b)。阴性对照(PBS组)血清不和灭活病毒反应。
[5]仇华吉,周彦君,童光志.猪生殖-呼吸综合征病毒蛋白的结构与功能[J].动物医学进展,2000,21(2):23-26.
[6]DENAC H, MOSER c, TRATSCHIN J D, et al. An indirect ELISAfor the detection of antibodies against porcine reproductiveandrespiratory syndrome virus using recombinant nucleocapsid protein asantigen [J].Journal of VirologicalMethods, 1997, 65 (2) :169-181.
[7]PYO H, SEO J, SUH G, et al. Serodiagnosis of porcine reproductive and respiratory syndrome virus infection with the use of glycoprotein 5antigens [J]. CanadianJournal of Veterinary Research, 2010,74 (3) : 223-227.
[8] POPESCU L N, TRIBLE B R, CHEN N H, et al. GP5 of porcinereproductive and respiratory syndrome virus (PRRSV) as a target for homologous and broadly neutralizing antibodies [J]. Veterinary Microbiology, 2017, 209: 90-96.
[9]OSTROWSKI M, GALEOTA J A, JAR A M, et al. Identification of neutralizing and nonneutralizing epitopes in the porcine reproductive and respiratory syndrome virus GP5 ectodomain [J]. Journal of Virology, 2002, 76 (9) :4241-4250.
[10]陳如敬,吴学敏,车勇良,等.PRRSVGP5抗原表位的串联表达及生物学活性鉴定[J].中国兽医学报,2014,34(6):904-907.
[11] PEABODY D S, MANIFOLD-WHEELER B, MEDFORD A, et al.Immunogenic display of diverse peptides on virus-like particles of RNA phage MS2 [J]. Journal of Molecular Biology, 2008, 380 (1) : 252-263.
[12] ZHAIL K, PEABODY J, PANG Y Y s, et al. A novel candidate HPVvaccine: MS2 phage VLP displaying a tandem HPV L2 peptide offers similar protection in mice to Gardasil-9 [J]. Antiviral Research, 2017,147: 116-123.
[13] ZHAIL K, YADAV R, KUNDA N K, et al. Oral immunization withbacteriophage MS2-L2VLPs protectsagainst oral andgenitalinfection with multiple HPV types associated with head & neck cancers and cervical cancer [J]. Antiviral Research, 2019, 166: 56-65.
[14] DONG Y M, CAIJ C, CHEN H T, et al. Protection of a novel epitope-RNA VLP double-effective VLP vaccineforfoot-and-mouthdisease [J]. Antiviral Research, 2016, 134: 108-116.
[15] WANGGQ, LIU Y c, FENG H, et al. Immunogenicity evaluation ofMS2phage-mediatedchimericnanoparticledisplayinganimmunodominant B cell epitope of foot-and-mouth disease virus [J]. PeerJ, 2018, 6: e4823.
[16] SONG H Q, XIONG D, WANG J, et al. A porcine reproductive andrespiratory syndrome virusvaccine candidate based on PRRSVglycoprotein 5 and the Toll-like receptor 5 agonist Salmonella typhimurium flagellin [J]. Journal of Molecular Microbiology and Biotechnology, 2015,25 (1) :56-59.
[17] QIAOS L, JIANG Z z, TIAN X H, et al. Porcine FcyRIIb mediatesenhancement of porcine reproductive and respiratory syndrome virus (PRRSV) infection [J]. PLoS One, 2011,6 (12) :e28721.
[18] SHI P D, ZHANG L L, WANG J S, et al. Porcine FceRI mediatesporcine reproductive and respiratory syndrome virus multiplication and regulates the inflammatory reaction [J]. Virologica Sinica, 2018, 33 (3) : 249-260.
[19] SU J, ZHOU L, HE B c, et al. Nsp2 and GP5-M of porcinereproductive and respiratory syndrome virus contribute to targets forneutralizingantibodies [J].VirologicaSinica, 2019, 34 (6) :631-640.
[20]曹佳媛,田明堯,辛舒,等.以乙型肝炎病毒核心蛋白为载体的PRRSV病毒样颗粒疫苗的构建[J].中国兽医科学,2015,45(10):1000-1004.
[21]张素姣,王东亮,李萌,等.LoopEF区嵌合猪细小病毒B细胞表位对猪圆环病毒2型病毒样颗粒组装的影响[J].中国兽医科学,2019,49(2):176-182.
[22]蒋春英,魏建超,史子学,等.展示日本乙型脑炎病毒B细胞表位和T细胞表位的猪细小病毒病毒样颗粒的制备[J].中国兽医科学,2013,43(4):358-363.
[23]许博,sYBALOVALM.基于在乙肝核心抗原免疫显性区域展示流感M2e肽的病毒样颗粒流感候选疫苗的研究:含4拷贝M2e的广^谱保护效力[J].微生物学免疫学进展,2016,44(6):47.
[24]董艳美,张国广,汪卫,等.MS2介导的口蹄疫类病毒颗粒疫苗的研究[J].厦门大学学报(自然科学版),2013,52(2):237-243.
[25]王艳梅,顾敬敏,雷连成,等.猪繁殖与呼吸障碍综合征病毒GP5蛋白羧基端的噬菌体展示及其诱导仔猪产生中和抗体水平[J].中国兽医学报,2019,39(5):830-834,841.
[26]孙士鹏,刘贵建.MS2噬菌体衣壳蛋白与包装位点结合特异性及其生物学应用进展[J].生物技术通讯,2014,25(2):259-262.
[27]冷超粮,安同庆,陈家铿,等.高致病性猪繁殖与呼吸综合征病毒GP5蛋白B表位诱导中和抗体能力的研究[J].中国预防兽医学报,2011,33(4):297-300.
[28] PLAGEMANN P G W. The primary GP5 neutralization epitope ofNorth American isolates of porcine reproductive and respiratory syndrome virus [J]. Veterinary Immunology and Immunopathology, 2004, 102 (3) :263-275.
(责任编辑:张梅)
王国强,李欣欣,苏运芳,等.MS2噬菌体介导展示猪繁殖与呼吸综合征病毒线性表位的嵌合纳米颗粒制备及免疫原性[J].福建农业学报,2020,35(6):618-625.
