转录组测序法研究草珊瑚叶和根的基因差异表达
2020-11-09车苏容张家源卢伟祁克明魏艺聪
车苏容 张家源 卢伟 祁克明 魏艺聪
滴要:[目的]从基因表达的水平,初步分析草珊瑚叶和根之间次生代谢差异的分子机制,为二者之间临床疗效差异形成的分子机制分析提供信息。[方法]以福建省福州市的草珊瑚作为样品,采用lluminaHiSeqTM高通量测序技术测定草珊瑚叶和根的转录组,然后经过滤和Trinity组装,得到的unigenes再通过blast与Nr、Nt、Pfam、KOG、Swiss-Prot、Kegg和GO进行比对注释,并对叶和根的基因差异表达进行分析,尤其是对KEGG代谢通路富集的差异基因进行分析。[结果]转录组测序结果共获得0.4亿多个cleanreads,经Trinity组装后共得到508271个unigenes,其平均长度为740bp,最大长度为17.3kb。基于blast分析,共有148561个unigenes在七大功能注释数据库中得到成功注释,占总基因数的58.80%。在分析基因表达水平差异时,发现草珊瑚叶和根的共同基因有93127个,叶和根的差异基因分别为36327个和52268个;同时还发现在29732种不同表达的unigenes中,有12511个上调基因和17221个下调基因;代谢相关KEGG具有显著差异的通路有淀粉和蔗糖代谢、苯丙烷类生物合成、乙醛酸和二羧酸代谢、光合生物的固碳作用、吞噬体、谷胱甘肽代谢、光合作用、丙氨酸、天冬氨酸和谷氨酸代谢、倍半萜类和三萜类生物合成、卟啉和叶绿素代谢、氮素代谢、昼夜节律一植物、光合作用一天线蛋白、芪类、二芳基庚酸和姜酚生物合成、不饱和脂肪酸生物合成、柠檬烯和蒎烯降解、类胡萝卜素生物合成、二萜类生物合成、类黄酮生物合成、脂肪酸延伸等。其中与药效密切相关的次生代谢通路苯丙烷类、倍半萜类和三萜类、二萜类、类黄酮类生物合成等途径分别有193个、82个、40个、35个差异表达基因,而上调倍半萜合酶、ent-kaur-16-烯合酶、黄酮醇合酶/黄烷酮3-羟化酶等基因和下调8-羟基香叶醇脱氢酶、vinorine合酶、角鲨烯合酶等关键酶基因差异显著。[結论]草珊瑚叶和根中苯丙烷类、倍半萜类和三萜类、二萜类、类黄酮次生代谢途径的相关基因差异最为显著,其中差异显著的关键酶基因可为分析其叶和根之间次生代谢差异的分子机制提供重要信息。
关键词:草珊瑚;叶;根;Illumina测序;基因差异表达分析;次生代谢
中图分类号:R932
文献标志码:A
文章编号:1008-0384(2020)060598-13
[研究意义]草珊瑚,又名肿节风、九节风、接骨木、接骨金粟兰等,是金粟兰科草珊瑚属植物草珊瑚Sarcandraglabra(Thunb.)Nakai的干燥全草叫。在2015年版《中国药典》中的草珊瑚是以肿节风收载,其性平,味苦、辛,归心、肝经,具有清热凉血,活血消斑,祛风通络的功效,用于治疗血热发斑发疹,风湿痹痛,跌打损伤。民族用药中,苗药关于草珊瑚疗效的记载和药典大致相同,但特别加以记录了临床上不同部位的不同功效主治,如:茎、叶主治头晕、夏季湿病;叶主治骨折,根主治痢疾、胃痛、肝风、跌打肿痛”。目前已从草珊瑚中分离出黄酮类、倍半萜类、香豆素类、有机酸类的活性成分,还得到了较为丰富的挥发油!、氨基酸和微量元素等成分,现代药理研究显示草珊瑚具有抗肿瘤、抗癌、抗菌、抗病毒、消炎镇痛、对白细胞和血小板的影响、抗胃溃疡、祛痰平喘、促进骨折愈合、调整机体免疫的作用因此,若能从分子水平研究草珊瑚不同部位次生代谢调控基因表达差异的相关信息,将更好地为草珊瑚药用价值的分析提供线索,对有效利用草珊瑚资源具有重要意义。[前人研究进展]近年来,高通量转录组测序技术日益发展,在药用植物转录组测序方面也已经得到广泛的应用。现有的技术可以通过测定不同品种、不同采收期、不同产地、不同入药部位等药用植物转录组信息,整体地研究药效成分相关酶基因的表达情况,进而发现其次生代谢产物的合成途径及其调控机制凹。唐娟巧对三种不同品种的茯苓进行了转录组测序,研究了其基因的差异表达和可能与茯苓多糖含量有关的关键基因;邓楠等叫研究了不同发芽时期麻黄种子在萌发时的相关基因及重要基因的表达情况;谢冬梅等5研究了道地药材丹皮和非道地丹皮之间的基因表达差异,为道地性的形成阐明机制;陈延清等心建立了冬凌草叶和茎的转录组数据库;朱孝轩对长春花的叶、花、根的转录组数据库进行分析,得出了不同药用部位中基因的表达差异。[本研究切人点]目前尚未见涉及转录组测序法研究草珊瑚不同部位基因差异表达的报道。[拟解决的关键问题]本试验通过lluminaHiSeqTM高通量测序技术来获得草珊瑚叶和根的转录组信息,从基因表达的角度,分析草珊瑚叶和根之间基因表达差异,为二者之间可能存在的次生代谢差异分析提供信息,为草珊瑚叶和根不同药用价值分析提供参考,有利于草珊瑚叶和根资源的精准利用。
1材料与方法
1.1试验材料
试验样品取自福建省福州市闽侯县(东经1191057.54",北纬2604'36.10"),经福建中医药大学卢伟教授鉴定为金粟兰科植物草珊瑚Sarcandraglabra(Thunb.)Nakai。分别取林下种植、5年生的同一居群的3株草珊瑚叶和根样本各3份,编号分别为L1、L2、L3和R1、R2、R3,经过清洗、千燥后立即在液氮中冷冻并储存于-80C备用。
1.2基因文库的构建与RNA测序
使用TRIzol试剂盒分别提取草珊瑚样品中叶和根的总RNA,经检测合格后,富集各自的mRNA,并以此模板进一步合成双链cDNA,再经纯化处理、选择合适的片段大小,最后通过PCR技术扩增,并纯化PCR产物以获得基因文库。库检合格后,最终通过IlluminaHiSeqTM进行高通量测序。
1.3数据的筛选与转录本的组装
使用Trinity软件8将得到的rawreads进行过滤纯化,去除带接头的reads、无法确定碱基信息比例大于10%的reads和低质量的reads(质量值Qphred《=20的碱基数占整个reads的50%以上的reads),得到cleanreads。再对cleanreads进行组装,得到转录本序列。再使用Corset对转录本进行层次聚类,得到最终unigene。
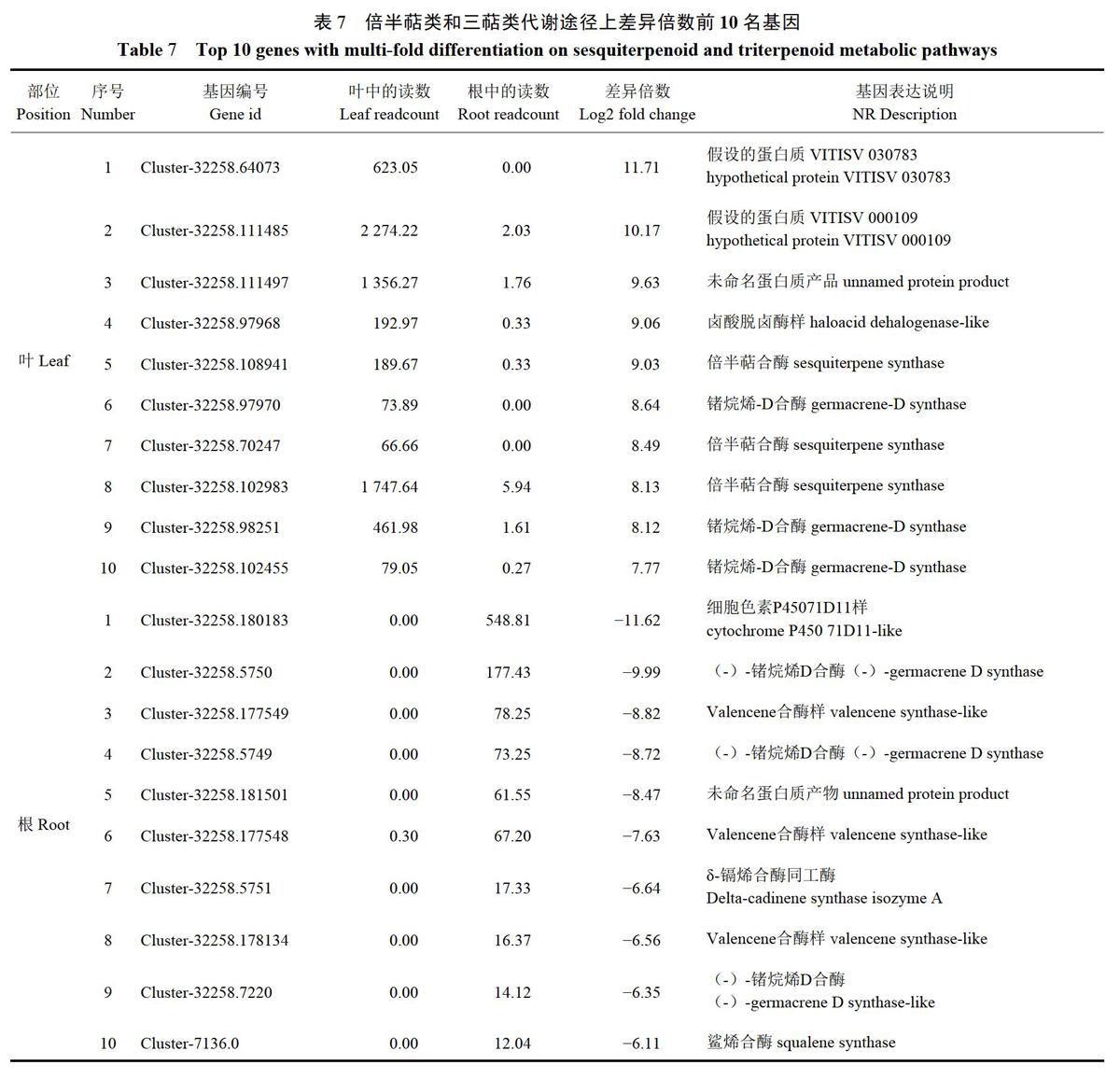
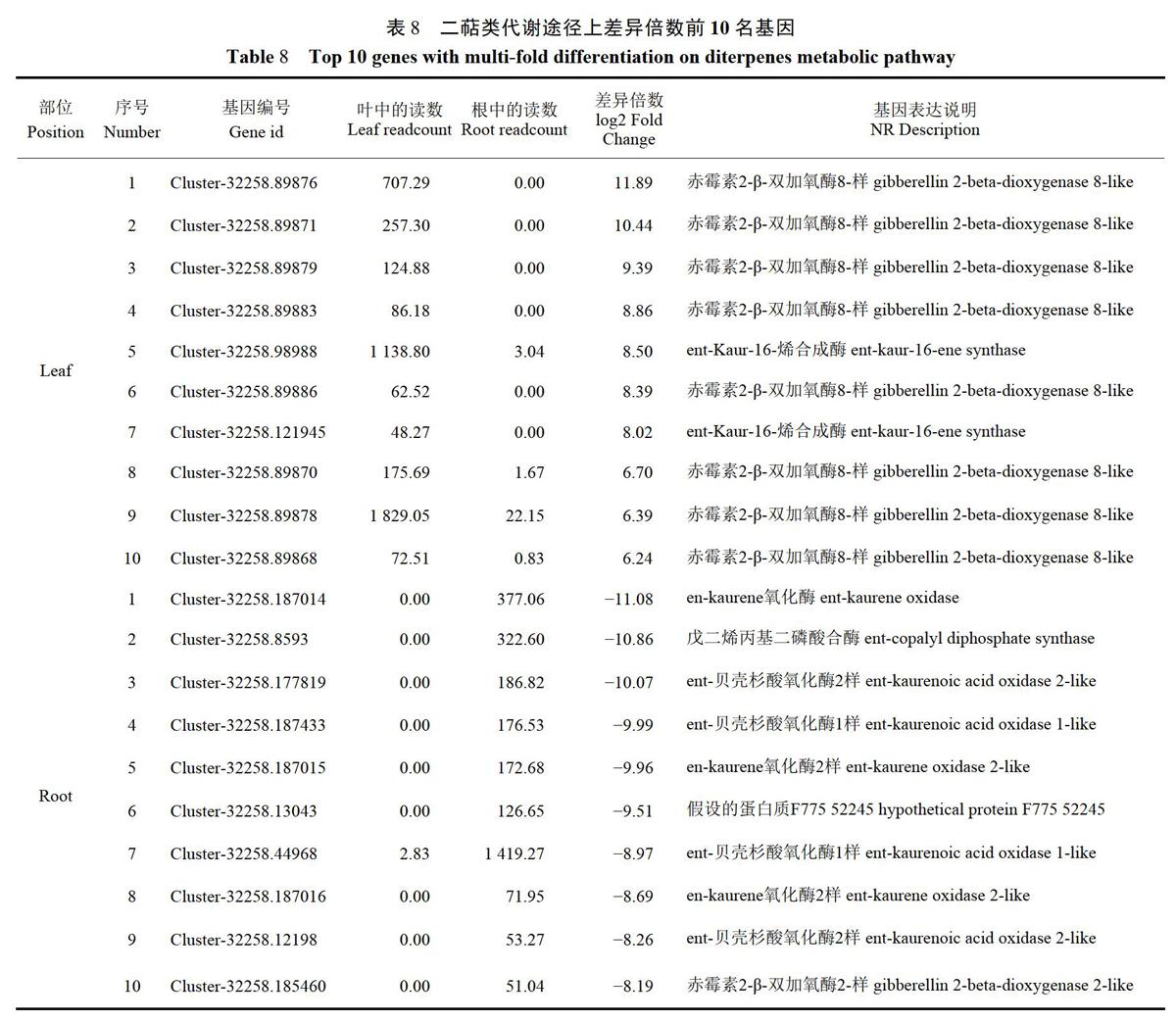
进一步分析这四个代谢途径中差异倍数前10名的基因,可以发现在苯丙烷类代谢途径上,差异倍数较大的上调基因有莽草酸氧羟基肉桂酰基转移酶、过氧化物酶、B一葡萄糖苷酶,下调基因有8-羟基香叶醇脱氢酶、過氧化物酶、甘露醇脱氢酶;在倍半萜类和三萜类代谢途径上,差异倍数较大的上调基因有倍半萜合酶、锗烷烯-D合酶,下调基因有(-)-锗烷烯D合酶、valencene合酶、8-镉烯合酶同工酶、角鲨烯合酶;在二萜类代谢途径上,差异倍数较大的上调基因有赤霉素2-B-双加氧酶、ent-kaur-16-烯合酶,下调基因有en-kaurene氧化酶、戊二烯丙基二磷酸合酶、ent-kaurenoicacidOXidase、赤霉素2-B-双加氧酶;在类黄酮代谢途径上,差异倍数较大的上调基因有黄酮醇合酶/黄烷酮3-羟化酶、莽草酸氧-羟基肉桂酰基转移酶、查尔酮合成酶、黄烷酮3-羟化酶,下调基因有vinorine合酶、咖啡酰辅酶AO-甲基转移酶、4-香豆酸-3-羟化酶、莽草酸氧-羟基肉桂酰基转移酶、咖啡酰辅酶A3-0-甲基转移酶。结果如表6~9。
3讨论与结论
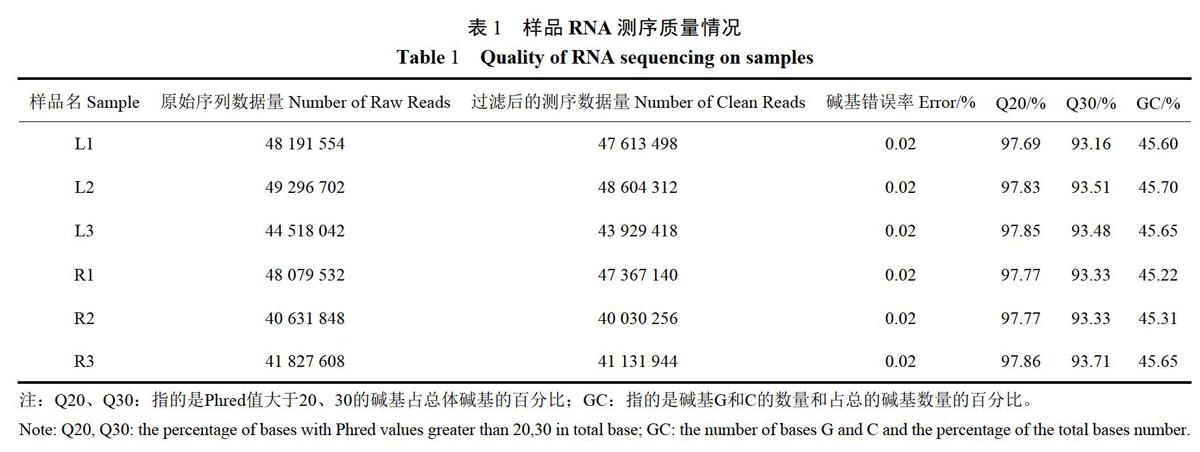
在本试验中,我们采用IluminaHiSeq”^高通量测序技术对草珊瑚叶和根的转录组进行测序,去除冗余后各获得了0.4亿多cleanreads,其中,各样品的Q20、Q30值均大于97.60%、93.10%,GC量均大于45.20%,说明建立的整个文库质量较高,再将这些读数通过使用Trinity组装成508271个转录物,其中Transcripts平均长度为740bp,最大长度为17.3kb,N50=l178bp,说明组装的转录本质量较高,测序质量良好。基于blast分析,共有148561个unigenes可以在功能注释数据库(Nr、Nt、Pfam、KOG、Swiss-Prot、Kegg和GO),上匹配,占总基因数的58.80%,剩余的unigenes由于与未知功能的蛋白质匹配,可能被认为是新的转录物或替代体,这些unigenes有待进一步的研究。
在分析基因表达水平差异时,采用DESeq2筛选出合格的readcount数据,发现草珊瑚叶和根的共同基因有93127个,叶和根的差异基因分别为36327个和52268个,同时还发现在29732种不同表达的unigenes中,有12511个上调基因和17221个下调基因,在叶中被大幅度上调,与根表达差异倍数最大的基因有抗坏血酸过氧化酶、植酰苯醌甲基转移酶、腺苷硫酸盐还原酶等;在根中大幅度下调,与叶中表达差异倍数最大的基因有葡萄糖脱氢酶、类枯草素蛋白酶、谷胱甘肽转移酶等,这与Mizra-chi等人2的研究结果相似。
在差异基因KEGG显著性富集通路中,与药效密切相关的次生代谢通路包括苯丙烷类生物合成基因193个,其中差异倍数较大的上调基因有莽草酸氧一羟基肉桂酰基转移酶、过氧化物酶、B-葡萄糖苷酶,下调基因有8-羟基香叶醇脱氢酶、过氧化物酶、甘露醇脱氢酶;倍半萜类和三萜类生物合成基因82个,其中差异倍数较大的上调基因有倍半萜合酶、锗烷烯-D合酶,下调基因有(一)一锗烷烯D合酶、valencene合酶、8-镉烯合酶同工酶、角鲨烯合酶:萜类生物合成基因40个,其中差异倍数较大的上调基因有赤霉素2-B-双加氧酶、ent-kaur-16-烯合酶,下调基因有en-kaurene氧化酶、戊二烯丙基二磷酸合酶、ent-kaurenoicacidoxidase、赤霉素2-B-双加氧酶;类黄酮生物合成基因35个,其中差异倍数较大的上调基因有黄酮醇合酶/黄烷酮3-羟化酶、莽草酸氧羟基肉桂酰基转移酶、查尔酮合成酶、黄烷酮3-羟化酶,下调基因有vinorine合酶、咖啡酰辅酶AO-甲基转移酶、4-香豆酸-3-羟化酶、莽草酸氧-羟基肉桂酰基转移酶、咖啡酰辅酶A3-0-甲基转移酶。
对于苯丙烷类生物合成代谢,穆红梅等巧总结了植物中苯丙烷类物质生物合成的主要途径,其下游分支有形成木质素类的成分、形成花青素、单宁等物质和形成黄酮类成分(包括查尔酮、黄烷酮、总黄酮)。其中,黄酮类物质作为草珊瑚的主要化学成分,具有抗癌、抗肿瘤、消炎抗菌、抗氧化、降血脂的功效。王敦清等26研究发现,在草珊瑚不同部位中,叶的总黄酮含量相对较高,本试验的结果不仅从基因的角度证明了王敦清等的研究,还进一步发现在叶中差异最大的基因是黄酮醇合酶/黄烷酮3-羟化酶基因,该类基因显著上调,其下游产物:高良姜素、杨梅素、山奈素、槲皮素的含量显著增多。因此,在临床上治疗癌定、肿瘤、心血管、肝脏、神经系统等疾病时往往可以优先选择草珊瑚的叶作为主要原料部位。在苯丙烷类物质中也包括木质素类(香豆素类)成分,如现行的药典规定草珊瑚含量测定的指标性成分之一的异嗪皮啶!。包侠萍56发现,草珊瑚中异嗪皮啶的含量在根中最高,其次是茎、叶中最低;本试验发现,在根中差异倍数最大的基因是8-羟基香叶醇脱氢酶,其下游产物芥子醇参与木质素类生物合成途径”,故进一步佐证了合成异嗪皮啶成分的基因在叶和根中的差异较为显著,认为差异与8~羟基香叶醇脱氢酶基因显著上调有关。而对于植物萜类物质生物合成代谢,近年来已有多数研究学者对其进行详尽的归纳总结8-39,药典中规定草珊瑚以全草人药,其化学成分中含量最丰富的是倍半萜类的成分,在差异基因KEGG富集通路排名靠前的结果中,我们可以发现草珊瑚叶和根在二萜类生物合成代谢上差异较大,以根中的表达较高,差异最大的基因是en-kaurene氧化酶,其下游产物是ent-Kaur-16-en-19-oate,该基因的下调可能是二者疗效差异的指标之一;而倍半萜类和三萜类生物合成代谢上基因差异性不是很显著,差异基因倍半萜合酶和(-)-锗烷烯D合酶的下游产物均为(-)-锗烷烯,说明叶和根倍半萜类化合物含量相差不大,以叶中含量较高,并且仅在根中发现角鲨烯合酶基因表现为上周,说明根还具有一定的抗氧化、保肝、促进血液循环等作用,对治疗肝和心血管方面的疾病具有优势。因此,本试验可以表明草珊瑚的叶和根之间基因表达的显著差异,主要表现在苯丙烷类、倍半萜类和三萜类、二萜类、类黄酮生物合成次生代谢途径的差异。其中上调倍半萜合酶、ent-kaur-16-烯合酶、黄酮醇合酶/黃烷酮3~羟化酶等基因和下调8-羟基香叶醇脱氢酶、vinorine合酶、角鲨烯合酶等基因,是叶和根疗效差异的主要分子机制。
由于前人未对草珊瑚开展过全面的基因组测序,可供参考的遗传信息较少,在一定程度上限制了草珊瑚功能基因的发掘和研究。本研究获得了草珊瑚叶和根的转录组信息,通过比较不同部位的差异基因表达,尤其是叶和根在次生代谢中相关的基因差异性,可为进一步分析草珊瑚叶和根之间可能的次生代谢差异分析提供基因表达方面的信息,为草珊瑚叶和根不同药用价值分析提供了重要信息与线索,有利于提升草珊瑚叶和根资源的精准利用。
参考文献:
[1]福建省科学技术委员会《福建植物志》编写组.福建植物志:第四卷[M].福州:福建科学技术出版社,1990.
[2]中国科学院《中国植物志》编辑委员会.中国植物志[M].北京:科学出版社,2005:287-290.
[3]国家药典委员会.中华人民共和国药典:2015年版一部[M].北京:中国医药科技出版社,2015:234-235.
[4]贾敏如,李星炜.中国民族药志要[M].北京:中国医药科技出版社,2005:365366.
[5]杨荣平,王宾豪,励娜,等.GC-MS法分析肿节风叶中挥发油化学成分[J].中成药,2008,30(11):1703-1704.
[6]徐丽丽.全缘金粟兰及草珊瑚的化学成分研究[D].昆明:云南中医学院,2016.
[7]徐艳琴,刘小丽,黄小方,等.草珊瑚的研究现状与展望[J].中草药,
2011,42(12):2552-2559.
[8]周斌,刘可越,常军,等.中药肿节风的化学成分和药理作用研究进展[J].中国现代应用药学,2009,26(12):982-986.
[9]姜伶,李景辉.中药肿节风的抗肿瘤作用研究进展[].中国执业药师,2014,11(04):29-31,35.
[10]梅全喜,胡莹.肿节风的药理作用及临床应用研究进展[].时珍国医国药,2011,22(1):230-232.
[11]孙洪计,魏慧君.RNA一Seq技术在转录组研究中的应用].中外医学研究,2018,16(20):184-187.
[12]王媛媛,杨美青.药用植物转录组的研究进展[J].安徽农学通报,2019,25(8):13-15,52.
[13]唐娟.三个茯苓品种的品质特性及转录组分析[D].长沙:湖南农业大学,2016.
[14]邓楠,史胜青,常二梅,等.膜果麻黄种子不同发育时期的转录组测序分析[J].东北林业大学学报,2015,43(2):28-32.
[15]谢冬梅,俞年军,黄璐琦,等.基于高通量测序的药用植物“凤丹根皮的转录组分析[J].中国中药杂志,2017,42(15):2954-2961.
[16]陈延清,胡志刚,刘大会,等.药用植物冬凌草高通量转录组测序与分析[J].中国现代中药,2018,20(12):1476-1482.
[17]朱孝轩.长春花转录组与萜类吲哚生物碱代谢途径研究[D].北京:北京协和医学院,2015.
[18] GRABHERR M G, HAAS B J, YASSOUR M, et al. Full-lengthtranscriptome assembly from RNA-Seq data without a reference genome [J]. Nature Biotechnology, 2011,29 (7) : 644-652.
[19] GOTZ S, GARCIA-GOMEZ J M, TEROL J, et al. High-throughputfunctional annotation and data mining with the Blast2GO suite [J]. Nucleic Acids Research, 2008, 36 (10) : 3420-3435.
[20] LOVE M I, HUBER W, ANDERS S. Moderated estimation of foldchange and dispersion for RNA-seq data with DESeq2 [J]. Genome Biology, 2014, 15 (12) : 550.
[21] YOUNG M D, WAKEFIELD MJ, SMYTH G K, et al. Gene ontologyanalysis for RNA-seq: accounting for selection bias [J]. Genome Biology, 2010, 11 (2) :R14.
[22] MIZRACHI E, HEFER C A, RANIK M, et al. De novo assembledexpressed gene catalog of a fast-growing Eucalyptus tree produced by Illumina mRNA-Seq [J]. BMC Genomics, 2010, 11 (1) : 681.
[23]穆紅梅,杜秀菊,张秀省,等.植物MYB转录因子调控苯丙烷类生物合成研究[J].北方园艺,2015(24):171-174.
[24]邵佳.草珊瑚总黄酮提取纯化及药理作用研究[D].贵阳:贵州大学,2008.
[25]郑永标,许小萍,邹先文,等.草珊瑚药材抗氧化活性化学成分研究[J].福建师范大学学报(自然科学版),2016,32(3):98-102.
[26]王敦清,李先春.草珊瑚根茎叶中总黄酮成分的研究[J].中草药,1996,27(6):337-338.
[27]陈郑,哈文波.高良姜素抗肿瘤作用机制的研究进展[J].医学综述,2017,23(9):1752-1756.
[28]张旭光,尹航,陈峰,等.高良姜素药理活性的研究进展[J].中国现代中药,2016,18(11):1532-1536.
[29]吴少花,陈君,刘亚萌,等.杨梅素抗肿瘤活性研究进展[].吉林医药学院学报,2015,36(5):381-383.
[30]王潞,周云英.杨梅素抗感染、抗炎及抗氧化活性研究进展[].中草药,2019,50(3):778-784.
[31]林国钡,谢燕,李国文.杨梅素的研究进展[J].国际药学研究杂志,2012,39(6):483-487.
[32]翟廣玉,马海英,郜蕾.槲皮素及其衍生物的抗肿瘤活性研究进展[J].化学试剂,2015,37(2):97-103.
[33]陈振华,胡晓艳,赵滕,等.槲皮素对心血管系统疾病的影响及其新剂型研究进展].时珍国医国药,2019,30(2):440-443.
[34]张超,李昌平.槲皮素治疗非酒精性脂肪性肝病的作用机制研究进展[J].中药新药与临床药理,2015,26(5):718-721.
[35]石玥,梁晓春.槲皮素防治神经退行性疾病的机制研究进展[J].中国中西医结合杂志,2012,32(10):1432-1435.
[36]包侠萍.草珊瑚不同部位及不同采收期有效成分含量的考察[J].海峡药学,2014,26(12):42-44.
[37]冯鹤翔,涂轶.木质素生物合成的研究[J].青岛大学学报(自然科学版)2018,31(1):46-54.
[38]时敏,王瑶,周伟,等.药用植物萜类化合物的生物合成与代谢调控研究进展[J].中国科学:生命科学,2018,48(4):352-364.
[39]苏文炳,蒋园园,白昀鹭,等.转录因子调控植物萜类化合物生物合成研究进展[J].农业生物技术学报,2019,27(5):919-926.
[40]金祖汉,金捷,毛培江,等.角鲨烯对四氯化碳急性肝损伤模型小鼠的抗氧化和护肝作用研究[J].浙江中医药大学学报,2015,39(9):666-670.
[41]缪云萍,陈爱瑛,夏志国,等.角鲨烯对小鼠急性酒精性肝损伤的保护作用[J].食品工业科技,2015,36(16):364-365,377.
[42] KATSELOU M G, MATRALIS A N, KOUROUNAKIS A P.Developing potential agents against atherosclerosis: Design, synthesis and pharmacological evaluation of novel dual inhibitors of oxidative stress and Squalene Synthase activity [J]. European Journal of Medicinal Chemistry, 2017, 138: 748-760.
(责任编辑:吴宇琳)
车苏容,张家源,卢伟,等.转录组测序法研究草珊瑚叶和根的基因差异表达[J].福建农业学报,2020,35(6):598-610.
