活血补肾壮骨方对GIOP型大鼠骨折愈合的作用及对骨密度、血清碱性磷酸酶和骨钙素水平的影响*
2020-11-09邓丹华魏迎亮
段 硕 邓丹华 陈 磊 魏迎亮
(1.辽宁省沈阳市骨科医院,辽宁 沈阳 110044;2.辽宁省丹东市联勤保障部队第九六六医院,辽宁 丹东 118000;3.辽宁省沈阳二〇四医院,辽宁 沈阳 110043;4.中国医科大学附属盛京医院,辽宁 沈阳110004)
糖皮质激素性骨质疏松(GIOP)是指长期应用糖皮质激素(GC)治疗疾病而引起的继发性骨质疏松,以骨量减少、骨微结构破坏、骨强度下降为主要特征的一种代谢性疾病,发病率较高,仅次于绝经后和老年性骨质疏松[1]。GIOP易并生骨折,且愈合困难,致残率较高。目前临床对GIOP的治疗无特效方法,而GC又因其强大的药理作用被广泛应用于临床上,很多患者必须长期甚至终生使用,因此,寻求有效防治GIOP的方法是临床亟待解决的问题。活血补肾壮骨方是沈阳市骨科医院协定处方,有补肾壮骨、活血化瘀之功效。本研究通过肌内注射地塞米松诱导建立GIOP大鼠模型,
采用活血补肾壮骨方干预,旨在探讨活血补肾壮骨方对GIOP模型大鼠骨折愈合的作用及机制。
1 材料与方法
1.1 实验动物 60只清洁级雄性SD大鼠,7~8周龄,平均体质量(250±20)g,购自辽宁长生生物技术有限公司,许可证号:SCXK(辽)2018-0002。室温20~25℃、相对湿度40%~50%下饲养,通风环境良好,自由饮水进食。
1.2 试药与仪器 活血补肾壮骨方组成:杜仲15 g,骨碎补15 g,淫羊藿15 g,淮山药15 g,菟丝子15 g,紫丹参10 g,当归10 g,红花10 g,茯苓10 g,龙骨 15 g,独活10 g,续断10 g,熟地黄20 g,川芎10 g,牛膝 10 g,甘草10 g;饮片均由本医院药房提供并煎煮,药材加水煎煮2次,生药质量浓度1 mg/mL。地塞米松磷酸钠注射液(广州白云山天心制药股份有限公司,批号1902067,规格:1 mL∶5 mg);阿仑膦酸钠(扬子江药业集团上海海尼药业有限公司,批号1903182,规格:10 mg/片);水合氯醛(分析纯,天津市瑞金特化学品有限公司);抗酒石酸酸性磷酸酶(TrACP)、Ⅰ型胶原交联羧基端肽(CTX-1)、碱性磷酸酶(ALP)、骨钙素(OC)试剂盒均购自南京建成生物工程研究所。PDiscovery QDR型双能X线骨密度仪(美国Hologic公司);ElectroForce 3200生物材料实验仪(美国Instron公司);J-D200生物显微镜(深圳拓天仪器设备有限公司);TE2000型荧光显微镜(日本Nikon公司);计算机X射线摄像仪(日本柯尼卡美能达公司);OLYMPUS BX-51型骨组织形态计量仪(美国BIOQUANT公司)。
1.3 分组与造模 随机法将实验大鼠分为空白组10只、造模组50只,造模组又分模型组、西药组,中药组(活血补肾壮骨方)低剂量、中剂量、高剂量各10只。建模前1周适应性饲养,除空白组外,其余大鼠均大腿部肌内注射地塞米松磷酸钠注射液,剂量1 mg/kg,每日1次,每周3次,每周称1次体质量,根据体质量调整剂量,连续注射9周。骨密度下降提示造模成功。9周后,按照闭合骨折模型方法,采用骨髓内针固定法行大鼠左侧股骨骨折。3.5%水合氯醛(10 μL/g)腹腔麻醉,自左股骨髁间凹处,垂直穿入直径1.0 mm克氏针达髓腔,拔出克氏针,在股骨中段以拇指为支点,用较缓和的力量徒手折骨,当感到骨折时,停止用力,避免骨折移位,克氏针从原穿针点进针,穿针到骨折远端,针尾埋于皮下,多余部分剪除,局部消毒后归笼。术后3 d常规抗感染处理,肌内注射青霉素100万U/kg。X线显示左股骨骨折,对位良好,髓内针固定在位,造模成功。建模未成功:空白组、模型组和中药中、高剂量组各1只,西药组、中药低剂量组各2只。
1.4 干预方法 术后第2天空白组和模型组给予生理盐水灌胃,剂量5 mg/kg;西药组给予阿仑膦酸钠5 mg/kg灌胃;中药组给予活血补肾壮骨方灌胃,低剂量组2.5 mg/kg、中剂量组5 mg/kg、高剂量组7.5 mg/kg;每天灌胃1次,连续10周。
1.5 标本采集与检测 骨转化指标测定:心脏取血,离心,取上层血清,采用试剂盒检测TrACP、CTX-1、ALP、OC水平,严格按说明书操作。骨密度测定:大鼠处死后无菌条件下剥离左侧股骨,剔除软组织,4℃避光保存在70%乙醇中,以双能X线骨密度仪测量股骨的骨密度(BMD)、组织骨密度(TMD),扫描2 cm阶段。骨组织形态计量学检测:截取剥离的左侧股骨远端干骺端组织,应用骨组织形态计量仪测定骨组织形态参数,包括骨小梁面积百分数(TbAr%)、骨小梁分离度(Tb.Sp)、骨小梁厚度(Tb.Th)、骨小梁数量(Tb.N)。骨生物力学测量:剥离的左侧股骨用生理盐水纱布包裹置于-20℃冰箱内保存备用。股骨解冻后行三点弯曲试验,支点跨距为20 mm,中央垂直(股骨与载荷成90°角)施加载荷,速率2 mm/min,测量并计算最大载荷、最大挠度和最大应力。骨组织染色:将大鼠股骨组织分离,取股骨上端标本,4%多聚甲醛固定24 h,脱钙液充分脱钙1个月,每周更换1次。石蜡包埋,制作切片,HE染色,显微镜下观察。
1.6 统计学处理 应用SPSS22.0统计软件。计量资料以()表示,组间或组内数据比较采用t检验;采用χ2检验进行计数资料的比较,以n(%)表示计数资料。P<0.05为差异有统计学意义。
2 结 果
2.1 各组大鼠骨转化指标比较 见表1。与空白组比较,模型组血清TrACP、CTX-1均明显升高,ALP、OC均明显降低(P<0.05);与模型组比较,各治疗组大鼠TrACP、CTX-1均明显降低,ALP、OC均明显升高(P<0.05);与西药组比较,高剂量组各指标均明显改善(P<0.05)。
表1 各组大鼠骨转化指标比较(±s)

表1 各组大鼠骨转化指标比较(±s)
与对照组比较,*P<0.05;与模型组比较,▲P<0.05;与西药组比较,△P<0.05。下同
组别空白组模型组西药组低剂量组中剂量组高剂量组n 9 9 8 8 9 9 TrACP(ng/mL)43.49±1.21 54.65±3.93*47.04±2.02*▲49.63±2.78*▲46.85±1.86*▲44.48±1.63▲△CTX-1(μmol/L)10.35±3.19 193.31±43.42*30.27±4.36*▲34.17±4.88*▲26.74±4.03*▲21.52±3.41▲△ALP(pg/mL)59.86±1.47 40.07±1.45*51.74±1.29*▲48.75±1.32*▲53.68±1.26*▲57.59±1.02▲△OC(pg/mL)337.20±26.78 239.97±30.26*291.46±20.53*▲278.82±18.39*▲300.28±21.64*▲311.28±17.71▲△
2.2 各组大鼠脑骨密度比较 见表2。与空白组比较,模型组BMD、TMD均明显降低(P<0.05);与模型组比较,各治疗组大鼠BMD、TMD均显著增加(P<0.05);与西药组比较,高剂量组BMD、TMD增加明显(P<0.05)。
表2 各组大鼠脑骨密度比较(g/cm3,±s)

表2 各组大鼠脑骨密度比较(g/cm3,±s)
组别空白组模型组西药组低剂量组中剂量组高剂量组n998899 BMD 0.38±0.03 0.23±0.02*0.29±0.02*▲0.27±0.02*▲0.31±0.01*▲0.34±0.02▲△TMD 0.85±0.02 0.73±0.01*0.79±0.02*▲0.77±0.01*▲0.80±0.02*▲0.82±0.02▲△
2.3 各组大鼠股骨骨形态计量学指标比较 见表3。与空白组比较,模型组TbAr%、Tb.N、Tb.Th明显减少,Tb.Sp明显增加(P<0.05);与模型组比较,各治疗组大鼠TbAr%、Tb.N、Tb.Th明显增加,Tb.Sp明显减少(P<0.05);与西药组比较,高剂量组各指标显著改善(P<0.05)。
表3 各组大鼠股骨骨形态计量学指标比较(±s)

表3 各组大鼠股骨骨形态计量学指标比较(±s)
组别空白组模型组西药组低剂量组中剂量组高剂量组n 9 9 8 8 9 9 TbAr%23.35±5.78 15.59±4.41*20.03±5.16*▲18.97±5.42*▲20.54±5.17*▲21.79±6.18▲△Tb.N(个/mm2)5.69±0.42 4.28±0.63*5.11±0.45*▲4.93±0.54*▲5.16±0.48*▲5.32±0.46▲△Tb.Th(μm)79.36±8.57 50.71±9.32*64.82±7.91*▲60.26±8.13 68.34±8.38*▲71.49±7.48▲△Tb.Sp(mm)0.20±0.01 0.31±0.03*0.25±0.02*▲0.26±0.01*▲0.23±0.02*▲0.22±0.01▲△
2.4 各组大鼠骨生物力学指标比较 见表4。与空白组比较,模型组最大载荷、最大挠度、最大应力均显著降低(P<0.05);与模型组比较,各治疗组最大载荷、最大挠度、最大应力均明显升高(P<0.05),与西药组比较,高剂量组各指标均升高明显(P<0.05)。
表4 各组大鼠骨生物力学指标比较(±s)
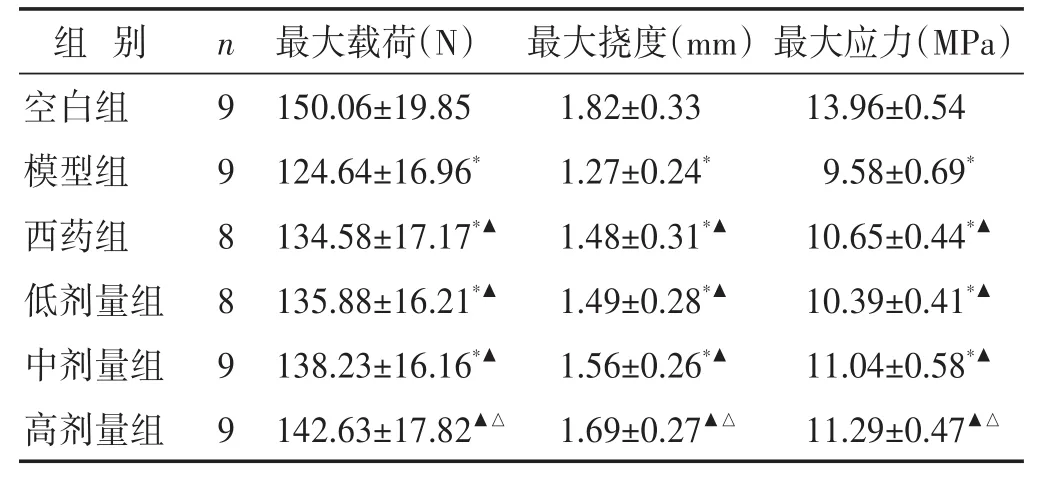
表4 各组大鼠骨生物力学指标比较(±s)
组别空白组模型组西药组低剂量组中剂量组高剂量组n 9 9 8 8 9 9最大载荷(N)150.06±19.85 124.64±16.96*134.58±17.17*▲135.88±16.21*▲138.23±16.16*▲142.63±17.82▲△最大挠度(mm)1.82±0.33 1.27±0.24*1.48±0.31*▲1.49±0.28*▲1.56±0.26*▲1.69±0.27▲△最大应力(MPa)13.96±0.54 9.58±0.69*10.65±0.44*▲10.39±0.41*▲11.04±0.58*▲11.29±0.47▲△
2.5 各组大鼠骨组织形态比较 见图1。模型组骨小梁明显变细、稀疏;各治疗组大鼠骨小梁较模型组明显增加。

图1 各组大鼠骨组织形态比较(HE染色,100倍)
3 讨论
GIOP属于继发性骨质疏松,GC可直接作用于成骨细胞、破骨细胞和骨细胞,通过促进破骨细胞生成,延长其生存时间以促进骨吸收,诱导成骨细胞和骨细胞凋亡、抑制成骨细胞分化和降低成骨功能等以抑制骨形成,同时抑制Ⅰ型胶原合成,阻碍其与非胶原蛋白结合,使骨丢失加快、骨增殖能力下降,最终引起骨质疏松。骨折是骨质疏松的常见并发症之一,GIOP患者在服用GC的3~6个月内,骨折发生率明显增加[2],多见于椎骨、腕部及髋部,以髋部骨折发生率最高。
骨代谢评价包括骨量和骨质量两个主要方面。骨密度是反映骨量的有效指标,与骨折危险程度密切相关,也是诊断骨质疏松的必要条件[3]。CTX-1是Ⅰ型胶原的降解产物,所具有的特异性结构使其在血清中有较佳的稳定性,因此,血清CTX-1水平能特异性反映破骨细胞的吸收活性[4]。TrACP是由破骨细胞分泌的非胶原蛋白,和胶原代谢产物一起被分泌到细胞外,故TrACP与骨吸收水平成正相关[5]。ALP和OC均由成骨细胞产生,前者是总碱性磷酸酶的重要组成部分,后者是骨基质中含量最丰富的标志物,二者均反映骨形成状态[6-7]。骨组织形态学是研究骨组织结构和骨量等静态特性;骨生物力学则是骨强度、骨结构、骨量的综合体现,其中骨结构力学强度是反映骨质疏松性骨折风险的最有效指标,三点弯曲试验是常用的测量方法,最大载荷反映骨的刚度,最大应力反映骨质的内在硬度。骨生物力学性能降低是骨折发生的重要原因之一,同时也是评价药物治疗骨质疏松疗效的重要指标[8]。
在中医学上,GIOP 属于“骨痿”“骨痹”“骨枯”范畴。中医学认为,骨质疏松的发病以肾虚为本,病机为肾虚精亏,骨空失养,阴阳两虚;治疗原则以补肾壮骨填精为主,补肝脾、活血化瘀为辅[9]。本方中淫羊藿、菟丝子、杜仲补肝肾、强筋骨、益精壮阳;续断、骨碎补补肝肾、强骨壮筋、续折伤;熟地黄补血养阴、填精益髓;丹参、红花、当归、牛膝活血化瘀、通经止痛;山药补脾益肾;茯苓健脾安神;龙骨镇心安神,平肝潜阳;川芎活血散瘀,祛风止痛;独活通痹止痛;甘草补脾气、调和诸药,全方共奏补肾壮骨、活血化瘀之功效。现代药理学研究证实[10-11]:牛膝总皂苷可升高骨质疏松大鼠碱性磷酸酶活性和血清骨钙素水平,改善骨代谢;骨碎补总黄酮能提高血钙、血磷水平,激活成骨细胞,明显增加骨小梁宽度和密度,减少骨小梁间隙[12];杜仲可降低骨折早期的血钙水平,升高血磷,促进骨折断端矿物质沉积,促进骨痂生长和骨折愈合;续断可以调节骨形成和骨吸收指标,降低骨转换率,增加骨密度,改善骨小梁微结构,提高股骨强度,降低骨折风险;丹参可预防骨质疏松,以预防松质骨为主,可显著增加BMD,降低磷含量[13-16]。
在本研究中,各治疗组大鼠TrACP、CTX-1、Tb.Sp均明显降低,ALP、OC、BMD、TMD、TbAr%、Tb.N、Tb.Th、最大载荷、最大挠度、最大应力均明显升高;活血补肾壮骨方高剂量组各项指标均改善明显。因此我们认为,活血补肾壮骨方能显著升高GIOP大鼠的血清ALP、OC含量,降低TrACP、CTX-I水平,增加BMD、Tb.N缩小骨小梁间隙,改善骨显微结构,增强骨强度,提升骨生物力学性能,从而有效促进骨折愈合,对抗糖皮质激素的致骨质疏松作用,改善GIOP症状,保护骨组织。
