耐药MTB分离株对不同组合抗结核药品体外药物敏感性试验的结果分析
2020-11-09应若嫣黄晓辰王洁刘一典沙巍杨华
应若嫣 黄晓辰 王洁 刘一典 沙巍 杨华
结核病是由MTB引起的慢性传染性疾病,疗程长,易耐药,严重危害人类的身体健康,是全球重大公共卫生问题。2010年全国第五次结核病流行病学抽样调查报告[1]指出,复治患者分离菌株对4种一线抗结核药品和11种二线抗结核药品的任一耐药率分别为35.9%和38.5%,可见复治结核病已成为耐药结核病的主要来源,如果未积极治疗极易发展成为耐多药结核病(multidrug-resistant tuberculosis,MDR-TB),甚至广泛耐药结核病(extensively drug-resisitant tuberculosis,XDR-TB),迁延不愈[2]。为研究针对首次复治肺结核患者更快速更有效的治疗方案[3],同济大学附属上海市肺科医院承担了“十一五”“十二五”“十三五”传染病重大专项——复治肺结核化学治疗新方案的研究。经“十一五”研究验证,推出了复治肺结核超短程治疗方案[4],将原标准方案(H-R-Z-E)中的利福平(R)、异烟肼(H)替换为含莫西沙星(Mfx)、对氨基水杨酸异烟肼(Pa)、利福布汀(Rfb)或利福喷丁(Rft)的2种新方案,即Mfx-Pa-Rfb-E-Z或Mfx-Pa-Rft-E-Z(其中E:乙胺丁醇;Z:吡嗪酰胺),并在临床开展应用。为了更准确地评估新方案的有效性,本研究选取入组“十二五”项目的首次复治肺结核患者分离培养的92株耐药菌株为研究对象,优化了组合药品药物敏感性试验(简称“药敏试验”)检测方法[5],通过计算新方案对各菌株的抑菌浓度指数(fractional inhibitory concentration index,FICI),对比分析标准方案和新方案体外组合药品的抑菌效果,进一步评估优化抗结核新方案对首次复治肺结核患者的应用价值。
资料和方法
一、材料
1.菌株:搜集同济大学附属上海市肺科医院“十二五”国家科技重大专项入组的148例首次复治肺结核患者,通过对患者痰标本进行BACTEC MGIT 960和改良罗氏法培养[包括H、R、E、Z、Pa、Mfx、Rfb、Rft]获取167株MTB分离株,将75例患者经上述两种方法进行药敏试验结果均为阳性的92株耐药菌株(包括36株MDR-MTB、54株XDR-MTB和2株单耐H菌株)作为研究对象,并保存于-20 ℃甘油中。MTB标准株(H37Rv,编号:ATCC27294)购自国家菌种保存中心,作为实验对照。本研究项目获得医院医学伦理学委员会批准,批号:k19-008。
2.抗结核药品:H、R、Pa、Rfb和Rft干粉均购自美国Sigma-Aldrich(上海)贸易有限公司,Mfx原粉购自美国MCE公司。药品配置:所有药品均称量10 mg,Pa干粉用1 ml 4%NaOH配置成10 mg/ml,H干粉用1 ml 18.2 MΩ.cm的超纯水配置成10 mg/ml,R、Rfb、Rft干粉用1 ml二甲基甲酰胺溶解配置成10 mg/ml,Mfx干粉用1 ml二甲基亚砜溶解配置成10 mg/ml,所有备用药品溶液均用0.22 μm无菌滤器过滤除菌,分装保存于-80 ℃下。
3.仪器与试剂:96孔无菌U形板购自浙江拱东医疗科技有限公司(原浙江拱东医用塑料厂),61010A-1型比浊仪、Middlebrook 7H9培养基干粉、营养添加剂(OADC)均购白美国BD公司。应用液为含10%营养添加剂的Middlebrook 7H9液体培养基,包被液为70%的18.2 MΩ.cm的超纯水+30%无水乙醇+5%蔗糖。
二、研究方法
采用最低抑菌浓度(MIC)三维棋盘法[6]分别进行92株菌株和1株标准菌株(H37Rv)对H-R、Mfx-Pa、Mfx-Pa-Rfb、Mfx-Pa-Rft 4种药品组合方案的体外药敏试验,分别以FICI≤0.5(2种药品组合)或FICl≤0.75(3种药品组合)作为是否具有协同作用的判断界值,评估不同药品的组合作用。
1.配置96孔板检测浓度:92株菌株和1株标准菌株(H37Rv),每株菌对应12块96孔板,分别为H+R、Mfx+Pa、Mfx-Pa+Rfb(0.125 mg/L)、Mfx-Pa+Rfb(0.25 mg/L)、Mfx-Pa+Rfb(0.5 mg/L)、Mfx-Pa+Rfb(1 mg/L)、Mfx-Pa+Rfb(2 mg/L)、Mfx-Pa+Rft(1 mg/L)、Mfx-Pa+Rft(2 mg/L)、 Mfx-Pa+Rft(4 mg/L)、Mfx-Pa+Rft(8 mg/L)、Mfx-Pa+Rft(16 mg/L)药敏试验检测板。依据文献[4] 配置96孔板药品组合(从上至下依次为A至H行,从左到右依次为1至12列,如表1所示),并进行如下改动:
1)H-R组合及H、R单药MIC浓度测定微孔板配置范围:首先将A1孔和H12孔设为对照孔,各加入20 μl无药培养基,再在第一行1~12和第一列A~H每孔各加入10 μl 电阻率为18.2 MΩ.cm的超纯水,继而沿96孔板Y轴从B行至H行每孔添加10 μl初始配置浓度为2.5、5、10、20、40、80、160 mg/L 的H(浓度由小到大)、沿96孔板X轴向2~12列每孔添加10 μl初始配置浓度为0.6、1.25、2.5、5、10、20、40、80、160、320、640 mg/L的R(浓度由小到大),则每孔混合后含液量均为20 μl,最终配置成含H的终浓度为1.25~80 mg/L和R的0.3~320 mg/L的单药或两药混合的96孔板培养基。实验前将每孔铺满20 μl含药培养基的96孔U形板放在无菌超净台中风干后制成含药干板待用。使每孔在加入200 μl菌液后的H终浓度为0.125~8 mg/L,R为0.03~32 mg/L(表1),为初始配置时浓度的1/20。
2)Pa-Mfx组合及Pa、Mfx单药MIC浓度测定微孔板配置范围:配置方法同H+R,其中Pa的初始配置浓度为0.15、0.3、0.6、1.2、2.5、5、10、20、40、80、160 mg/L,Mfx为0.6、1.2、2.5、5、10、20、40 mg/L。使每孔在加入200 μl菌液后的Mfx终浓度为0.03~2 mg/L,Pa为0.0075~4 mg/L,均为初始配置时浓度的1/20。
3)Pa-Mfx-Rfb或Pa-Mfx-Rft组合及Rfb或Rft单药MIC浓度测定微孔板配置范围:将预先配置好的Rfb或Rft的5个初始浓度梯度溶液(Rfb为1.25、2.5、5、10、20 mg/L,Rft为10、20、40、80、160 mg/L),分别加至含Pa和Mfx的5个96微孔板除A1外的所有孔中,再加入200 μl菌液,使Rfb的终浓度为0.125、0.25、0.5、1、2 mg/L,Rft为1、2、4、8、16 mg/L,H12为单药Rfb/Rft的5个不同浓度的MIC值。

表1 96孔微孔板药敏试验检测H和R的药品浓度(mg/L)
以Mfx-Pa-Rfb(0.125 mg/L)添加方法为例:(1)准备18支5 ml离心管,分别与96孔板对应标号,为2~12和B~H。取0.0125 ml预先配置好的10 mg/ml的Rfb备用溶液,加入100 ml包被液,制成1.25 mg/L的Rfb溶液,分别加入上述5 ml离心管中,从左2至右11分别加入2.5 ml,右12管加入5 ml;从上B至下G分别加入2.5 ml,下H管加入5 ml。(2)取0.08 ml预先配置好的Pa备用液(10 mg/ml)加入到配置好的12管Rfb溶液(1.25 mg/L,5 ml)中,形成含160 mg/L的Pa和含1.25 mg/L的Rfb的溶液Ⅰ,混匀后取2.5 ml溶液Ⅰ依次从右11号管往左到2号管加入到上述Rfb溶液(1.25 mg/L,2.5 ml)中进行梯度稀释。(3)取0.02 ml预先配置好的Mfx备用液(10 mg/ml)加入到配置好的H管Rfb溶液(1.25 mg/L,5 ml)中,形成含40 mg/L的Mfx和含1.25 mg/L的Rfb的溶液Ⅱ。混匀后取2.5 ml溶液Ⅱ依次从下G号管往上到B号管加入到上述Rfb溶液(1.25 mg/L,2.5 ml)中进行梯度稀释。(4)除A1孔外,第1行和第1列每孔各加入10 μl含1.25 mg/L的Rfb溶液,最终形成第一行和第一列的梯度浓度;H12孔加入20 μl含1.25 mg/L的Rfb溶液作为单药对照。继而将配置好的梯度溶液Ⅰ沿着Y轴从左2至右12每孔依次添加10 μl,将配置好的梯度溶液Ⅱ沿着X轴从上B至下H每孔依次添加10 μl,每孔混合后含液量均为20 μl,添加200 μl菌液后最终形成Mfx终浓度为0.03~2 mg/L,Pa为0.0075~8 mg/L,均为初始配置时浓度的1/20;Rfb为0.125 mg/L,为初始配置时浓度的1/10。
2.组合药品药敏试验:取适量7H9液体培养基内生长至对数期的标准菌株(H37Rv)菌液,磨菌比浊至1个麦氏单位[约107菌落形成单位(CFU)/ml],用7H9液体培养基以1∶100稀释,使菌液浓度为105CFU/ml。取稀释后的标准菌株菌液(200 μl/孔)加入12个不同含药微孔板中,同时设置100%菌量生长对照孔加至A1孔和H12孔中,由于对照孔均位于边缘,为防止干板情况同时设置复孔。以此对比在无抗培养情况下的菌株生长情况;封板后37 ℃培养,分别于7、10、14 d后将96孔板放置于配套用的倒置放大镜上观察并记录结果,以孔底出现肉眼可见的白色菌体沉淀为阳性。标准菌株用以检测12块组合药敏板效价,不计入92株研究菌株。以标准菌株为例,其余92株菌添加方法均以此为准。
3.相关定义:
1)H、R、Pa、Mfx、Rfb、Rft的单药MIC定义为:A2~A12或B1~H1孔底菌体沉淀<100%菌量对照孔1(A1)或对照孔2(H12)所对应单药的MIC值,MIC值越小表明抑菌效果越好。
2)两药联合检测的FICI定义为:组合96孔板阵列中除A1~A12和A1~H1外各孔底菌体沉淀<100%菌量对照孔所对应的2种药品的浓度值与之前测得的两种单药MIC值之比的和,即:两药组合FICI=组合MIC[A]/单药MIC[A]+组合MIC[B]/单药MIC[B],以FICI≤0.5为协同作用,0.5
3)3种药品组合检测的FICI定义为:药品组合作用板阵列中除第1行和第1列外的孔底菌体沉淀<100%菌量对照孔所对应的3种药品浓度值与之前测得的3种单药MIC值之比的和,即:三药组合FICI=组合MIC[A]/单药MIC[A]+组合MIC[B]/单药MIC[B]+组合MIC[C]/单药MIC[C]。以FICI≤0.75为协同,0.75
协同率=两或三种组合药品表现为协同作用的菌株数/总菌株数。
三、统计学处理
采用GraphPad Prism 8.0软件进行数据的录入和分析,考虑到样本量较小,对计量资料采用中位数(四分位数) [M(Q1,Q3)]描述其离散趋势,计量资料的比较采用Wilcoxon配对检验;计数资料以百分比(%)表示,采用χ2检验或Fisher精确概率法检验。均以P<0.05为差异有统计学意义。

图1 96孔药敏试验板对H和R检测 14 d后的菌株生长情况
结 果
一、不同药品组合前后MIC检测结果分析
单药药敏试验结果显示,H和R对大部分菌株的MIC值已经整体升高,中位数分别为4和24 mg/L,但仍有少部分菌株对单药MIC值较敏感,均≤1 mg/L;而Mfx和Rfb的MIC中位数均为0.5 mg/L,抑菌效果较好。
单药H或R与组合后的R或H、Rfb或Rft与其组合Mfx-Pa后的Rfb或Rft,以及Pa与其组合Mfx、Mfx-Rfb或Mfx-Rft后的MIC值差异均有统计学意义(P值均<0.001),且组合后的MIC值明显低于组合前,Mfx与其组合Pa后的MIC值差异有统计学意义(P值<0.05);但Mfx与其组合Pa-Rfb 或Pa-Rft后的MIC值差异均无统计学意义(表2)。
二、组合药品的药敏试验检测结果分析
H-R、Mfx-Pa、Mf-xPa-Rfb、Mfx-Pa-Rft药品组合对92株菌的FICI数值范围分别为0.06~4、0.14~4、0.09~4.75、0.15~6.5,各组合药品表现为协同作用、不相关、拮抗的菌株分布株数见表3。
采用χ2检验或Fisher精确概率法检验分布情况,显示H-R与Mfx-Pa、Mfx-Pa-Rfb与Mfx-Pa-Rft药品组合的分布差异均无统计学意义(Fisher精确概率法,P=0.190;χ2=1.645,P=0.439),而H-R和Mfx-Pa与Mfx-Pa-Rfb、Mfx-Pa-Rft的分布差异均有统计学意义(χ2=12.670,P=0.002;χ2=19.420,P<0.001;χ2=18.640,P<0.001;χ2=28.500,P<0.001)。
三、4种组合药品的药敏检测结果的分层分析
1.不同耐药菌株对4种组合药品的FICI值:92株不同耐药菌株对4种组合药品的FICI值见表4。

表2 不同药品组合前后MIC对比结果
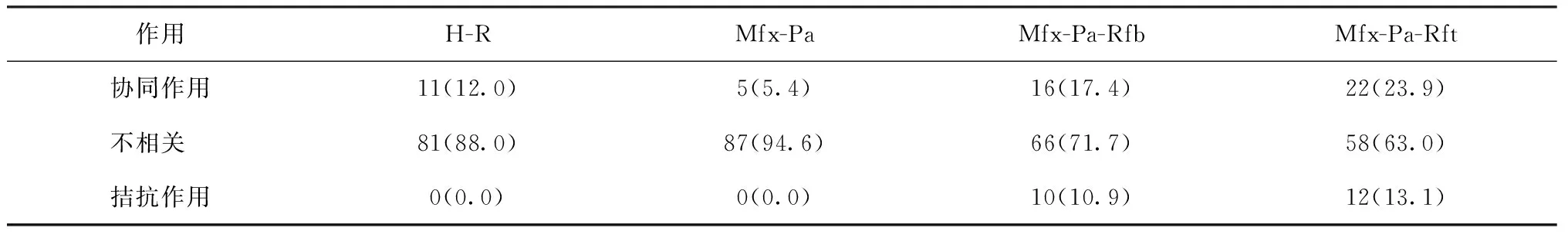
表3 92株菌株不同FICI值在4种组合药品中的分布情况

表4 不同组合药品对不同耐药MTB菌株的FICI值[M(Q1,Q3)]
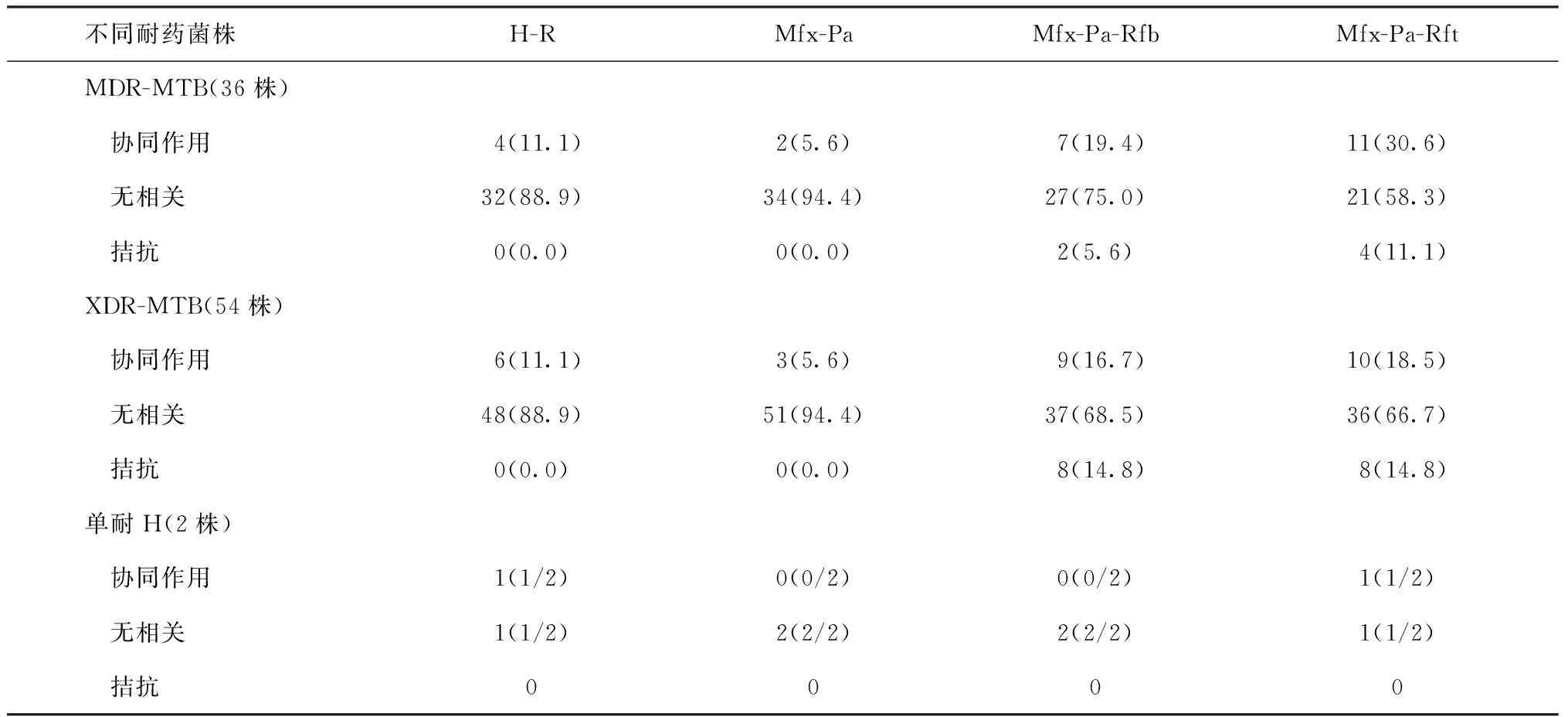
表5 不同耐药菌株药品间作用情况在4种组合药品中的分布
1)MDR-MTB分布情况:H-R与Mfx-Pa、Mfx-Pa-Rfb组合药品的分布差异均无统计学意义(Fisher精确概率法,P=0.674;χ2=0.084,P=0.772),与Mfx-Pa-Rft的分布差异有统计学意义(χ2=9.550,P=0.008);Mfx-Pa与Mfx-Pa-Rfb和Mfx-Pa-Rft的分布差异均有统计学意义(χ2=0.872,P=0.350;χ2=13.300,P=0.001);Mfx-Pa-Rfb与Mfx-Pa-Rft的分布差异无统计学意义(χ2=2.306,P=0.316)。
2)XDR-MTB分布情况:H-R组合药品与Mfx-Pa 的分布差异无统计学意义(Fisher精确概率法,P=0.489),与Mfx-Pa-Rfb和Mfx-Pa-Rft的分布差异均有统计学意义(χ2=10.020,P=0.007;χ2=10.710,P=0.005);Mfx-Pa与Mfx-Pa-Rfb和Mfx-Pa-Rft的分布差异均有统计学意义(χ2=13.230,P=0.001;χ2=14.360,P=0.001);Mfx-Pa-Rfb与Mfx-Pa-Rft的分布差异无统计学意义(χ2=0.066,P=0.967)。
2.分层分析不同方案对不同耐药菌株的协同作用:对不同耐药菌株的分层分析结果见表5。
讨 论
我国现行的复治结核病标准化学治疗方案,是一线抗结核药品的再组合及叠加,已不适合应对目前复治结核病高耐药率的现状,极易导致治愈率下降、不良反应加重、疗程延长、中断治疗,是造成MDR-TB发生的重要原因,不利于我国“三病两率”的控制[7],亟需研究新的更有效的治疗组合方案,而体外联合药敏试验可以准确评估不同药品组合对不同耐药性MTB的抑制活性,为临床制定治疗方案提供有效依据。
本研究通过对92株首次复治肺结核患者痰标本分离的耐药MTB行联合药敏检测,评价标准方案和新方案体外联合药敏试验的检测效果。由于既往对敏感菌株进行组合药品药敏检测时,发现每种药品的MIC值远远低于该药品单药的正常检测范围,为进一步准确判断FICI值,本研究通过检测不同组合药品对耐药菌株的作用,为临床选择合适的抗结核化学治疗方案,尤其是针对耐药结核病患者提供了治疗方案的依据。而且,本研究当结果统计中出现单药孔最高浓度中菌落长满的情况时,会升高两个浓度重复实验;当出现单药孔最低浓度菌落不生长的情况时,会下降两个浓度重复实验,以确保结果的可靠性。
H和R是标准方案的核心药品,但实际上很多复治患者均已经对其中1种甚至2种药品产生耐药,再用来治疗并不合理,效果较差。在本研究的组合药品中,引入了Mfx、Pa和Rfb、Rft,考虑Mfx是氟喹诺酮类中杀菌效果较好的药品,单药MIC值低(本研究中的单药MIC值为0.5 mg/L),且具有不良反应轻微、生物利用度高、组织渗透性强、消除半衰期长、与其他抗菌药品无交叉耐药性等特点[8];Pa是一种复合制剂,是由异烟肼和对氨基水杨酸组成的分子化合物,对部分耐异烟肼或对氨基水杨酸的菌株仍敏感[9],可使与Mfx、Mfx+Rfb或Mfx+Rft组合后单药的MIC值明显下降(P值均<0.001);而Rfb和Rft均为R的衍生物,三者具有高度的交叉耐药性,但有研究表明Rfb和Rft对低耐R的菌株仍保留一定的杀菌活性,尤以Rfb的效果显著[10-11],与本研究Rfb的单药MIC值明显低于Rft的单药MIC值的结果一致。
本研究不仅分析Mfx-Pa与H-R的药敏试验效果,也在Mfx和Pa两药组合的基础上分析Rfb或Rft与二者组合使用时对耐药MTB的作用效果,并与标准方案中H和R的组合药敏效果进行对比,进一步分析H-R、Mfx-Pa、Mfx-Pa-Rfb、Mfx-Pa-Rft 4种药品方案的组合作用。通过两药组合比较可以看到,H和R在组合后MIC值下降幅度均比较大,差异均有统计学意义,说明H和R两药组合有较好的协同作用;而Mfx和Pa组合后,Mfx本身的MIC值无变化,但Pa的MIC值从原来的中位数8 mg/L下降至0.0075 mg/L(P<0.001),表明Mfx可促进Pa的抑菌作用;但Mfx和Pa组合后的协同率(5.4%)低于H-R组合(12.0%),FICI值(1.5)高于H-R组合(1.25),提示Mfx-Pa较H-R不能实现更好的抑菌效果,必须再引入第三种药品,如利福平类药物[12-13]。而Rfb或Rft分别与Mfx-Pa组合后,是否会优于H-R组合,是下一步需研究解决的问题。
进一步研究发现,3药组合后的协同率明显高于两药组合,差异均有统计学意义,Mfx-Pa-Rfb或Mfx-Pa-Rft组合药品的协同率(17.4%和23.9%)明显高于H-R、Mfx-Pa,与我们前期研究结果一致[4]。而Mfx-Pa-Rfb的协同率虽低于Mfx-Pa-Rft,但差异无统计学意义 (χ2=1.645,P=0.439),与我们前期的研究结论“Mfx-Pa-Rft组合药品的协同作用明显高于Mfx-Pa-Rfb”[4]有所不同。考虑到本次研究样本量是前期研究的2.3倍,XDR-MTB菌株的数量显著增多,且均来源于临床首次复治肺结核患者,应该更具有代表性,结果更可靠。
进一步分层分析发现, Mfx-Pa-Rft对单耐H、MDR-MTB、XDR-MTB的协同率均比Mfx-Pa-Rfb高,FICI值均低于Mfx-Pa-Rfb,提示Mfx-Pa-Rft方案更有效。XDR-MTB和MDR-MTB菌株在H-R、Mfx-Pa方案中的协同率和不相关率均相同,均无拮抗。而在两种三药组合中XDR-MTB的协同率(16.7%和18.5%)均低于MDR-MTB(19.4%和30.6%),拮抗率(14.8%和14.8%)均高于MDR-MTB(5.6%和11.1%),提示XDR-MTB菌株不仅耐单药数量多,也极易对三药组合产生拮抗,提示制订XDR-TB患者治疗方案时,不仅要关注单药的耐药性,也要明确治疗方案对不同耐药菌的组合作用效果,应通过组合药品的药敏检测,选择协同率更高的药品组合。
综上所述,本课题在“十二五”研究基础上进一步优化药敏试验方法、增加样本量,验证了新方案中Mfx-Pa-Rfb或Mfx-Pa-Rft组合药品的协同效果。Rfb的单药抑菌效果好于Rft,但在Mfx-Pa-Rfb和Mfx-Pa-Rft中,Rfb的协同效果却低于Rft的协同效果,且XDR-MTB菌株不仅对耐单药种类多,也易对组合的药品产生拮抗作用,提示针对不同耐药患者选择药品时,不仅应关注单药的抑菌效果,也要考虑药品间组合使用的互相影响。后续我们将结合临床治疗结果对比复治患者不同方案治疗前后FICI值、MIC值的变化,分析研究组合药品药敏检测在治疗疗效评估中的应用价值。
志谢复旦大学公共卫生学院王伟炳教授对本研究统计学处理进行了指导和帮助。
