中性粒细胞弹性蛋白酶基因敲除改善非酒精性脂肪性肝炎小鼠库普弗细胞活化的研究
2020-11-09梁冰田吴正琴杨传玉杜卫东
梁冰田 吴正琴 杨传玉 杜卫东
非酒精性脂肪性肝炎(NASH)是非酒精性脂肪性肝病(NAFLD)的一个进行性亚型,其特征是伴或不伴有纤维化的严重肝脏炎症[1]。流行病学调查结果显示,全世界约有25%的人口患有NAFLD,其中25%是NASH。这些NASH 患者与非NASH 患者比较,更容易进展为肝硬化或肝细胞癌(HCC)[2]。除此之外,NASH 患者还容易并发代谢紊乱,如肥胖、2 型糖尿病(T2DM)和高血压(HTN)[3]。然而,由于NASH 的发病机制尚未完全阐明,目前尚无公认的治疗NASH的药物。NAFLD整个疾病进程(单纯性脂肪肝-NASH-肝纤维化)中均可见肝小叶内中性粒细胞浸润这一重要的病理学特征[4-5]。中性粒细胞弹性蛋白酶(NE)是中性粒细胞分泌的最重要的活性蛋白酶之一,已被证明能改善饮食诱导的小鼠肥胖和胰岛素抵抗,NE-/- 肥胖小鼠脂肪组织中性粒细胞以及巨噬细胞的浸润较肥胖小鼠明显减少,相关炎症减轻[6-7]。本研究旨在探讨NE 在高脂饲料(HFHC)诱导的NASH 中的作用及机制。
1 材料与方法
1.1 实验动物及饲料 ApoE-/-小鼠购自北京维通利华实验动物技术有限公司,NE-/-小鼠购自Jackson 实验室。NE-/-ApoE-/-小鼠由ApoE-/-小鼠与NE-/-小鼠杂交F4 代以上获得。实验动物HFHC 均购自美国戴茨(Dyets,USA)公司,货号:100244,配方为:20%蛋白质(17kcal)、50%碳水化合物(43kcal)、21%脂肪(40kcal)和1.5%胆固醇(0kcal)。对照饲料为低脂饲料(LFD),货号LF10B,配方为:17%蛋白质(17kcal)、71%碳水化合物(73kcal)、4%脂肪(10kcal)和0%胆固醇(0kcal)。
1.2 动物选择与分组 将购买来的ApoE-/-小鼠和NE-/-小鼠进行繁殖,选取8 周龄雄性NE-/-ApoE-/-小鼠和ApoE-/-小鼠,HFHC 长期喂养建立NASH 模型:HFHC-ApoE-/-和HFHC-NE-/-ApoE-/-组(n=8)。以LFD 长期喂养小鼠视为对照组:LFD-ApoE-/-和LFD-NE-/-ApoE-/-组(n=8)。喂养16 周后空腹过夜称体重,常规处死采集血标本、称量肝重,肝左叶固定部位取材制备肝脏石蜡切片和冰冻切片,其余按叶分装于冻存管80℃保存留待其余实验所需。
1.3 血清学指标检测 采集隔夜禁食小鼠眼眶血,室温静置30min 后3000rpm 离心15min 取上清液。检测谷丙转氨酶(ALT)、谷草转氨酶(AST)、总胆固醇(TC)、甘油三酯(TG)。
1.4 基因鉴定 采用碱裂解法提取小鼠尾部组织DNA。具体步骤如下:在50mm NaOH 100µl 95 ℃下对小鼠尾部组织进行1h 裂解,随后加入100µl pH8.0Tris HCL,12000r/min 4℃离心10min 取离心上清液和2*Taq PCR mastermix 构建小鼠DNA PCR 反应体系,在以下条件下对小鼠DNA 进行PCR 扩增:95℃5min 循环1 次;95℃ 30s 循环1 次;58℃ 30s 循环1 次;72 ℃ 45s 循 环35 次;72 ℃ 5min 循 环1 次,保温10℃。以蒸馏水稀释10 倍而成的0.5×TBE 缓冲液为流动缓冲液,在GeneGreen 核酸染料染色后的2%琼脂糖凝胶上电泳(200V30min)分离PCR 产物,紫外光下观察。相关鉴定引物序列详见表1。

表1 基因鉴定引物序列
1.5 肝脏组织病理 肝脏组织经通用型组织固定液固定48h 后流水冲洗30min,梯度酒精脱水(75%酒精1h,95%酒精1h×2 次,100%酒精30min×2 次),二甲苯透明(二甲苯酒精20min,二甲苯15min×2 次),65℃石蜡浸泡2h,石蜡包埋后常温保存。切片后将石蜡切片放入65℃烤箱0.5h,之后依次放入二甲苯溶液中10min,100% 乙 醇10min,95% 乙 醇10min,75%乙醇10min,蒸馏水5min),加入足量苏木素染色液5~10min,流水冲洗60s,滴入1%盐酸乙醇3s 后快速水洗10s,伊红染色液染色2min,水洗10s。脱水透明(依次放入75%乙醇5min,95%乙醇5min,100%乙醇10min×2 次,二甲苯溶液5min×2 次),中性树胶封片。由专业病理科医生参照美国国立卫生研究院NASH 临床研究网络病理工作组评分系统进行NAFLD 活动度评分(NAFLD activity score,NAS)[8]。油红O 染色:采用新鲜现配油红O 染色液(6 ∶4 配置)对组织切片进行染色。取10µm 厚度新鲜肝脏冰冻切片,10%多聚甲醛固定40min,PBS 清洗10min×3 次,再经60%异丙醇漂洗30s。油红O 染色液染色15~20min,再经60%异丙醇漂洗10s×3 次,蒸馏水清洗10s,苏木素复染核5min,流水冲洗10s,甘油明胶封片,光镜下观察拍照。
1.6 荧光定量RT-PCR 取肝脏组织约30mg,采用TRIZOL/氯仿抽提法提取总RNA。取2µg RNA 按照罗氏逆转录试剂盒cDNA 第一链合成系统逆转录合成cDNA,以20µl 反应体系加入2µl cDNA 模板,2µl引物,6µl 水,10µl SYBR Green mix 进行PCR 扩增,反应条件为:95℃ 10min,95℃15s,60℃1min40 个循环,GAPDH 作为内参,以2-ΔΔCT计算mRNA 表达相对水平。相关引物序列详见表2。
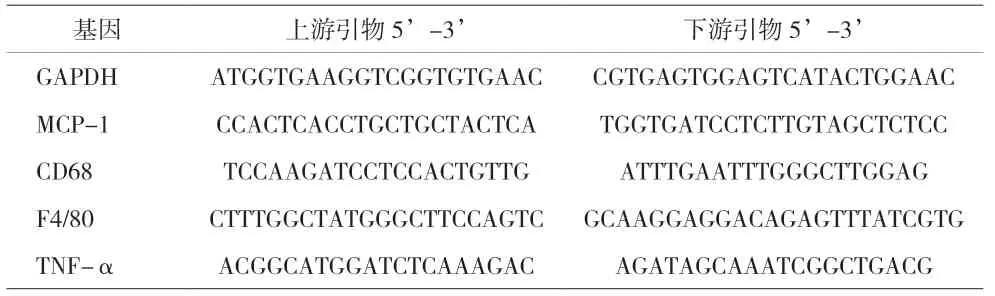
表2 RT- PCR引物序列
1.7 免疫组织化学染色 石蜡切片后,脱蜡与水化依次进行二甲苯10min×3 次,100%酒精10min×2 次,90%、80%及70%酒精各10min,流水水洗10min,PBS 缓冲溶液冲洗5min×3 次,再对组织进行柠檬酸盐-高压(120℃)修复组织抗原10min。用3% H2O2阻断内源性过氧化物酶30min,PBS 与蒸馏水充分洗涤各10min×3次,10% BSA封闭1h,一抗4℃孵育过夜,滴加一抗反应增强液后二抗孵育1h,最终行DAB 显色,显微镜下观察并计数阳性灶,苏木素复染核10min,流水返蓝10min,镜下拍照。
1.8 统计学方法 采用SPSS 17.0 统计软件。计量资料以(±s)表示。组间比较采用单因素方差分析,以双侧P<0.05 为差异有统计学意义。
2 结果
2.1 小鼠基因分型结果 NE-/-ApoE-/- 小鼠由ApoE-/-小鼠与NE-/-小鼠杂交F4 代以上获得。图1为杂交后代所有基因分型结果,不断繁殖直至拥有足够实验所需NE-/-ApoE-/-小鼠数量。

图1 小鼠基因分型结果
2.2 体重、肝指数及血清学指标 ApoE-/-小鼠经HFHC 饮食诱导16 周后,体重、肝指数、AST、ALT、TC 和TG 水 平 明 显 高 于LFD-ApoE-/- 小 鼠(P 均<0.05)。NE 基因敲除则能够明显降低小鼠体重及上述指标(P 均<0.05)。各组小鼠体质量及各项血清生物化学指标见表3。
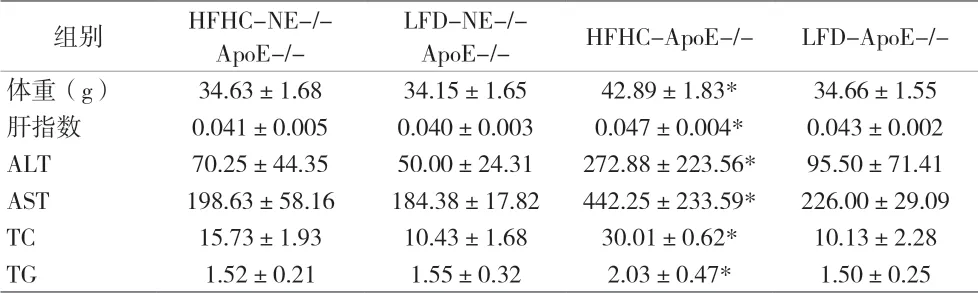
表3 各组小鼠体质量及各项血清生物化学指标
2.3 肝脏病理 HE 染色结果显示HFHC-ApoE-/-小鼠有严重的脂肪变性和多发性炎症灶,较HFHCNE-/-ApoE-/-小鼠脂肪变性及炎症反应则明显减轻(P<0.05)。油红O 染色也显示HFHC-NE-/-ApoE-/-小鼠肝脂肪变性的严重程度比HFHC-NE-/-ApoE-/-小 鼠 轻(P<0.05)。 在 定 量 分 析 中,HFHC-NE-/-ApoE-/-小鼠病理评分:脂肪变性、小叶炎症、NAS均低于HFHC-ApoE-/-小鼠(P<0.05)(见图2、3,表4)。

图2 各组小鼠肝脏切片HE染色结果(×20)

图3 各组小鼠肝脏切片油红O染色结果(×20)

表4 各组小鼠NAS积分
2.4 肝脏内炎症因子表达水平 在肝脏炎症方面,通过IHC 染色(见图4、5),发现HFHC-ApoE-/-小鼠肝脏中促炎性KC 标记物CD68 和F480 的表达明显高于其余三组(P<0.05)。LFD 饮食小鼠kupffer 细胞无明显活化,而在HFHC 饮食小鼠中HFHC-ApoE-/-小鼠kupffer 细胞明显活化,相对的HFHC-NE-/-ApoE-/-小鼠kupffer 细胞则活化水平明显降低(P<0.05)。荧光定量RT-PCR 结果显示,与LFD-ApoE-/-小鼠比较,HFHC-ApoE-/-小鼠肝脏炎性细胞因子mRNA:CD68(P<0.05)、F4/80(P<0.05)、TNF-α(P<0.05)和MCP-1(P<0.05)的表达升高(P<0.05),而NE 基因敲除下调了HFHC-ApoE-/-小鼠这些炎症细胞因子mRNA 的表达(见图6)。

图4 各组小鼠CD68免疫组织化学结果(×40)

图5 各组小鼠F4/80免疫组织化学结果(×40)

图6 各组小鼠CD68,F4/80,MCP-1和TNF-α mRNA表达水平
3 讨论
ApoE-/-小鼠之前被广泛应用于动脉粥样硬化模型的建立。近些年有研究发现西方饮食(WD)的ApoE-/-小鼠表现出异常的葡萄糖耐量、肝肿大、体重增加和NASH 的全谱,包括肝脂肪变性、纤维化和炎症,但是无肾脏损害的迹象。WD 喂养的ApoE-/-小鼠代表了一种新颖、快速的模型,具有NASH 和MS(代谢综合征)的所有特征,非常适合NASH 研究[9]。
NE 由中性粒细胞分泌,在生理条件下,NE 能够协助清除病原体,促进吞噬细胞消除有害病菌,有助于组织的愈合和再生,但NE 的过量表达则会对机体组织基质造成危害,表现为破坏血管壁成分,进一步趋化中性粒细胞及释放IL-8、TNF-α 等炎症因子导致炎症加重,NE 的促炎作用已在多种疾病模型中得到证实[10]。最新研究结果表明,中性粒细胞分泌NE 可能是介导系统性低度慢性炎症和胰岛素抵抗的主要机制,NE 处理肝细胞会引起细胞胰岛素抵抗,NE-/-的肥胖小鼠脂肪组织中性粒细胞以及巨噬细胞的浸润较肥胖小鼠明显减少,同时糖耐量水平和胰岛素敏感性明显改善[7]。
本研究利用NE 与ApoE 基因敲除小鼠,采用可以显示人类NASH 大部分特征的HFHC 饮食ApoE -/-小鼠模型。造模16 周时,小鼠大体及生化学指标均出现了NASH 的特征性变化,肝脏染色显示脂肪变性和炎症细胞浸润,荧光定量RT-PCR 及免疫组化显示相关炎症因子的表达增高。NE 基因敲除对HFHC 诱导的ApoE-/-小鼠肥胖、脂肪变性和肝脏炎症均具有保护作用。
库普弗细胞(KC)募集和活化在NAFLD 炎症的发生和发展中起着重要的作用,激活的KC 可分泌炎症因子如TNF-α、白细胞介素1、白细胞介素10 等,募集炎症细胞并放大肝脏炎症参与机体慢性炎症状态的形成[11-12]。本研究以CD68 和F4/80 作为KC 细胞活化标志,发现NE 基因敲除能明显减少KC 细胞的活化,表明NE 促进KC 细胞活化是其影响NASH 炎症反应的重要机制。
综上所述,本研究表明NE 基因敲除能改善HFHC 诱导的ApoE -/-小鼠NASH,其作用机制可能是敲除NE 基因,消除NE 介导炎症、胰岛素抵抗和激活KC 细胞的作用,从而起到改善NASH 的作用。
