北极狐MITF-M基因启动子活性及转录调控元件的分析
2020-11-06李寒妹王瑞宁郑晓宁刘铮铸彭永东巩元芳李祥龙
郭 敏,李寒妹,王瑞宁,郑晓宁,刘铮铸,彭永东,巩元芳*,李祥龙*
(1.河北科技师范学院 动物科技学院 河北省特色动物种质资源挖掘与创新重点实验室,河北 秦皇岛 066004;2.河北农业大学 动物科技学院,河北 保定 071000)
狐皮,因其色泽艳丽、绒毛稠密丰厚、御寒力强,极具经济价值。毛色是影响狐皮经济价值的一个重要因素,其形成是一个复杂的生理生化过程,与黑色素的合成和分布有关。黑色素的生成受多种基因调控,MITF-M是调控动物毛色形成信号下游通路中的一个重要功能基因,可调控多种其他黑色素基因的转录(如:AIM、MART1/MLANA、SILV/PMEL17、TRPM1和TYR家族等)[1],引起动物毛色的多样化。
MITF具有一个bHLHZip(螺旋-环-螺旋-亮氨酸拉链)结构,可识别靶基因启动子区E-box和M-box,进而启动下游基因的转录[2]。该基因至少存在9种不同启动子结构,调控编码多种蛋白质异构体[3],其中MITF-M基因在黑素细胞和黑素瘤细胞中特异表达[4]。杨玉静等[5]研究发现,绵羊MITF-M过表达会使黑素细胞TYR和TYRP-1的表达量增加,揭示黑素细胞中TYR和TYRP-1的表达可能受MITF-M基因的调控。郑嫩珠等[6]发现MITF-M和TYR mRNA在各组织间的表达量与黑色素含量呈显著正相关。此外,张建一等[7]研究发现,牦牛MITF-M基因mRNA在心脏、肾脏和皮肤等众多组织中,仅在皮肤中特异性表达,且在黑色被毛皮肤中的表达量显著高于白色被毛皮肤(P<0.01)。以上研究提示MITF-M基因与动物被毛颜色关系密切。
众所周知,启动子是基因表达的指挥棒[8],启动子的顺式作用元件和反式作用因子对基因的转录调控起重要作用。目前,MITF-M基因作为调控狐狸毛色形成的相关研究鲜见报道,因此,研究北极狐MITF-M基因启动子活性及其相关转录调控元件,可为进一步深入探究该基因调控狐狸毛色的遗传机制提供理论依据。
1 材料与方法
1.1 材料与试剂北极狐组织样品来自河北省秦皇岛市昌黎县金岛育种场;LA Taq DNA Polymerase、pMD19-T Vector、DH5α感受态细胞、反转录试剂盒、T4DNA连接酶均购自TaKaRa公司;2×TransStart FastPfu PCR SuperMix、TransStart Taq DNA Polymerase购自北京全式金公司;DNA胶回收试剂盒、质粒DNA小量提取抽提试剂盒、无内毒素质粒DNA大量提取试剂盒购自天根生化科技(北京)有限公司;双荧光素酶报告基因检测试剂盒购自Promega公司;DPBSD、MEM培养基(高糖型)购自Hyclone公司;限制性内切酶Kpn Ⅰ和Mlu Ⅰ、0.25%胰蛋白酶、Opti-MEM培养基Lipofectamine®2000Transfection Reagent(Lip2000脂质体)、胎牛血清购自Thermo Fisher Science公司;质粒载体pGL3-Basic、pRL-TK、人肾上皮细胞系(293T)、人恶性黑色素瘤细胞系(A375)均由本实验室保存。
1.2 北极狐MITF-M基因核心启动子区的确定
1.2.1启动子的克隆及序列分析 参照文献[9]所得北极狐MITF-M基因核苷酸序列以及该基因启动子区和调控元件的预测结果,在编码区上游设计扩增6个缺失片段的引物(表1,图1)。通过NEB cutter®(http://nc2.neb.com/NEBcutter2/)在线分析限制性内切酶位点,片段2 279 F、1 738 F、1 313 F、1 040 F、524 F和236 F上游引物引入酶切位点KpnⅠ(GGTACC)及保护碱基GG,下游引物引入酶切位点MluⅠ(ACGCGT)及保护碱基CC。

图1 北极狐MITF-M基因启动子缺失片段示意图
PCR扩增体系为50 μL:基因组DNA 1 μL,10×PCR Buffer(Mg2+Plus)5 μL,dNTP Mix(2.5 mmol/L)8 μL,上、下游引物(20 μmol/L)各1 μL,LA Taq DNA聚合酶(5 U/ μL)0.5 μL,灭菌ddH2O 33.5 μL。
PCR反应条件:94℃预变性5 min;94℃变性45 s,退火30 s,72℃延伸2 min,共35个循环(退火温度和延伸时间见表1);72℃延伸10 min。PCR产物进行1.5% 琼脂糖凝胶电泳检测。

表1 MITF-M基因启动子区缺失片段和转录因子结合位点引物
1.2.2缺失片段载体构建及鉴定 将缺失片段X 的PCR产物克隆至载体pMD19-T中,再将重组载体(pMD19-X)转化至DH5α感受态细胞,鉴定为阳性的菌液PCR样品送至生工生物工程(上海)股份有限公司测序。对重组克隆载体pMD19-X及pGL3-Baisc载体同时进行双酶切,将回收产物进行连接构建pGL3-Baisc-X重组表达载体并转化至DH5α感受态细胞,通过菌液PCR、测序和双酶切3种方法依次鉴定重组载体,对阳性重组载体进行无内毒素质粒的提取。
1.2.3突变载体的构建及鉴定 以pGL3-Basic-524质粒为模板,分别以引物524F和Mut-CREB-1-Rm、Mut-CREB-1-Fm和R、524F和Mut-Sp1-2-Rm、Mut-Sp1-2-Fm和R、524F和Mut-Sp1-3-Rm、Mut-Sp1-3-Fm和R(表1)通过重叠延伸PCR技术扩增上、下游引物。重叠延伸PCR扩增体系为40 μL:野生型质粒模板2 μL,2×TransStart FastPfu Super Mix 20 μL,上、下游引物(20 μmol/L)各1 μL,灭菌ddH2O 16 μL。将扩增产物切胶回收并等比例混合,用此混合物为模板,以引物524F和R扩增突变载体全长片段。PCR扩增体系为50 μL:混合物模板2.5 μL,10×TransStart Taq Buffer 5 μL,TransStart Taq DNA Polymerase 0.5 μL,dNTP Mix(10 mmol/L)1 μL,上、下游引物(20 μmol/L)各1 μL,灭菌ddH2O 39 μL。重叠延伸和全长片段PCR反应条件:94℃预变性5 min;94℃变性 30 s,退火30 s,72℃延伸共35个循环(退火温度和延伸时间见表1);72℃最终延伸10 min,4℃保存。通过菌液PCR和测序鉴定突变载体,并提取无内毒素质粒。
1.2.4细胞的培养和转染 用含有10%胎牛血清的DMEM培养基在37 ℃、5% CO2细胞培养箱中培养293T和A375细胞。转染前将细胞接种于24孔板内,待细胞贴壁生长覆盖率至70%~80%时,分别将重组报告基因质粒pGL3-Baisc-X(293T:0.95 μg;A375:0.9 μg)、内参质粒pRL-TK(293T:0.05 μg;A375:0.1 μg)和lip2000脂质体2.0 μL加入至50 μL Opti-MEM培养基中得到质粒-脂质体混合物,然后转染到细胞,培养48 h后收集细胞。生物学重复至少3次,每次3个技术重复。
1.2.5双荧光素酶活性鉴定 根据双荧光素酶检测试剂盒说明书进行启动子活性检测,用DPBS洗细胞2次,每孔加入150 μL细胞裂解液,振荡30 min 至细胞完全裂解,向1.5 mL EP管中添加10 μL 裂解好的细胞待测样品和20 μL LAR Ⅱ试剂,通过发光仪检测pGL3质粒中萤火虫荧光素酶活性,检测10 s时的化学发光值,读值为F,随后加入20 μL Stop&Glo试剂,混匀后检测pRL-TK质粒中海肾荧光素酶活性,同样检测10 s时的化学发光值,读值为R。启动子相对活性值=F/R,即萤火虫荧光素酶活性/海肾荧光素酶活性。
1.2.6统计分析 所有样品在转染293T和A375细胞株时进行至少3次生物学试验重复,将试验所得活性值数据标准化并利用SPSS 20.0软件进行统计学分析,不同检测片段的启动子活性数据用单因素ANOVA进行分析(LSD和Duncan法),P<0.05 表示差异显著,具有统计学意义。
1.3 核心启动子区转录因子结合位点的预测分析通过在线软件WWW Signal SCAN、Cluster、Nsite、JASPAR和AliBaba 2.1等预测北极狐MITF-M基因核心启动子区的转录因子结合位点,详细情况见表2。

表2 转录因子结合位点预测软件
1.4 核心启动子区转录因子结合位点突变体活性分析将转录因子结合位点突变载体转染至A375和293T细胞,用双荧光素酶报告系统检测结果与野生型对比分析转录因子结合位点突变前后启动子活性的变化。
2 结果
2.1 北极狐MITF-M基因启动子缺失片段的扩增以北极狐基因组DNA为模板,利用所设计引物对MITF-M基因启动子区进行缺失片段的扩增,扩增产物进行1.5%琼脂糖凝胶电泳检测后,与预期片段大小(2 279,1 738,1 313,1 040,524和236 bp)基本一致(图2)。随后将扩增所得各缺失片段连接到pMD19-T载体上。

图2 北极狐MITF-M基因启动子区缺失片段PCR扩增结果 M1.DL2000 DNA Marker;M2.DL5000 DNA Marker;1~6.引物为2279F、1738F、1313F、1040F、524F和236F的扩增产物
2.2 北极狐MITF-M基因启动子荧光素酶表达载体的构建使用T4DNA连接酶对双酶切后回收的片段X和双酶切后pGL3-Basic质粒进行连接(pGL3-basic-X),将构建的MITF-M基因启动子荧光素酶表达载体进行菌液PCR(图3)、双酶切鉴定(图4)和测序,对其依次进行鉴定,结果与预期基本一致,表明北极狐MITF-M基因重组表达载体pGL3-basic-X构建成功。

图3 北极狐MITF-M基因重组表达载体pGL3-basic-X菌液PCR扩增结果 M1.DL2000 DNA Marker;M2.DL5000 DNA Marker;1~6.引物为2279F、1738F、1313F、1040F、524F和236F重组表达载体pGL3-basic-X菌液PCR的扩增产物
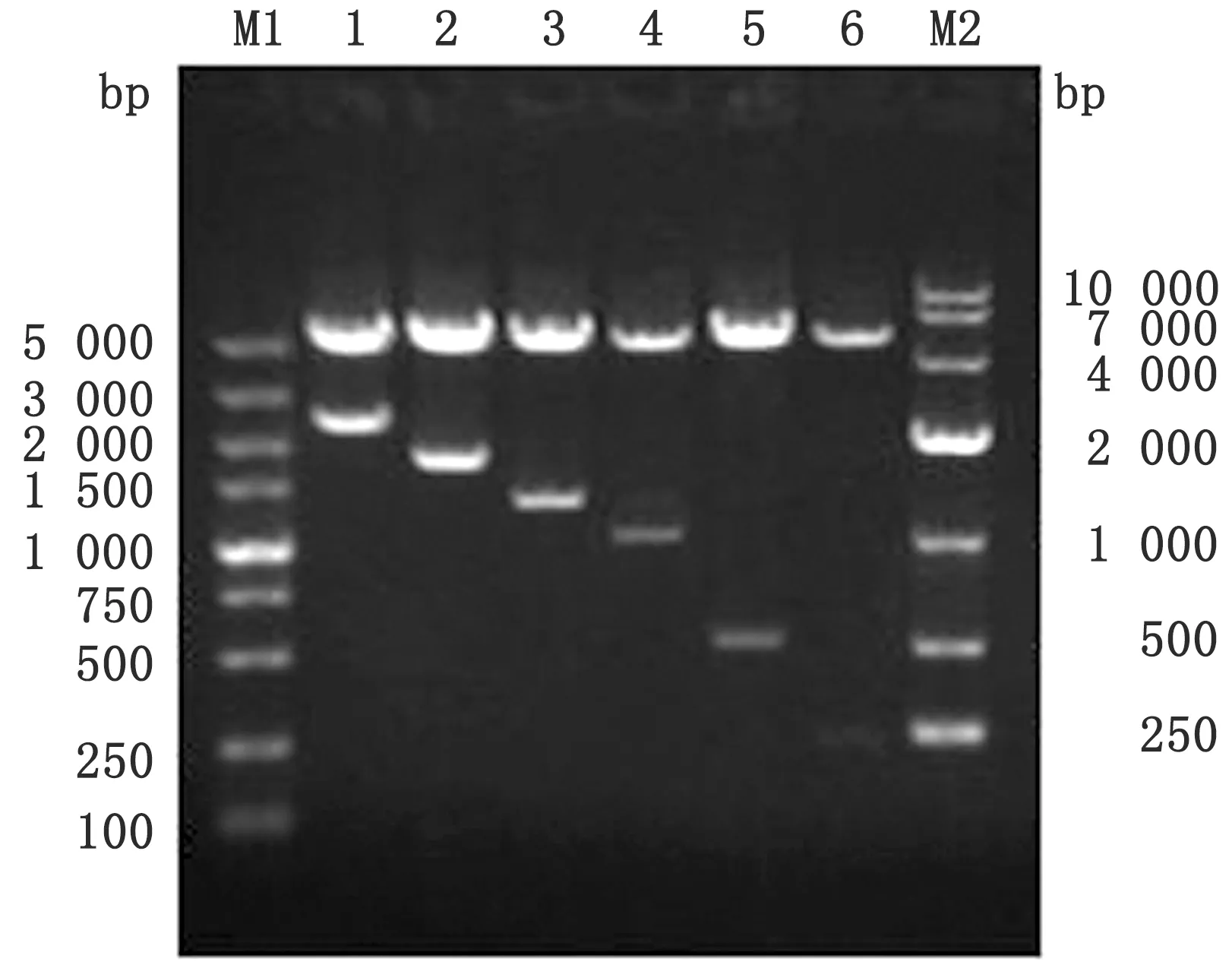
图4 北极狐MITF-M基因重组表达载体pGL3-basic-X双酶切鉴定结果 M1.DL5000 DNA Marker;M2.DL10000 DNA Marker;1~6.分别为重组表达载体pGL3-basic-X双酶切鉴定产物
2.3 北极狐MITF-M基因5′端调控序列的活性分析利用启动子双荧光素酶报告基因表达载体(pGL3-Basic-X)无内毒素质粒转染细胞(A375和293T),测定MITF-M基因双荧光素酶活性(图5)。结果显示,6个启动子报告基因无内毒素质粒转染2种细胞的活性值高低趋势一致,A375细胞活性值均低于293T细胞;293T细胞转染结果显示6个启动子报告基因的活性与pGL3-basic对照组比较均差异极显著(P<0.01);A375细胞转染结果表明除片段1 040 bp(-1 026 bp/+13 bp)和236 bp(-222 bp/+13 bp)启动子活性与pGL3-basic对照组比较无显著性差异外(P>0.05),2 279 bp(-2 265 bp/+13 bp),1 738 bp(-1 724 bp/+13 bp),1 313 bp(-1 299 bp/+13 bp)和524 bp(-510 bp/+13 bp)4个报告基因活性值与pGL3-basic对照组相比均呈极显著性差异(P<0.01)。纵观全图发现片段524 bp(-510 bp/+13 bp)区域在2种细胞间的活性值均最高,且与其他5个片段活性相比,均呈极显著性差异(P<0.01),提示此处MITF-M基因的启动表达作用最强。当启动子片段缩短至236 bp(-222 bp/+13 bp)时,荧光素酶相对活性值明显下降,推测-510 bp/-222 bp可能是北极狐MITF-M基因的核心启动子区。
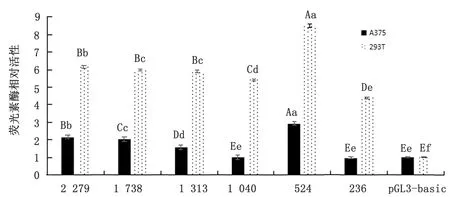
图5 北极狐MITF-M基因启动子表达载体转染细胞的相对荧光素酶活性值 注:大小写字母分别表示在P=0.01和P=0.05 水平的显著性
2.4 北极狐MITF-M基因核心启动子区转录因子结合位点的生物信息学分析通过在线软件WWW Signal SCAN、Cluster等数据库对MITF-M基因核心启动子区(-510 bp/-222 bp)的转录因子结合位点进行了预测(表3),为避免出现假阳性,取至少3个软件的预测结果。由表3可知,该区域可能存在CREB(-312 bp/-319 bp),Sp1(-295 bp/-307 bp)和Sp1(-249 bp/-262 bp)3个转录因子结合位点。

表3 转录因子结合位点预测结果
2.5 北极狐MITF-M基因核心启动子区转录因子结合位点突变体活性分析图6是以pGL3-524为模板预测得到的3个转录因子结合位点CREB(-312 bp/-319 bp),Sp1(-295 bp/-307 bp)和Sp1(-249 bp/-262 bp)点突变图,以此构建了突变体(图7),突变前后序列情况见表4,分别转染至A375和293T细胞,双荧光素酶报告系统检测结果(图8)表明,-312 bp/-319 bp,-295 bp/-307 bp和-249 bp/-262 bp位置CREB、Sp1和Sp1转录结合位点的活性与野生型524 bp(-510 bp/+13 bp)均呈极显著性差异(P<0.01),表明以上3个区域的突变使北极狐MITF-M基因的启动子活性上升。

表4 MITF-M基因转录因子结合位点突变前后的序列情况

图6 北极狐MITF-M基因启动子区转录因子结合位点突变图 注:■表示转录因子结合位点;表示突变

图7 北极狐MITF-M基因启动子突变体的克隆 M.DL2000 DNA Marker;1,2.mut-CREB-1上、下游片段;3,4.mut-Sp1-2上、下游片段;5,6.mut-Sp1-3上、下游片段;7~9.mut-Sp1-1、mut-Sp1-2和mut-Sp1-3全长片段
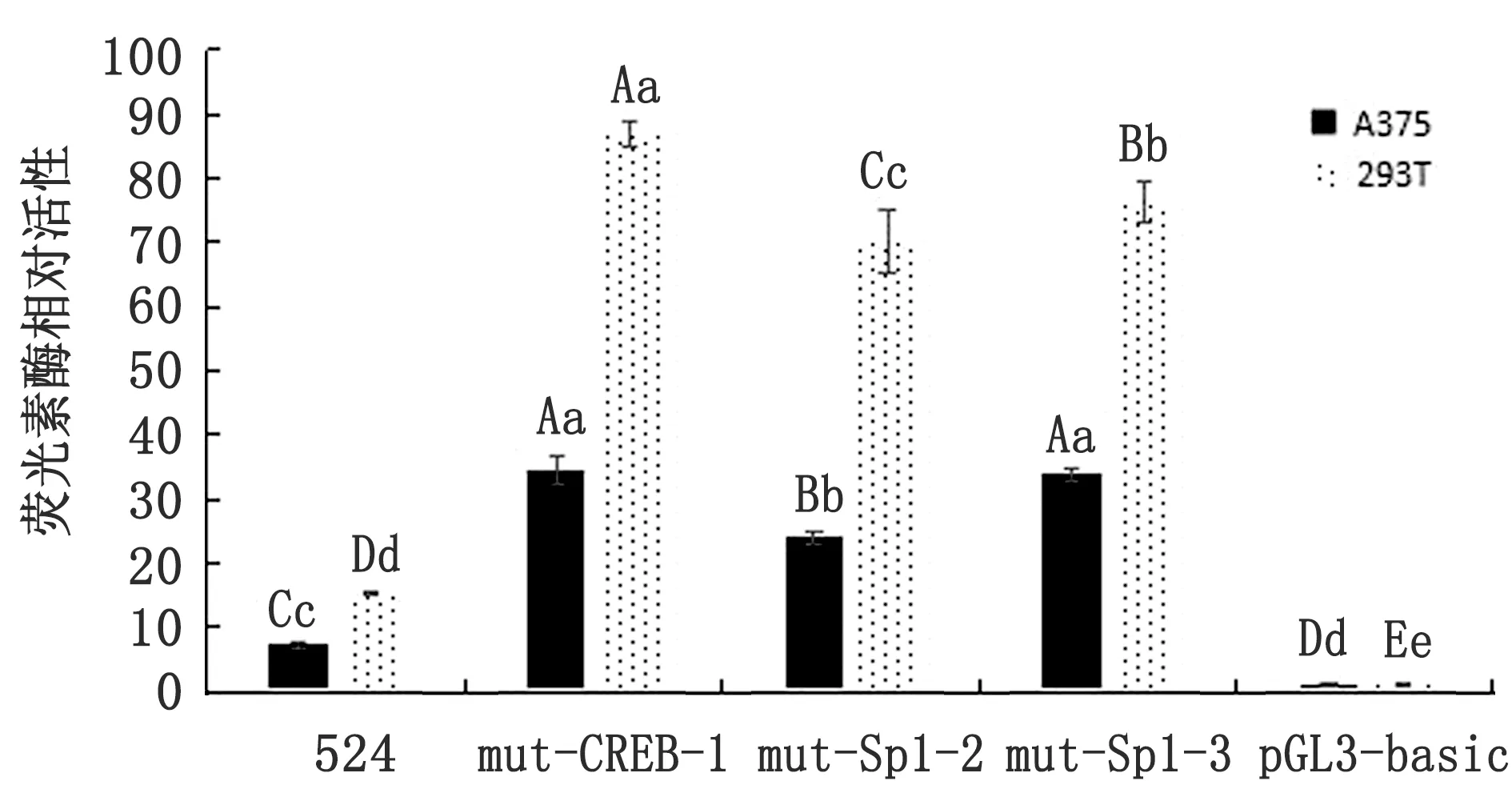
图8 北极狐MITF-M基因突变启动子表达载体转染细胞的相对荧光素酶活性值 注:大小写字母分别表示在P=0.01和P=0.05水平的显著性
3 讨论
MITF-M基因对于动物的毛色形成是必不可少的[10],狐皮的毛色作为重要的质量性状直接影响其品质及价格[11]。因此,MITF-M基因启动子及其转录调控机制的研究对于揭示北极狐被毛颜色的分子遗传机制具有十分重要的意义。启动子的克隆方式大致分为基因组文库筛选法、利用启动子探针载体筛选启动子和基于PCR技术克隆启动子法等,这些技术都已得到广泛的应用[12]。相关研究显示,克隆片段若仅含有TSS上游区域易出现假阴性结果,但选择包含TSS、ATG及部分CDS区可提高阳性率[13]。
本试验利用PCR和荧光素酶报告基因技术等确定了北极狐MITF-M基因的核心启动子区在-510 bp/-222 bp区间,结果与POINDEXTER等[14]的研究结果基本一致。
真核动物功能基因启动子中多种顺式作用元件如CAAT框(GGCTCAATCT)、TATA框(TAT-AATAAT)和GC框(GTGGGCGGGGCAAT)等参与基因的转录。GC框主要分布在转录起始位点前-128 bp/-23 bp区域内,一般位于CAAT框的两侧和TATA框上游,能够结合调节特异性蛋白Sp1[15],Sp1已被证实是一种能影响转录起始的反式激活子[16]。郭敏等[9]发现北极狐MITF-M基因启动子区-302 bp处存在GC框,本试验进一步确认该区域-295 bp/-307 bp和-249 bp/-262 bp位置各存在1个Sp1转录因子结合位点,提示GC框(-302 bp)可能与Sp1(-295 bp/-307 bp)蛋白结合调控北极狐MITF-M基因的转录。通过对这2个Sp1转录因子结合位点进行突变处理,发现北极狐MITF-M基因启动子的活性显著性上升,推测Sp1对北极狐MITF-M基因的转录激活起一定调控作用。柳云霞等[17]研究发现,Sp1抑制小鼠MEPE基因的转录活性,且抑制MEPE基因的表达水平。而田宏攀[18]在研究乳腺癌中DNA甲基化对SP1调控FOXF2转录时,发现SP1可以增强FOXF2启动子的转录活性,SP1转录可促进FOXF2启动子低甲基化的乳腺癌细胞中FOXF2的表达,但DNA甲基化后SP1可抑制FOXF2启动子的转录活性。综合柳云霞等[17]和田宏攀[18]的研究结果,推测本试验的2个Sp1转录因子结合位点可能对北极狐MITF-M基因的转录激活起负调控作用;也可能是2个Sp1转录因子结合位点对北极狐MITF-M基因的转录激活起正调控作用,只是由于DNA发生甲基化,抑制了其转录激活MITF-M启动子的活性,但当甲基化的Sp1被点突变后,抑制作用被破坏,使得其对北极狐MITF-M基因转录激活的正调控作用发挥出来,启动子活性上升。
有研究指出,转录因子结合位点CREB和CRE结合能提高下游基因的转录活性,部分基因转录水平可提高20倍,但若CRE缺失则会导致转录活性下降[19-20]。本试验在北极狐MITF-M基因的核心启动子区域内(-312 bp/-319 bp)筛查到CREB,前期研究在-317 bp和-310 bp处分别筛查到CRE[9],提示CREB(-312 bp/-319 bp)可能与CREs(-317 bp,-310 bp)结合调控北极狐MITF-M基因的转录。对转录因子结合位点CREB(-312 bp/-319 bp)点突变处理后,北极狐MITF-M基因启动子的活性显著性上升。肖慧[21]研究发现,CREB可通过结合在TNFAIP1基因近端启动子上的CREs位点负调控TNFAIP1基因的表达,CREs元件缺失突变后对TNFAIP1基因启动子活性的抑制作用减弱。汤必奎[22]研究发现IL-6基因启动子区域DNA甲基化程度影响CREB和IL-6的结合,DNA甲基化水平低时,二者结合能力增强,CREB和基因活性相关;DNA甲基化水平高时,二者结合能力减弱,CREB和基因沉默相关。综上,推测本试验的CREB可能和CREs结合对北极狐MITF-M基因的转录激活起负调控作用。但也可能是CREB和CREs结合对北极狐MITF-M基因的转录激活起正调控作用。当北极狐MITF-M基因启动子区域DNA甲基化时抑制了CREB转录激活MITF-M启动子的活性,但当甲基化的CREB被点突变后,破坏了这种抑制作用,增强了CREB和MITF-M的结合,MITF-M启动子活性显著上升。为了确证CREB(-312 bp/-319 bp)、Sp1(-295 bp/-307 bp)和Sp1(-249 bp/-262 bp)对北极狐MITF-M基因转录调控的具体功能,后期需对以上3个转录因子结合位点进行DNA甲基化检验,进而用CHIP和EMSA等手段进一步分析验证。
本试验成功构建了北极狐MITF-M基因启动子区不同长度缺失片段荧光素酶表达载体,确定了-510 bp/-222 bp区是北极狐MITF-M基因的核心启动子区,该区域存在CREB(-312 bp/-319 bp)、Sp1(-295 bp/-307 bp)和Sp1(-249 bp/-262 bp)3个转录因子结合位点,它们被点突变后,能使北极狐MITF-M基因的启动子活性上升,说明这3个转录因子结合位点对北极狐MITF-M基因的转录激活起到一定的调控作用。
