盐酸多西环素壳聚糖微球的制备与评价
2020-11-06王洪利郝良玉李乾学韩德明
王洪利,孙 钰,郝良玉,3,邵 琳,3,王 玥,3,易 乐,曲 晗,王 凯,李乾学*,韩德明*
(1.长春理工大学 生命科学技术学院,吉林 长春 130022;2.军事医学科学院 军事兽医研究所,吉林 长春 130122;3.吉林农业大学,吉林 长春 130000)
盐酸多西环素(doxycycline hydrochloride,DH)又称去氧土霉素、强力霉素、盐酸多西霉素等,是第2代半合成四环素类衍生物,具有十二氧化并四苯的线性结构[1-2];具有广谱抗菌、抗原虫作用[3],主要用于防治畜禽的急慢性呼吸道病,衣原体感染、支原体感染、布鲁菌病、立克次体病、霍乱及其他多种细菌性疾病[4];抗菌活性是四环素的10倍左右,比四环素更强效、更长效[5],是四环素类中最稳定的一种[6],目前已经在我国及世界多个国家上市[7]。
目前临床应用的制剂种类繁多,如片剂、注射剂、分散剂、软膏剂和喷雾剂等,而缓释微球制剂凭借增强药物稳定性,释放缓慢,减少胃肠道代谢及保护药物不被胃酸破坏,增强患者依从性等优势成为研究热点。而在缓释微球的制备过程中,壳聚糖由于储量丰富、价格低廉、亲水性好、生物相容性强以及无毒性等优点,被广泛应用于生物医药材料领域[8-10]。
壳聚糖缓释微球的制备方法多样,如喷雾干燥法[11-12]、离子交联法[13-14]、乳化交联法[15-16]和复凝聚法[17-18]等。喷雾干燥法操作简单,通过该方法制备出来的微球细胞毒性小,且该方法易于工业化生产,但是该方法需要特殊的仪器设备,且试剂浓度、黏度、温度以及气体压力等因素对微球影响较大,同时对被包合材料的热稳定性要求较高。离子交联法是指大分子在离子交联剂作用下,通过静电作用发生的可逆的物理交联,该方法具有操作简单、条件温和,避免了使用交联剂产生的毒性,但因容易黏连而导致微球粒径较大或形状不规整,且交联方式为可逆的物理交联从而导致微球热稳定性差和机械强度较差[19-20]。复凝聚法操作简单方便,制备过程中无需添加其他试剂,但包封率较低且缓释效果较差。而本试验采用乳化交联的方法制备DH壳聚糖微球,该方法是一种传统的微球制备方法,通过该方法得到的微球表面光滑、粒径整齐、载药量和包封率较高,且亲水性和亲油性的试剂均可进行包合试验,适用范围较广。
1 材料与方法
1.1 材料与试剂DH:纯度98%,上海源叶生物科技有限公司;壳聚糖:脱乙酰度大于90%,北京Blotopped公司;液体石蜡:化学纯,天津市华东试剂厂;Span-80:化学纯,天津市光复精细化工研究所;三聚磷酸钠:纯度99%,湖北广奥生物科技有限公司;冰醋酸:分析纯,北京化工厂;溴化钾:分析纯,北京化工厂。
1.2 DH微球的制备采用乳化交联法制备DH-壳聚糖微球。取5 mL壳聚糖醋酸溶液,加入0.3 g DH,于涡旋器上混匀,通过恒流泵滴加至装有12 mL 液体石蜡和Span-80溶液的烧杯中,在磁力搅拌器上混匀,1 000 r/min,搅拌1 h;加入三聚磷酸钠溶液交联1 h,再加入戊二醛溶液搅拌固化1 h;4 000 r/min离心3 min,弃上清,分别用石油醚、异丙醇和超纯水清洗3次,冻干,即得淡黄色微球产物。
1.3 吸收波长的选择称取一定质量的DH和壳聚糖,使其分别溶于0.1 mol/L的盐酸缓冲液中,以空白盐酸缓冲液作对照,在200~450 nm范围内扫描。DH最高紫外吸收峰出现在272 nm处,而在此位置壳聚糖未出现紫外吸收峰,所以,壳聚糖对DH在272 nm处的测定无影响。
1.4 标准曲线的绘制见图1。精密称取DH 10 mg,加入0.1 mol/L盐酸缓冲液100 mL,待完全溶解后分别稀释成质量浓度为10,20,30,40,50,60 mg/L,测定D272 nm值,以质量浓度为横坐标,D值为纵坐标,得到回归方程y=0.038x+0.011(R2=0.999 8)。

图1 DH标准曲线
1.5 载药量和包封率的计算称取DH微球20 mg,置于研钵中充分研磨,取研磨后的微球10 mg 加入0.1 mol/L盐酸缓冲液10 mL,超声2 h,稀释10倍,测定D272 nm值。
载药量=微球中药物的质量/微球的质量×100%;
包封率=微球中药物的质量/理论药物质量×100%。
1.6 微球制备工艺的优化采用Design-expert 软件进行试验设计和优化。选取壳聚糖浓度、体系内DH的质量、转速和油相体积为考察因素,选取载药量和包封率为优化目标。采用Box-Behnken设计原理进行四因素三水平响应曲面分析试验,共计29组子试验(表1)。
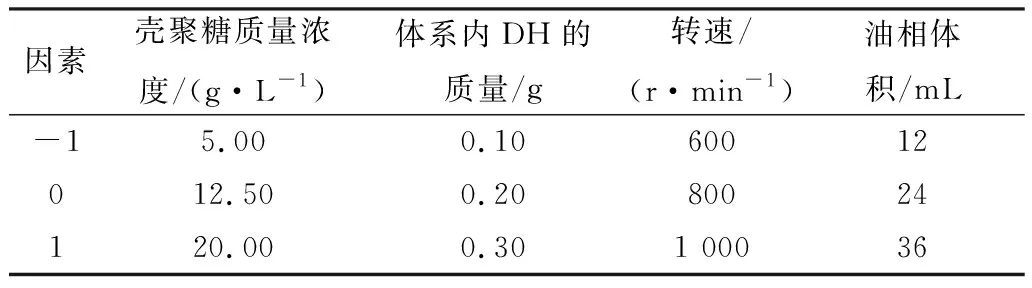
表1 Box-Behnken设计四因素三水平表
1.7 微球形态及表征
1.7.1壳聚糖微球的扫描电镜观察(SEM) 取真空冷冻干燥后的壳聚糖载药微球约5 mg,通过导电胶固定后观察微球的表面状况。
1.7.2壳聚糖微球的傅里叶红外光谱(FT-IR) 采用溴化钾作为测试背景。分别称取溴化钾、壳聚糖、DH、壳聚糖与DH的物理混合物(按质量比1∶1称量后,研钵充分研磨)及壳聚糖载药微球适量于培养皿中,60℃充分干燥,之后精密称取各个样品2 mg,分别加入溴化钾100 mg,研钵充分研磨后压片测量,400~4 000 cm-1扫描范围内扫描16次。
1.7.3壳聚糖微球的热重分析(TGA) 分别称取壳聚糖、DH、壳聚糖与DH的物理混合物以及壳聚糖微球各10 mg于坩埚中,以空坩埚作参照,静态空气气氛,以10℃/min升温,扫描30~800℃。
1.7.4壳聚糖微球的X射线衍射(XRD) 分别称取壳聚糖、DH、壳聚糖与DH的物理混合物、壳聚糖空球以及壳聚糖微球各10 mg进行XRD分析,扫描范围为0~90°。
1.7.5壳聚糖微球的拉曼光谱分析 分别称取壳聚糖、DH、壳聚糖与DH的物理混合物、壳聚糖空球以及壳聚糖微球各10 mg于载玻片上,采用785 nm 激光波长,积分时间为10 s,积分次数为2,扫描范围为100~3 300 cm-1,取400~1 900 cm-1绘图。
2 结果
2.1 制备工艺的优化结果根据上述试验设计,对29组子试验进行制备后,以载药量和包封率为优化指标对制备工艺进行优化。结果表明,此模型载药量和包封率的失拟相均为不显著,表明此模型与试验结果拟合较好,具有代表性。应用软件Design-expert优化结果,最佳制备方案:壳聚糖质量浓度20 g/L,体系内DH质量0.3 g,转速910 r/min,液体石蜡12 mL。
2.2 SEM结果分析从图2中可以看出微球外表呈球形,且表面光滑,无凹陷,但具有少许黏连现象。

图2 微球SEM图
2.3 FT-IR结果分析如图3所示,微球图谱中在1 722 cm-1和1 655 cm-1处有较弱的峰,证明存在较弱的Schiff碱反应。伯氨基与仲氨基的吸收峰分别出现在1 615 cm-1和1 581 cm-1处,发生蓝移[21],且在3 345 cm-1处的-OH峰已经变得平坦,在1 612 cm-1处出现P=O振动吸收峰,由此证明壳聚糖氨基与磷酸基团以静电作用结合[22]。微球图谱中还增加了DH的“指纹”图谱,证明壳聚糖已经通过物理作用将DH包裹在其内部。

图3 FT-IR检测结果 A.壳聚糖;B.DH;C.壳聚糖与DH的物理混合物;D.微球
2.4 TGA结果分析由图4可见,壳聚糖通过乳化交联方法包裹DH形成的微球热稳定性较差。而结合红外光谱图在1 740 cm-1和1 640 cm-1处有较弱的峰,以及在1 060 cm-1处出现的P=O振动吸收峰,可以分析得到微球的包合过程中主要以物理结合为主,所以导致其热稳定性较差。图5中壳聚糖、DH、微球的最大分解速率温度分别在296.77,219.29,267.75 ℃,且不同于物理混合后最大分解速率温度258.66 ℃,这是因为壳聚糖包裹药物后,分子间的氢键减少导致热分解温度降低[23]。综上所述,壳聚糖已将DH包裹在内部。
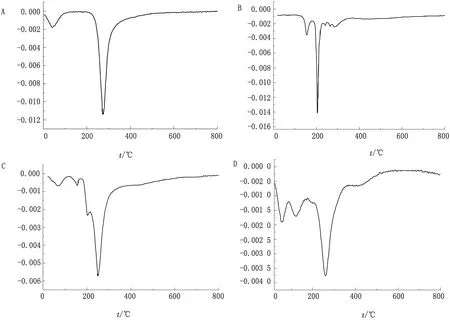
图5 DTG 曲线图 A.壳聚糖;B.DH;C.壳聚糖与DH的物理混合物;D.微球

图4 TGA曲线图 A.壳聚糖;B.DH;C.壳聚糖与DH的物理混合物;D.微球
2.5 XRD结果分析从图6可以看出DH在10~90°有很强的晶体衍射峰,表明DH是以晶体的形式存在的;而壳聚糖在该范围内只出现离散型的隆峰,说明壳聚糖是以无定型的非晶体形式存在的;两者物理混合的衍射图谱为两者图谱的叠加,壳聚糖空球的衍射图表明空球是以无定型的非晶体形式存在的;而载药微球的衍射图谱中为壳聚糖和DH的图谱叠加,只是DH的晶体峰变宽,表明DH被壳聚糖包合成功且仍然以晶体的形式存在。
图6 XRD检测结果 A.壳聚糖空球;B.壳聚糖;C.壳聚糖微球;D.壳聚糖与DH的物理混合物;E.DH
2.6 拉曼光谱结果分析由图7可以看出,DH在400~1 900 cm-1出现拉曼特征峰,主要有在1 629 cm-1处的C=O伸缩振动峰;在1 262 cm-1和1 313 cm-1处的双峰,这是由于环的呼吸振动在拉曼光谱中有很强的拉曼谱带,是环全对称振动的特征峰;在1 180 cm-1处的C-C伸缩振动峰,以及在485 cm-1处的C=O扭曲变形振动峰。壳聚糖在该范围内未出现特征峰,说明壳聚糖对DH峰型没有影响。DH和壳聚糖的物理混合图谱中,DH的拉曼特征峰依然存在,只是随着含量的降低而峰强有所减弱;而壳聚糖空球和壳聚糖载药微球的拉曼图谱在该范围内均未出现上述DH的特征峰。以上结果表明,本试验成功制备了壳聚糖载DH的微球。

图7 拉曼光谱检测结果 A.DH;B.壳聚糖与DH的物理混合物;C.壳聚糖空球;D.壳聚糖;E.壳聚糖微球
3 讨论
DH是一种淡黄色结晶粉末,有吸湿性,易溶于水和甲醇,属于广谱抗菌药,但其半衰期较短、具有一定的胃肠道刺激性及肝肾毒性。壳聚糖作为缓释载体材料具有廉价无毒无刺激,生物相容性高,且壳聚糖具有一定的生物黏附性[24],将其制备成微球后,可以有效减少药物对患者胃肠道的刺激性,同时也可以延长药物的作用时间,提高生物利用度,减少用药次数,增强患者的依从性。此外将DH制备成壳聚糖微球后还可以有效避免水份对药物的影响,提高药物的稳定性。
DH壳聚糖微球在制备过程中采用恒流泵进行滴加,可以更好地防止人为因素对滴加的影响,更好地减小滴加速度、滴加高度及每次滴加的液体剂量对微球粒径的影响。同时在制备过程中以三聚磷酸钠为交联剂同时加入戊二醛为固化剂,两者结合使用,可以更好地提高壳聚糖微球的包封率[25]。
DH壳聚糖微球制备过程中采用Design-expert软件进行设计和优化,按优化配比所制备的载药微球的载药量为56.49%,包封率为61.41%。对微球进行扫描电镜观察微球表面平整圆滑,但具有少许黏连现象,可能由于清洗过程中液体石蜡难以清洗干净或交联过程中壳聚糖微乳之间交联所造成的。
在FT-IR检测中,微球图谱中出现较弱的化学交联峰,可能是由于戊二醛的剂量较小或浓度较低造成的;而壳聚糖与三聚磷酸钠之间的氢键作用和静电作用的峰却十分明显,表明在本试验中物理作用较明显。这也导致壳聚糖微球成球后热稳定性较差,若想加强该微球的热稳定性与机械强度,应该适当加大戊二醛溶液剂量或者提高戊二醛溶液浓度。而在XRD和拉曼光谱检测结果中可以看出,壳聚糖包合DH后,DH并未发生晶体结构的改变,也并没有新的物质产生,这也和上述得出的结果相呼应。综上所述,本试验初步制备出载药壳聚糖微球,为DH缓释制剂的研制提供理论依据。
