单增李斯特菌耐药基因tetM、ermB接合转移
2020-11-06李庆辉康立超李红欢钱凌霄阮婷玉
李庆辉,康立超,李红欢,钱凌霄,阮婷玉,马 勋*
(1.石河子大学 动物科技学院,新疆 石河子 832000;2.新疆农垦科学院 分析测试中心,新疆 石河子 832000)
单核细胞增生李斯特菌(Listeriamonocytogenes,LM),简称单增李斯特菌,是一种胞内寄生菌,可引起全球性的人兽共患李斯特菌病。食源性传播是该菌的主要感染途径,人和多种动物感染主要表现为败血症、脑膜炎、胃肠炎、流产等症状,致死率可达20%~30%[1]。
近年来,抗生素的长期使用导致细菌产生耐药性的机会提高。青霉素是治疗单增李斯特菌病的首选药物,红霉素和四环素都是对青霉素过敏者的替代药物[2]。四环素是LM耐药性最为严重的抗生素,红霉素耐药较少见。人类感染耐药李斯特菌病将导致治疗困难,死亡率增加,更为严重的是LM携带的耐药基因能够在种属内及种属间水平传播,造成多种食源性致病菌的普遍耐药[3]。据报道食源性致病菌(沙门菌、大肠杆菌)的多种耐药基因能在种属内及种属间传播,而tetM和ermB基因已被证实与移动质粒和转座子相关,并已验证在多种物种间转移[4-5]。本试验为了解LM四环素耐药基因tetM及红霉素耐药基因ermB水平传播的能力,以粪肠球菌为宿主进行接合转移试验,验证抗生素耐药性的体外水平转移情况。
1 材料与方法
1.1 菌株供体菌株分离自调理肉制品的2株耐受四环素LM(L34、L38),1株耐受红霉素LM(L40)分离自冷冻鱼糜制品。
受体菌株:1株高度耐受卡那霉素粪肠球菌(E1),保存于石河子大学预防兽医学实验室。药物敏感质控菌株为金黄色葡萄球菌ATCC25923。
1.2 培养基与试剂脑心浸液培养基(BHI)、酪蛋白培养基(MH)购自青岛高科园海博生物技术有限公司;2×PCR Mix购自广州东盛生物科技有限公司;DNA Marker购自北京全式金生物技术有限公司;细菌基因组DNA提取试剂盒购自天根生化(北京)科技有限公司;青霉素、氨苄西林、四环素、红霉素、卡那霉素等抗菌药及琼脂粉购自上海索莱宝生物科技公司。
1.3 引物参考相关文献设计LM特异基因hly[6],粪肠球菌E1特异性基因tuf[7],四环素耐药基因tetM[8],红霉素耐药基因ermB[9],转座子Tn196int-Tn[9]及Tn197[10]基因引物序列(表1)。

表1 引物信息
1.4 供体菌和受体菌的PCR鉴定以供体菌L34、L38、L40和受体菌E1基因组为模板,分别对供体菌L34、L38特异基因hly、四环素耐药基因tetM、供体菌L40特异基因hly和红霉素耐药基因ermB进行PCR扩增;对受体菌E1特异性基因tuf、四环素耐药基因tetM和红霉素耐药基因ermB进行PCR扩增。反应体系(25 μL):2×PCR Mix 12.5 μL,上、下游引物各1 μL,DNA模板3 μL,ddH2O 7.5 μL。反应程序:95℃ 5 min;95℃ 30 s,退火30 s(hly58℃、tuf52℃、tetM60℃、ermB54℃),72℃ 50 s,35个循环;72℃延伸10 min,4℃保存。PCR产物通过琼脂糖凝胶电泳检测。
1.5 接合转移
1.5.1LM四环素耐药菌株接合转移 将过夜培养的供体菌L34、L38菌液接种于含20 mg/L四环素的BHI中,受体菌E1菌液接种于含30 mg/L卡那霉素的BHI中,37℃培养5~6 h后,供体菌与受体菌1∶1混合,混合物离心去除上清加入100 μL BHI重悬,各取50 μL点种于未加抗生素铺有硝酸纤维素膜的BHI平板上,37℃过夜培养。用BHI液体培养基收集硝酸纤维素膜上的细菌混合物,离心弃上清,加入200 μL BHI重悬。将L34、L38与E1的重悬物涂布于含20 mg/L四环素和30 mg/L卡那霉素双抗BHI平板,分别记录为L34-E1、L38-E1平板,37℃培养24 h,观察菌落生长情况。
1.5.2LM红霉素耐药菌株的接合转移 参照1.5.1方法。将L40接种于含10 mg/L红霉素的BHI中,然后将L40与E1的重悬物涂布于含10 mg/L红霉素和30 mg/L卡那霉素的双抗BHI平板,记录为L40-E1平板。
1.6 接合子PCR鉴定每个平板随机挑选2~8个接合子分别接种于5 mL BHI液体培养基,培养16~18 h。按照细菌基因组DNA提取试剂盒说明提取DNA并进行PCR鉴定,对L34-E1、L38-E1平板接合子进行LM特异基因hly、粪肠球菌E1特异基因tuf、四环素耐药基因tetMPCR扩增;对L40-E1平板接合子进行LM特异基因hly、粪肠球菌特异基因tuf、红霉素耐药基因ermBPCR扩增。
1.7 供体菌、受体菌及接合子的药敏试验按照美国临床实验室标准研究所(CLSI)推荐的微量肉汤稀释法(MIC法),对供体菌、受体菌及接合子进行药物敏感试验,判断标准参照CLSI药敏标准(M45-A)和微生物药物敏感试验执行标准M100-S24-2014版[11]。
1.8 供体菌及接合子Tn916、Tn917转座子PCR检测对供体菌L34、L38及接合子L34-E1、L38-E1进行耐药基因tetM相关转座子Tn916检测;对L40及接合子L40-E1进行耐药基因ermB相关转座子Tn917检测。
PCR反应体系为25 μL,Tn916、Tn917转座子基因PCR反应程序:95℃预变性5 min;95℃变性30 s,退火60 s(Tn916 58℃、Tn917 52℃),72℃延伸50 s,35个循环;72℃延伸10 min,4℃保存。
2 结果
2.1 供体菌和受体菌的PCR鉴定供体菌L34、L38、L40扩增出约749 bp的条带,大小与预期LM特异性基因hly结果相符;受体菌E1扩增出约112 bp 的条带,大小与预期粪肠球菌特异基因tuf结果相符(图1);耐受四环素的供体菌L34、L38扩增出四环素耐药基因tetM,大小为740 bp;耐受红霉素的供体菌L40扩增出红霉素耐药基因ermB,大小为636 bp;受体菌未扩增到四环素耐药基因tetM和红霉素耐药基因ermB(图1)。

图1 供体菌与受体菌PCR鉴定 M.DL2000 DNA Marker;1~3.hly基因;4.tuf基因;5,6,8.tetM基因;7,9.ermB基因
2.2 接合转移试验L34-E1、L38-E1涂布于含四环素和卡那霉素双抗的筛选平板,分别得到17,23株接合子。L40-E1涂布于含红霉素和卡那霉素双抗的筛选平板,得到28株接合子(表2)。
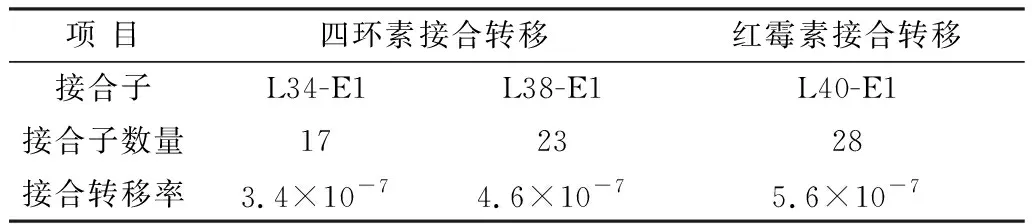
表2 接合转移试验结果
2.3 接合子PCR鉴定L34-E1、L38-E1、L40-E1平板接合子PCR鉴定显示:L34-E1、L38-E1平板的接合子均扩增出740,112 bp的目的片段,与预期的耐药基因tetM、tuf大小一致;LM40-E1平板接合子扩增出636,112 bp的目的片段,与预期的ermB、tuf基因大小一致;且各平板接合子均未扩增出hly基因(图2,3);说明L34、L38株菌的tetM基因成功转移至粪肠球菌,L40的ermB基因成功转移至粪肠球菌。

图2 接合子tetM、ermB基因PCR扩增结果 M.DL2000 DNA Marker;1~4.接合子tetM基因;5~6.接合子ermB基因
2.4 接合子的药敏试验用MIC法对接合子进行药敏试验,L34-E1、L38-E1接合子对四环素的MIC值由2 mg/L升高到64 mg/L,说明对四环素产生了耐药性,且接合子对强力霉素也产生耐药性;L40-E1的接合子对红霉素的MIC值由0.06 mg/L升高到8.00 mg/L,说明对红霉素产生耐药性。供受体菌及接合子对13种抗菌药的药敏结果见表3。
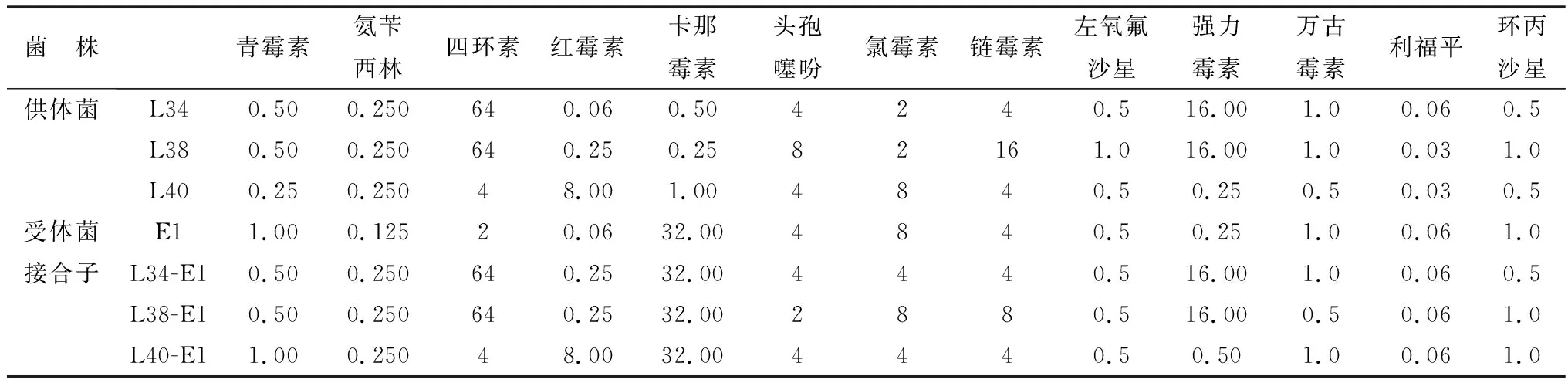
表3 供受体菌与接合子对药物敏感性测定结果(MIC) mg/L
2.5 供体菌及接合子Tn916、Tn917转座子PCR检测见图4。PCR结果显示,供体菌株L34、L38扩增出约525 bp的条带,与预期Tn916转座子int-Tn基因大小相符合;供体菌株L40扩增出约652 bp的条带,与预期Tn917转座子基因大小相符合。对接合子相关转座子基因进行检测均为阴性。

图3 接合子hly、tuf基因PCR扩增结果 M.DL2000 DNA Marker;1~6.接合子hly基因;7~12.接合子tuf基因

图4 转座子Tn916、Tn917 PCR扩增结果 M.DL2000 DNA Marker;1,2.转座子int-Tn基因;4.转座子Tn917基因;3,5.阴性对照
3 讨论
目前四环素是LM耐药性最为严重的抗生素,冯有为等[12]对LM基因组进行分析,发现LM中存在着携带耐药基因的外源遗传元件,获得性转移质粒是LM产生耐药性的重要原因。在LM中的四环素耐药基因主要有tetM、tetS、tetL,其中tetM在LM四环素耐药菌株中最常见,其能够编码的核糖体保护蛋白与核糖体结合,从而阻止了四环素对细菌蛋白合成的抑制作用而产生耐药性[13]。tetM常与质粒、转座子等可移动成分相连在菌群间进行转移[14]。tetM基因在肠球菌和链球菌中很常见,主要定位于染色体上,国外研究证明通过接合作用可将tetM在李斯特菌属间及从LM向粪肠球菌转移,也可从粪肠球菌转移到LM[9]。本试验将2株携带tetM四环素耐药基因的LM向粪肠球菌转移,并用四环素和卡那霉素的双抗平板筛选接合子,分别获得17,23株接合子,接合转移率分别为3.4×10-7,4.6×10-7。与邵美丽等[4]报道的以链球菌为受体菌接合转移率4×10-7相接近,与VICENTE等[15]报道的tetM基因向无害李斯特菌和粪肠球菌10-6的接合转移率相差不大。PCR验证接合子tetM基因阳性,接合子耐药试验表明粪肠球菌获得四环素耐药表型,表明tetM基因成功由LM转移至粪肠球菌并且发挥了耐药作用。研究发现Tn916是与四环素转移密切相关的转座子,由整合酶int-Tn基因编码。本试验在2株耐受四环素的供体LM检测到了int-Tn基因,而在接合子中未发现int-Tn基因,推测LM的tetM基因可能是由非Tn916的其他转座子或可移动质粒携带在不同菌种间转移。
细菌对红霉素耐药,主要是存在erm基因编码红霉素甲基化酶,使红霉素作用靶位发生改变[16]。目前已发现erm基因家族有20余种基因亚型,其中ermB基因比较常见。目前为止,从临床、食品分离耐受红霉素的LM仅检测到ermB、ermC基因。已有研究表明,肠球菌ermB基因通常位于转座子Tn917或接合性质粒上,携带有ermB的Tn917转座子或携带有ermB接合性质粒能在不同菌属内外传播[17]。本试验推测耐受红霉素的LMermB基因也可能由可移动元件携带并水平传播,选择1株耐受红霉素的LM为供体菌,粪肠球菌为受体菌进行接合转移。经筛选在红霉素和卡那霉素双抗平板获得28株接合子,接合转移率为5.6×10-7,转移效率与最初通过从粪肠球菌结合到LM的ermB报道10-4~10-8接合率相符[18]。接合子ermB耐药基因检测阳性并且产生了耐药表型,表明ermB基因由LM转移至粪肠球菌发挥了耐药作用。与四环素耐药转移相似的是,在供体LM中检测到ermB的相关转座子基因Tn917,而在接合子中未发现,推测LMermB向粪肠球菌传递与转座子Tn917没有关系,更可能依赖于其他可移动介质。
LMtetM、ermB耐药基因能够向粪肠球菌跨种水平传播,虽然其结合转移效率较低,但不能忽略种间传播,它在动物和人类病原菌的耐药性传播方面会起到重要的作用。本试验在接合子中未检测到与其耐药相关的转座子,这将为进一步推测与耐药基因连接的移动元件,探讨耐药基因tetM、ermB水平转移机制具有重要意义。
