秦皇岛地区貉肠外大肠杆菌的致病性与耐药性分析
2020-11-06刘勃兴赵安奇柳翠翠史秋梅张志强
刘勃兴,赵安奇,柳翠翠,付 祥,刘 畅,李 浩,史秋梅,张志强
(河北科技师范学院 河北省预防兽医学重点实验室,河北 秦皇岛 066004)
养貉业在我国毛皮动物养殖业中占据重要地位,但随着貉的养殖规模逐渐扩大,貉的各种疾病频发,严重制约着养貉业的健康发展[1]。在貉养殖过程中,貉大肠杆菌病十分常见,肠外致病性大肠杆菌(extraintestinal pathogenicEscherichiacoli,ExPEC)通常可引起貉肺炎、流产、神经系统损伤和败血症等[2-3]。有研究表明,在ExPEC致病过程中,毒力基因可通过质粒或溶原性噬菌体在不同菌属之间水平传播,严重威胁人与其他动物健康[4-6]。
目前,大肠杆菌病的防治以抗生素类药物为主。但随着对抗生素耐药菌株的出现,给临床治疗带来了困难,并且对抗生素耐药的菌株还可通过多种途径传播,影响人与动物的公共卫生安全[7-8]。
本试验对2019年从河北省秦皇岛地区分离的20株貉源ExPEC进行试验研究,为秦皇岛地区貉大肠杆菌病的防制以及ExPEC的致病性和耐药性的相关机制研究奠定基础。
1 材料与方法
1.1 菌株来源20株河北省秦皇岛地区流行的貉源ExPEC(QHE1~20)为2019年由秦皇岛市各县的地方貉养殖场送检疑似大肠杆菌病的病死貉,临床症状以肺炎和神经症状为主,剖检有明显败血症。对送检死貉的肝脏、肺脏、心脏等实质器官中的优势细菌进行分离,经鉴定为大肠杆菌。
1.2 主要试剂伊红美蓝培养基购自北京陆桥技术股份有限公司;DL2000 plus DNA Marker购自中科瑞泰科技有限公司;药敏纸片购自杭州天和微生物科技股份有限公司;2×Taq Master Mix细菌DNA基因组提取试剂盒购自康为世纪生物科技有限公司;引物由生工生物工程(上海)股份有限公司合成;昆明小鼠,体质量(20±2)g,购自北京维通利华实验动物技术有限公司。
1.3 菌株的复苏将冻存的20株ExPEC分别在伊红美蓝培养基上三区划线,于37℃恒温培养箱培养12 h,挑取有金属光泽的单个菌落接种于LB液体培养基,37℃恒温摇床培养12 h。
1.4 小鼠致病性试验将1.3制备的纯化菌液以1∶100的比例转接至另一管LB液体培养基,37℃恒温摇床培养至对数期,用无菌的PBS调整菌液浓度为1×107CFU/mL。每株ExPEC为1个感染组,每组5只小鼠,腹腔注射0.1 mL调整浓度后菌液。设置对照组1组,5只小鼠分别注射0.1 mL无菌PBS。观察各组小鼠状态,记录小鼠发病及死亡情况,并剖检死亡小鼠,分离实质器官细菌并鉴定。
1.5 毒力基因检测按照细菌DNA基因组提取试剂盒说明书提取20株ExPEC的DNA,以提取的DNA为PCR模板。参照文献[9]合成血清抗性蛋白iss基因、肠细胞脱落位点毒力岛(locus of enterocyte effacement,LEE)ler和eaeA基因、耶尔森强毒力岛(high pathogenicity island,HPI)irp2和fyuA基因,空泡形成素vat基因、溶血素基因hlyF、铁摄取系统iucD和iroN基因、P菌毛黏附素papC基因、外膜蛋白ompT基因、Ⅰ型菌毛黏附素fimC基因引物,PCR检测20株ExPEC的毒力基因并统计各菌株毒力基因携带情况。
1.6 药物敏感性试验采取KB纸片法进行药物敏感性试验检测,具体操作参照美国临床和试验室标准协会(CLSI)标准。试验的抗生素分别为β-内酰胺类(氨苄西林、头孢曲松、阿莫西林),氨基糖苷类(阿米卡星、新霉素、卡那霉素),四环素类(多西环素、土霉素),氟喹诺酮类(环丙沙星、恩诺沙星),氯霉素类(氟苯尼考),大环内酯类(替米考星),磺胺类(磺胺间甲氧、磺胺二甲氧、复方新诺明)。试验结果判定参照CLSI药敏试验标准。
1.7 耐药基因检测按照细菌DNA基因组提取试剂盒说明书提取20株ExPEC的DNA,以提取的DNA为PCR模板。参照文献[10]合成四环素耐药基因tetA和tetC,磺胺类耐药基因sul1和sul3,喹诺酮类耐药基因qnrA、qnrB、gyrA和gyrB,β-内酰胺类耐药基因ctx-M和SHV,氨基糖苷类耐药基因addA1、strA和strB,大环内酯类耐药基因ermA和mefA引物,PCR检测20株ExPEC的耐药基因并统计各菌株耐药基因携带情况。
2 结果
2.1 小鼠致病性试验感染小鼠后,对各组小鼠持续观察2周。感染组小鼠出现呼吸急促、紊乱,精神萎靡。各感染组小鼠死亡情况见表1。剖检死亡小鼠,小鼠肝脏、肺脏有明显出血点,腹腔有积液。对照组小鼠无死亡,状态良好,无病征。分离感染组死亡小鼠肝脏、肺脏等器官细菌,经鉴定为大肠杆菌,生化鉴定等鉴定结果与感染菌株特征相近。
2.2 毒力基因检测毒力基因检测结果显示,20株ExPEC分别检出1~10个毒力基因,具体见表1。12种毒力基因中,未检出papC基因,其余11种毒力基因均检出。各毒力基因检出率见图1,其中iucD基因检出率最高,为85%(17/20)。试验的20株ExPEC均携带毒力基因,各菌株所检出的毒力基因组合形式较多。在致病性试验中,感染小鼠后小鼠未全部死亡的菌株毒力基因检出数要明显少于全部死亡的菌株。

表1 20株ExPEC毒力基因检测结果与小鼠死亡情况
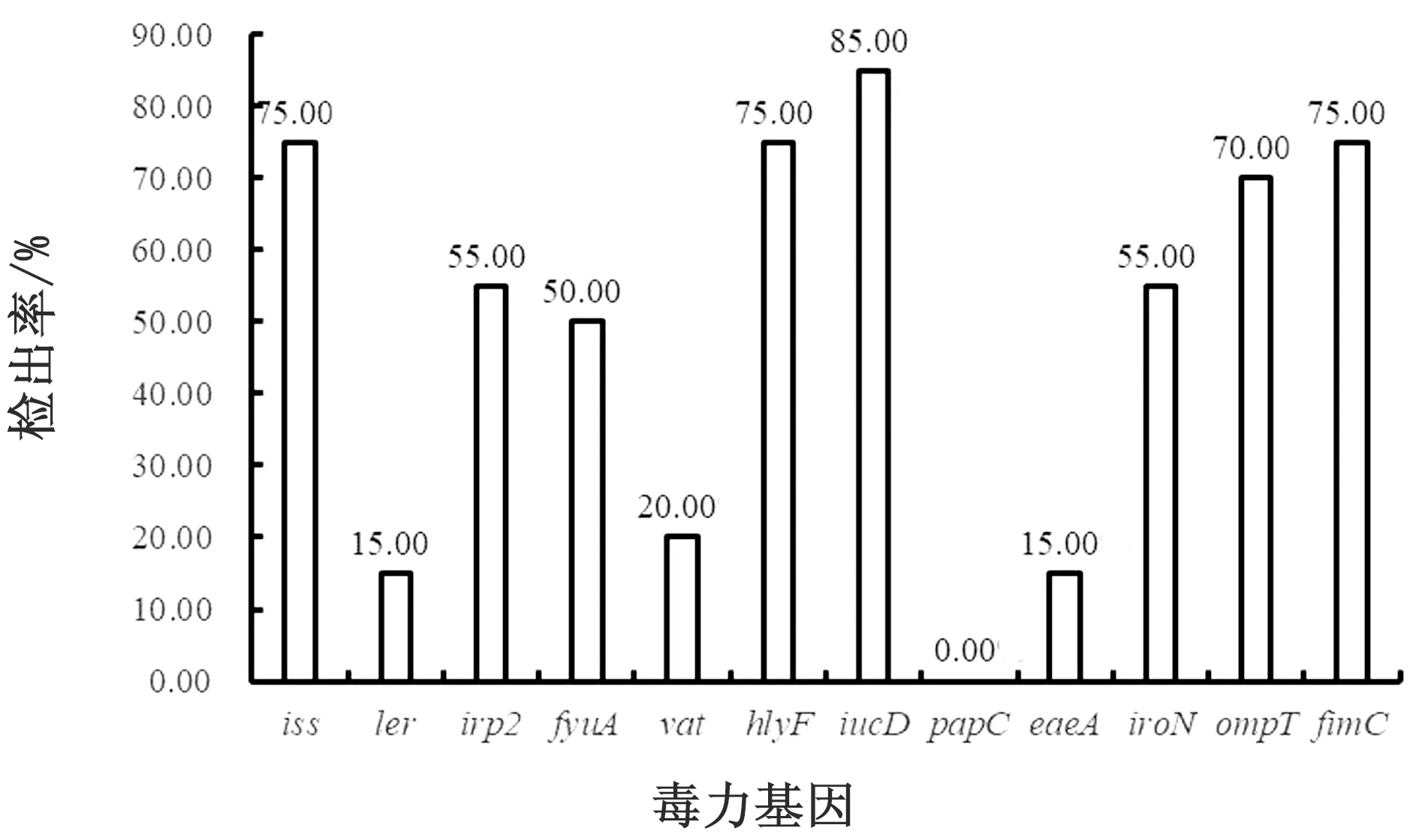
图1 20株ExPEC各毒力基因检出率
2.3 药物敏感性试验药物敏感性试验结果显示,20株ExPEC对多西环素耐药率高达100%(20/20),对头孢曲松敏感率最高为40%(8/20)(表2)。分离菌的耐药谱显示,20株ExPEC分别对6~15种抗生素表现耐药,对3类抗生素及以上多重耐药菌株占比高达100%(20/20)(表3),说明20株ExPEC耐药表型较为复杂多样。

表3 20株ExPEC的耐药谱
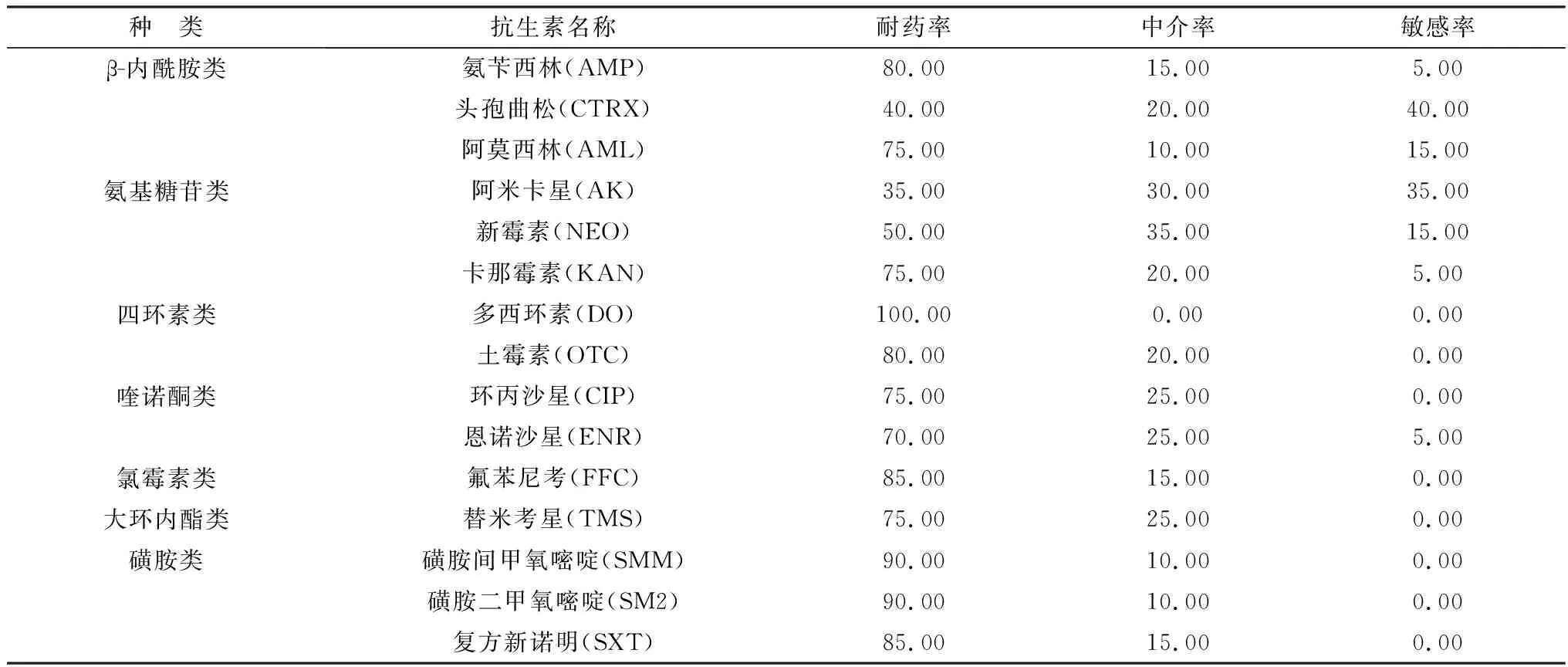
表2 20株ExPEC的药物敏感性试验结果 %
2.4 耐药基因检测耐药基因检测结果显示,20株ExPEC分别携带2~8个耐药基因(表4)。15种耐药基因中,四环素类耐药基因tetA和tetC,磺胺类耐药基因sul1,大环内酯类耐药基因mefA未检出,其余10种耐药基因有不同程度的检出,喹诺酮类耐药基因gyrA和gyrB检出率最高,均为80%(16/20)(图2),说明20株ExPEC的耐药基因携带情况较为复杂。

图2 20株ExPEC各耐药基因检出率

表4 20株ExPEC耐药基因检出情况

续表
3 讨论
ExPEC是一种能够引起猪、牛、羊、鸡等多种动物发病的人畜共患病原菌[11-12]。动物感染ExPEC后临床表现复杂,毛皮动物感染后以肺炎、败血症为主,具有较高的死亡率[13]。国内外对于猪源、禽源ExPEC的相关报道居多,且致病菌株占比较高,而毛皮动物,尤其是貉源ExPEC相关报道较少。本试验以小鼠为动物模型对20株ExPEC的致病力进行初步研究,结果显示,20株ExPEC可致小鼠出现不同程度的死亡,且均具有致病力,表明秦皇岛地区貉源ExPEC均具有一定的毒力,养殖过程应注意合理预防貉大肠杆菌病,减少经济损失。但20株ExPEC致病力及其强弱还需进一步进行动物回归试验和LD50试验验证。
有研究表明,ExPEC毒力基因与其在动物宿主体内定植,逃逸甚至破坏宿主相关免疫系统,对宿主的致病性和自身遗传进化有一定的相关性[5,14]。因此,通过对ExPEC的毒力基因进行研究,可进一步了解ExPEC的感染发病机制以及该地区致病菌的病原特征。在ExPEC的毒力基因中,以黏附因子、免疫逃逸和代谢相关毒力基因为主[15]。因此,本试验选取上述3类毒力基因中研究较多的12种进行检测。研究发现,20株貉源ExPEC共计检出11种毒力基因且每种毒力基因检出率不同。在所检测的毒力基因中,iucD基因检出率最高。iucD属于iuc基因家族,该基因家族编码气杆菌素相关蛋白的合成[16]。气杆菌素系统可增强细菌从宿主摄取铁的能力,进而影响细菌的致病力[17-18]。有报道通过基因敲除技术构建了禽大肠杆菌iucD基因缺失株,并通过动物试验验证了iucD基因缺失降低禽源大肠杆菌的致病力,表明iucD基因与大肠杆菌的致病性有一定的相关性[19-20]。此外,李巧玲[10]报道秦皇岛地区狐肺炎大肠杆菌iucD基因的检出率为71.4%(55/77);贾青辉等[21]报道河北地区鸡源致病性大肠杆菌iucD基因的检出率为95.2%(99/104),表明在河北地区,尤其是在秦皇岛地区,动物源ExPEC中iucD基因较为流行。本试验毒力基因数携带多的菌株小鼠死亡率明显高于携带数少的菌株,在马增军等[22]和朱利霞等[23]的研究中,同样出现过该现象,但两者是否有明显的相关性还有待考证。
抗生素类药物在大肠杆菌病的防治中有着重要地位,但在临床治疗过程中,由于致病菌产生了耐药性,导致某些抗生素类药物的疗效锐减或无效;因此,了解当地致病菌的耐药表型并指导临床用药对相关细菌病的防控具有重要意义。本试验选取临床常用的15种抗生素药物进行试验,结果显示,20株ExPEC均对3类以上抗生素多重耐药性,且不同菌株耐药表型有一定的差别。15种抗生素中,20株ExPEC对多西环素、磺胺间甲氧嘧啶、磺胺二甲氧嘧啶等12种抗生素耐药率在70%以上,对多西环素耐药率高达100%(20/20),表明上述12种抗生素对20株ExPEC的治疗效果较差,临床用药时应选用敏感度较高的头孢曲松、氨苄西林等治疗。据冯涛等[24]报道,黑龙江和吉林两省貉源大肠杆菌对头孢噻吩、氨苄西林和四环素耐药率较高,与本试验结果有较大差别;据高光平等[25]报道,秦皇岛市昌黎县的狐和貉源大肠杆菌对土霉素、多西环素、磺胺间甲氧嘧啶、磺胺二甲氧嘧啶等耐药性较高,与本试验结果相近,表明不同地区貉源大肠杆菌对抗生素的耐药性表型不同,同一地区貉源大肠杆菌的耐药表型相近,这可能与地方用药情况有关。因此,临床应注意合理用药,避免耐药性的产生,并实时监控地方流行致病菌株的耐药情况,可有效地防制相关细菌病。
细菌耐药性的产生分为固有耐药和获得耐药两类,而后者被认为是耐药性产生的主要原因[26]。细菌的耐药基因可通过质粒、整合子、转座子等移动基因元件在不同菌株之间转移,使菌株获得耐药性。本试验选取目前研究最多的6类15种耐药基因进行检测,结果显示,20株ExPEC分别检出2~8个耐药基因,不同菌株耐药基因携带情况有一定的不同。除四环素类耐药基因tetA和tetC,磺胺类耐药基因sul1,大环内酯类耐药基因mefA,其余11种耐药基因均有检出。在检出的耐药基因中,喹诺酮类耐药基因gyrA和gyrB检出率最高。DNA回旋酶的2个A、B亚基分别由gyrA、gyrB基因编码,这2个基因突变导致喹诺酮类药物作用靶位改变,降低了喹诺酮类药物的结合率使细菌耐药[27]。在本试验中,喹诺酮类抗生素环丙沙星和恩诺沙星这2种药物的耐药率同样很高,表明细菌耐药性的产生与耐药基因存在一定的相关性。但四环素类、大环内酯类和磺胺类抗生素的耐药基因检出率与耐药率符合率较低,分析其原因有:细菌耐药性的产生是由多个基因和多重机制共同作用的结果,本试验仅选取目前较为常见的几种耐药基因进行调查;耐药基因与药物敏感性试验等耐药性试验检测技术有一定的误差。本试验对秦皇岛地区貉源ExPEC的耐药性和耐药基因携带情况进行了初步研究,为后续貉源ExPEC耐药性产生原因的机制研究以及临床合理应用抗生素提供依据。
