猪传染性胃肠炎病毒qRT-PCR检测方法的建立
2020-11-06原冬伟颜子涵申贵男李明月
原冬伟,颜子涵,申贵男,王 一,李明月
(黑龙江八一农垦大学 动物科技学院, 黑龙江 大庆 163319)
猪传染性胃肠炎(transmissible gastroenteritis,TGE)是由猪传染性胃肠炎病毒(transmissible gastroenteritis virus,TGEV)感染引起猪以腹泻、呕吐、脱水为主要临床特征的一种高度接触性肠道传染病。该病由于传染性强,尤其感染2周龄内仔猪,死亡率高,最高可达100%[1-2],且临床生产中防控难度大,治疗恢复仔猪也会终身影响其消化系统,引起小肠绒毛萎缩,吸收能力下降,降低饲料利用效率,给养猪业造成巨大经济损失[3-4]。TGEV可通过粪便排泄污染外界环境,在猪群间传播速度极快,也可以通过气溶胶进行传播[5],被感染的仔猪所表现的临床症状和剖检特征与其他病毒性腹泻疾病很难鉴别,为临床TGE的预防和诊断增加了难度。目前,针对TGE临床常规检测方法有RT-PCR、酶联免疫吸附法、胶体金法等,这些方法虽然特异性好,但均存在灵敏性低的缺点,检测时容易出现假阴性,影响该病的早期诊断和防控措施的进行。因此,建立一种更加特异、灵敏的TGEV检测方法对TGE的防控具有重要意义。
TGEV是尼多病毒目,冠状病毒科成员,基因结构为单股正链RNA,包括4个结构蛋白和5个非结构蛋白,其中N蛋白在病毒的转录和复制过程中起重要作用[6],并且在结构蛋白中具有高度保守性。本试验根据TGEV N基因比对后的保守序列设计并合成2对特异性引物,建立了qRT-PCR检测方法。该方法可用于TGEV的早期鉴别诊断,同时也可为猪群病原提供实时监测,为TGEV的流行病学调查、防控措施的制定和病原净化提供参考依据。
1 材料与方法
1.1 病毒样品TGEV、猪轮状病毒(PoRV)、猪德尔塔冠状病毒(PDCoV)、猪流行性腹泻病毒(PEDV)毒株均由本实验室保存。
1.2 主要试剂pMD18-T 载体、反转录试剂盒、T4DNA连接酶、限制性内切酶、PCR相关试剂、DL2000 DNA Marker、DNA凝胶回收试剂盒及SYBR Premix Ex TaqⅠ聚合酶均购自TaKaRa公司;TRIzol 试剂购自Invitrogen公司。
1.3 引物设计与合成以TGEV N基因为靶基因,通过NCBI BLAST比对,选择N基因保守区域,参考GenBank登录的JS2012(KT696544.1)N基因序列设计2对特异性引物(表1),引物由哈尔滨睿博兴科生物技术有限公司合成。

表1 TGEV N基因引物序列
1.4 阳性标准品的制备
1.4.1病毒RNA提取 按照病毒RNA提取试剂盒说明书,提取病毒RNA,提取的RNA测量浓度后直接反转录或-40℃保存。
1.4.2cDNA的合成 病毒RNA反转录体系:RNA 2 μL,随机引物0.5 μL,Buffer 2 μL,RNA酶抑制剂(40 U/μL) 0.25 μL,dNTP(10 mmol/L) 1 μL,M-MuLV反转录酶(200 U/μL) 0.5 μL,加ddH2O补至10 μL。将液体置于42℃水浴30 min,迅速放入70℃水浴终止反应。制备的cDNA于-40℃保存。
1.4.3PCR扩增及回收纯化 PCR扩增体系50 μL:2×Premix预混酶25 μL,TGEV-F 1 μL,TGEV-R 1 μL,cDNA 4 μL,ddH2O 19 μL。扩增条件:94℃ 5 min;94℃ 30 s,52℃ 30 s,72℃ 30 s,35个循环;72℃延伸10 min。将扩增产物进行1.5%琼脂糖凝胶电泳鉴定,DNA纯化回收试剂盒回收目的基因扩增片段。
1.4.4病毒N基因的T载体克隆 将回收的N基因片段进行T载体克隆。体系:pMD18-T载体 1 μL,10×T4DNA Ligation Buffer 1 μL,T4DNA 连接酶(3 U/μL) 1 μL,模板5 μL,加ddH2O至10 μL。于16℃低温金属浴中连接16 h。将连接产物转入E.coliDH5α感受态细胞中,并将37℃预热的SOB培养基1 mL与连接产物混匀,37℃摇床中扩增1 h后,6 000×g离心5 min,弃上清液,取200 μL LB培养基与沉淀混匀,均匀涂到LB(Amp+)固体培养基上,37℃培养12~16 h。在LB平板上选取大的单菌落进行挑菌,挑取的单菌落与50 μL的LB培养基混匀,进行菌落PCR鉴定,反应体系如1.4.3。鉴定为阳性的菌落接种到4 mL LB(Amp+)液体培养基中,送至哈尔滨擎科生物技术有限公司测序。
1.4.5标准品的制备 测序成功的阳性菌落经扩增后使用质粒提取试剂盒提取阳性质粒,分光光度计测定浓度并计算拷贝数,然后10倍倍比梯度稀释。
1.5 qRT-PCR标准曲线的构建将梯度稀释阳性标准品参照SYBR Primix Ex Taq 试剂盒20 μL 体系,荧光染料预混液10 μL,上、下游引物各0.2 μL,模板2 μL,加ddH2O至20 μL。对引物浓度、退火温度、循环条件和循环次数等进行筛选,选用最佳优化条件进行荧光定量PCR扩增,选取7个稀释度绘制标准曲线,每个梯度设3个平行进行检测。
1.6 敏感性试验将初始浓度为6.06×108拷贝/μL的质粒标准品进行10倍梯度稀释,以每个稀释度的质粒标准品作为模板,利用建立的方法进行检测,以确定该方法的最低检测限。
1.7 特异性试验以TGEV、PoRV、PDCoV、PEDV的cDNA为模板,通过已建立的方法进行检测,TGEV样品作为阳性对照,ddH2O为阴性对照,用以评价方法的特异性。
1.8 临床应用对本实验室保存的24份疑似TGEV感染的病料进行普通RT-PCR检测和qRT-PCR检测,评价检出率的高低。
2 结果
2.1 胶回收纯化结果将RT-PCR扩增片段胶回收纯化,产物加入Loading Buffer进行1.5%琼脂糖凝胶电泳鉴定,所得到目的片段大小与预期相符(图1),测序结果与预期完全一致。
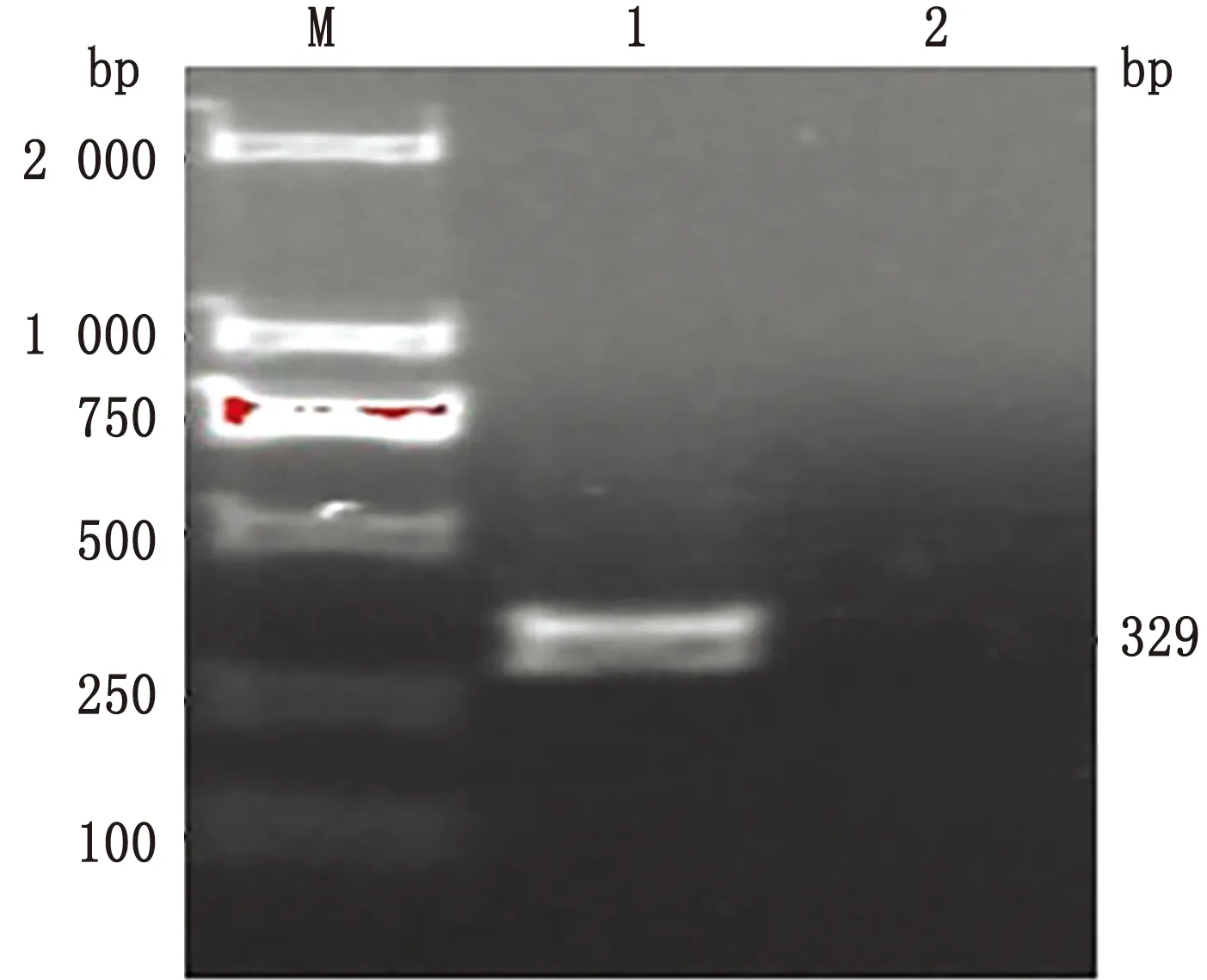
图1 TGEV N基因片段PCR产物纯化鉴定结果 M.DL2000 DNA Marker;1.N基因扩增产物;2.阴性对照
2.2 qRT-PCR反应体系与反应条件的建立通过对qRT-PCR反应体系进行优化,20 μL反应体系:荧光染料预混液10 μL,上、下游引物各0.2 μL(10 μmol/ L),模板2 μL,加ddH2O至20 μL。反应条件:45℃ 10 min;95℃ 10 min;95℃ 15 s,60℃ 45 s (收集绿色荧光信号),40个循环。
2.3 qRT-PCR标准曲线的构建取重组质粒7个稀释度(6.06×102~6.06×108拷贝/μL)作为标准品,建立检测TGEV的qRT-PCR标准曲线,结果显示(图2),标准曲线方程为:y=-3.484 6x+34.851 0,R2=0.999 8,该方法具有良好的线性关系。分析熔解曲线可知熔解温度在78.8℃所有样品均出现单峰(图3),说明该方法所扩增基因片段特异性强。
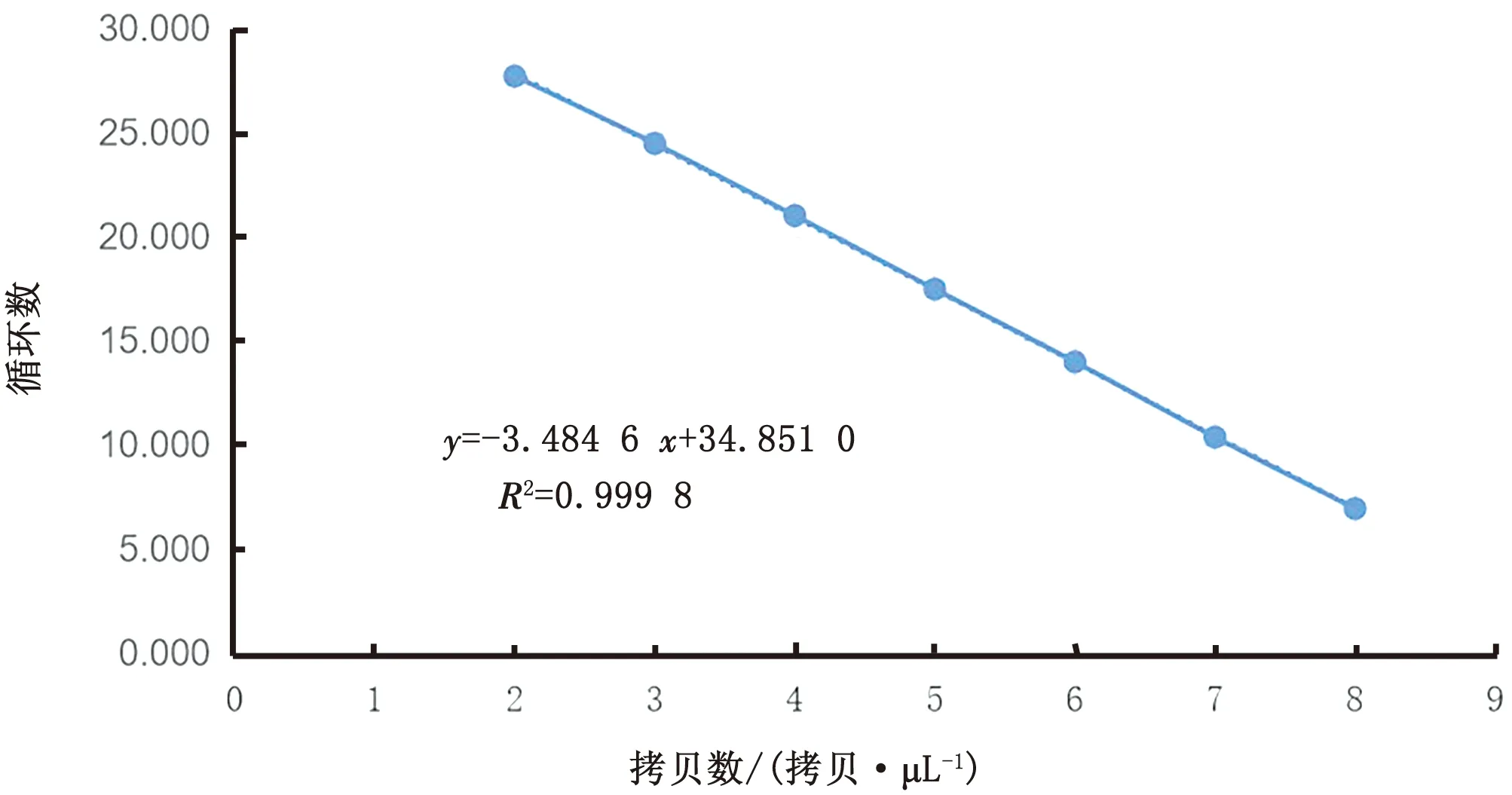
图2 TGEV qRT- PCR的标准曲线

图3 TGEV qRT-PCR的熔解曲线
2.4 敏感性试验以标准品质粒8个稀释度(6.06×101~6.06×108拷贝/μL)为模板,每个梯度作3个重复,进行qRT-PCR检测。结果显示,当病毒含量为6.06×102拷贝/μL(Ct值为27.7)时,扩增曲线良好,而当病毒含量为6.06×101拷贝/μL(Ct值为29.2)时,扩增曲线无法与水(Ct值>30判定为阴性)进行区分(图4);因此该方法的检测下限为6.06×102拷贝/μL。
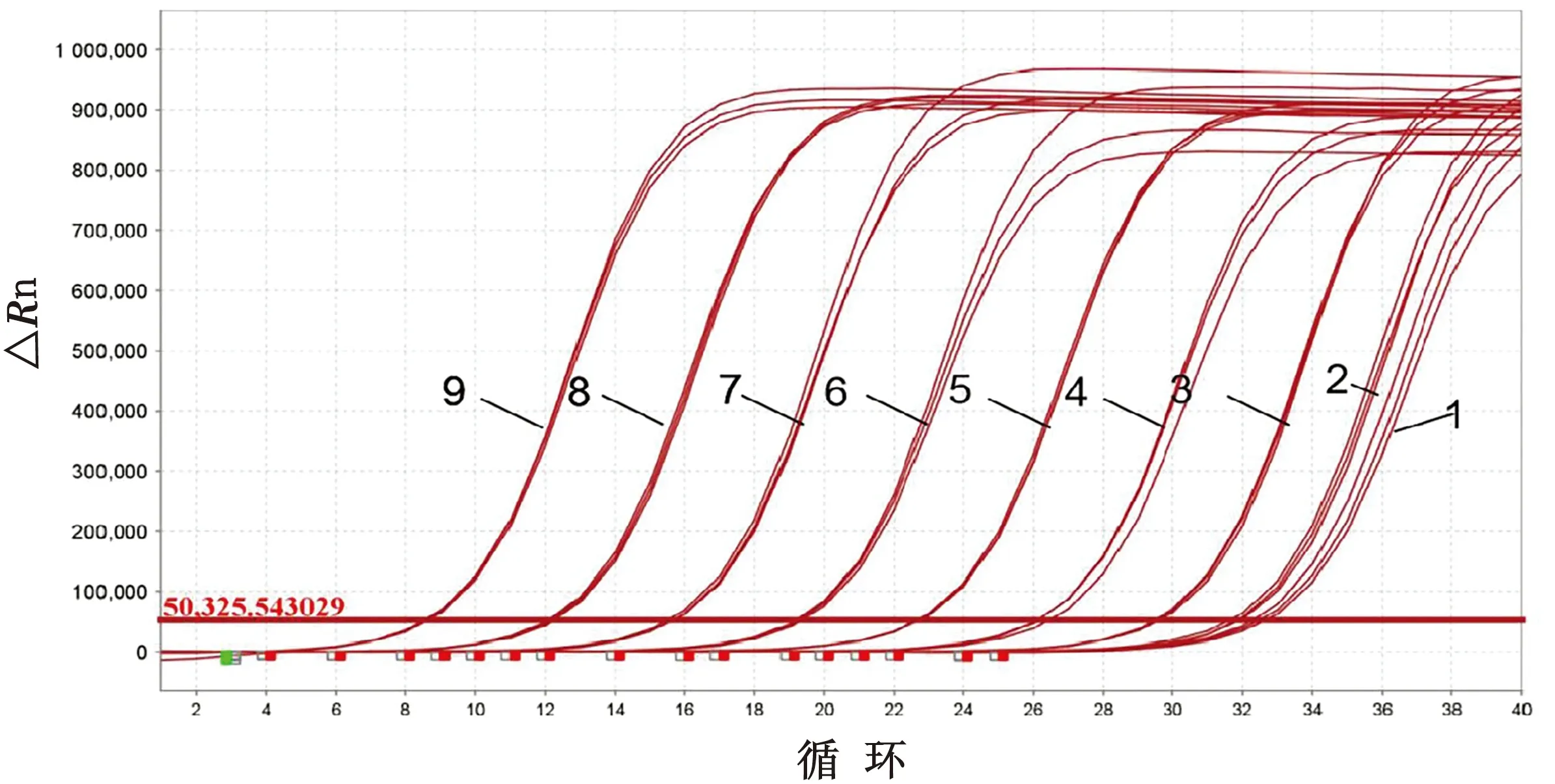
图4 TGEV qRT-PCR敏感性试验结果 1.ddH2O;2~9.6.06×101~6.06×108 拷贝/μL
2.5 特异性试验以本实验室保存的毒株PoRV、PDCoV、PEDV的cDNA为模板,TGEV标准品为阳性对照,ddH2O作阴性对照进行qRT-PCR检测,结果显示,只有TGEV阳性标准品出现典型的扩增曲线,其他毒株与水作对照均未出现扩增曲线,无交叉反应或特异性扩增,表明所建立方法具有良好的特异性。但在反应进行32个循环处(Ct值>30),阴性对照产生扩增反应,与敏感性试验结果保持一致(图5)。

图5 TGEV qRT-PCR特异性试验结果
2.6 临床检测通过建立的qRT-PCR方法和常规RT-PCR方法对临床24份疑似TGEV感染的病料进行检测,结果显示,常规RT-PCR方法检测有4份阳性样品,所建立的qRT-PCR结果显示有6份阳性样品,且常规RT-PCR检测出的阳性样品用所建qRT-PCR检测也均为阳性。
3 讨论
TGEV感染后的临床症状与其他腹泻病毒感染很难区分,特别是存在混合感染的情况下,严重干扰临床诊断[7-8],因此建立一种科学、准确的TGEV检测方法具有重要意义。目前临床检测TGEV的方法有很多,如RT-PCR、巢式RT-PCR、胶体金试纸、RT-LAMP、细胞分离鉴定和免疫荧光等,但这些检测方法仍存在成本高、灵敏性差、操作繁琐、检测时间长、易受污染等不足[9-13]。qRT-PCR检测方法具有简便、快速、灵敏、高效等特点并可进行定量分析,分为染料法和探针法。探针法灵敏度高,但成本较高[11];染料法虽不及探针法灵敏却具有相对灵敏、成本低廉等优势,故本试验建立了用于检测TGEV的染料法qRT-PCR检测方法。
本试验建立的qRT-PCR检测方法通过与GenBank公布的TGEV N基因序列进行比对,针对保守区域设计引物,N基因具有高度保守的特性,所以该方法具有良好的特异性和广泛的应用性,可适用于目前绝大部分的TGEV毒株。敏感性结果显示,本试验建立方法能检出的最低拷贝数为6.06×102拷贝/μL,较常规RT-PCR[14]高出1 000倍,完全可以满足临床TGEV的早期感染检测。特异性结果显示除TGEV阳性样品外,其他毒株及水对照均无特异性曲线,这说明该方法具有良好的特异性,完全可用于临床腹泻性病毒的鉴别诊断。值得注意的是,本试验建立的qRT-PCR检测方法经批内、批间重复性试验发现,反应中阴性对照在32个循环处可收集到荧光信号,此时平均Ct值>30,经反复试验确定非污染造成,因此将检测反应中Ct值>30均可判为阴性而不影响检测方法的准确度。导致此种情况的原因可能是引物中的发卡结构造成,可通过引物优化设计来杜绝。临床样品检测结果证明,qRT-PCR检测方法的阳性检出率为25%,明显高于常规RT-PCR检测方法,且阳性检测正确率达100%,与本试验敏感性结果保持一致。因此,本试验建立的检测方法准确、有效,且特异性好,敏感性更强,可满足临床检测的需求,而且能够实时呈现病毒含量,为TGEV的流行病学调查、疫病早期防控和猪场TGE的检测提供参考依据。
