1,25(OH)2D3对猪伪狂犬病病毒诱导小鼠流产的影响
2020-11-06左玉柱袁广富张建楼范京惠飞1
左玉柱,韩 磊,王 晶,袁广富,张建楼,范京惠*,仲 飞1,*
(1.河北农业大学 动物科技学院,河北 保定 071001;2.河北农业大学 动物医学院,河北 保定 071001)
猪伪狂犬病(pseudorabies,PR)是由伪狂犬病病毒(pseudorabies virus,PRV)引起的一种急性、高度接触性传染病,临床症状主要表现为奇痒、发热和神经症状,妊娠母猪繁殖障碍、流产和死胎等[1- 2]。PRV属于疱疹病毒科,α疱疹病毒亚科[3]。宿主较多,除猪外,还包括反刍动物、肉食动物和啮齿动物等[4]。自2011年以来,PRV的感染力增强,感染率不断上升,国内猪场伪狂犬野毒抗体阳性率居高不下,导致妊娠母猪的流产率和仔猪死亡率较高,对养猪业造成了较大的经济损失[5-6]。目前,临床上主要使用疫苗预防PR,尽管疫苗在防控PR的过程中起到了至关重要的作用,但目前疫苗免疫猪场的PR野毒抗体阳性率依然较高,因此,在防控PR的过程中,还应寻求其他辅助途径,与疫苗免疫配合使用,才能降低PR对猪场的危害。
1,25(OH)2D3,为维生素D3的活性物质,不仅参与免疫调节,还参与雌性生殖系统的调节,且具备一定的抗病毒作用[7-9]。然而,1,25(OH)2D3在抗PRV方面的作用,目前尚不明确。1,25(OH)2D3在体内的吸收和代谢与维生素D受体(vitamin D receptor,VDR)是否表达及表达量的高低有关[10]。在雌性小鼠生殖系统中VDR存在于卵巢、输卵管和子宫中,并且该受体主要是在妊娠早期滋养层细胞中起到调节的作用[11]。为了开展1,25(OH)2D3在防控PRV引起母猪流产方面的研究,本试验使用不同剂量的PRV 感染小鼠,以确定引起感染小鼠流产的PRV最佳剂量;使用1,25(OH)2D3预处理小鼠研究生殖系统中VDR mRNA水平及PRV的量,阐明1,25(OH)2D3对PRV增殖以及小鼠流产的影响,为1,25(OH)2D3在抗PRV引起的母猪繁殖障碍方面的作用提供依据。
1 材料与方法
1.1 病毒和实验动物PRV(HB-BD株,25代)由河北农业大学动物医学院预防兽医学实验室分离,其gE基因GenBank登录号为MG738722。雌性昆明小鼠9~12 周龄,体质量(34±2) g,共95只;同龄雄性昆明小鼠30只,体质量(36±2) g。将小鼠在25℃条件下饲养并自由采食,自由饮水,饲养1周以适应环境。小鼠均购自北京斯贝福生物技术有限公司(SPF ( Beijing ) Biotechnology Co.,Ltd.)。
1.2 主要试剂1,25(OH)2D3粉剂购自Sigma;TRIzol Reagent/RNA提取试剂,反转录试剂盒PrimeScriptTMRT-Kit购自TaKaRa生物工程(北京)有限公司;2× SYBR Green qPCR Master Mix,Super GelRed®核酸凝胶染料购自US Everbright®Inc(苏州)。
1.3 引物设计根据GenBank登录的序列分别设计合成1对VDR检测引物VDR-1F/R和1对PRV的荧光定量PCR引物,并根据VDR扩增产物的测序结果,设计1对荧光定量PCR引物VDR-2F/R(表1),引物均由生工生物工程(北京)有限公司合成。
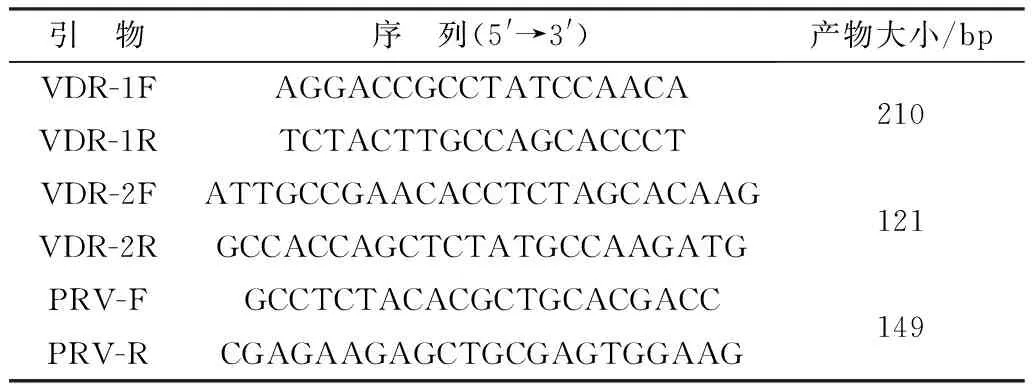
表1 引物信息
1.4 引起小鼠流产的PRV最佳接种量的确定将昆明雌鼠和雄鼠按2∶1合笼,合笼9 h后通过阴栓确定小鼠的妊娠情况,小鼠妊娠12 d左右时,将妊娠小鼠分为对照组(NC)和接种不同剂量PRV的流产模型组,每组8只妊娠小鼠。模型组小鼠分为低、中、高剂量组,分别注射0.25,0.35,0.40 mL 1 000 TCID50PRV,对照组给予等量的生理盐水,均颈背部皮下注射。注射后每隔6 h,观察小鼠流产和死亡情况,以确定引起小鼠流产的PRV最佳接种剂量。
1.5 1,25(OH)2D3对VDR表达量的影响待小鼠妊娠7 d时,使用不同质量浓度的1,25(OH)2D3处理,共分为4组:对照组(NC),200,300,400 μg/kg 1,25(OH)2D3试验组,对照组给予等量的生理盐水,每组8只小鼠。注射后,每隔1 d 取2只小鼠检测子宫和卵巢中VDR的表达量,连续检测4次,以确定小鼠生殖系统中VDR量达到最高的时间以及1,25(OH)2D3最佳质量浓度。具体操作方法:将取得的子宫和卵巢按照TRIzol法提取组织总RNA,并使用反转录试剂盒对总RNA进行反转录得到cDNA,-80℃保存。以反转录的cDNA为模板,VDR-1F/R为引物进行PCR扩增,反应体系为20 μL:Taq DNA聚合酶0.5 μL,dNTPs 3 μL,10×PCR Buffer 2.5 μL,上、下游引物各1 μL(10 μmol/L),ddH2O 8 μL,模板4 μL。反应程序:95℃ 5 min;95℃ 30 s,52℃ 30 s,72℃ 25 s,30个循环;72℃ 10 min。PCR反应产物经1.5%琼脂糖凝胶电泳后,按照琼脂糖凝胶回收试剂盒的操作步骤回收目的片段,并送上海生物工程有限公司测序,以确定扩增的目的基因为VDR。
VDR mRNA表达水平通过SYBR Green Ⅰ荧光定量PCR方法检测,反应体系为20 μL:qPCR Master Mix 7.5 μL,上、下游引物各0.8 μL(10 μmol/L),模板1 μL,用水补至20 μL。反应程序:95 ℃ 5 min;95 ℃ 5 s,58 ℃ 20 s,72 ℃ 20 s,40个循环。
1.6 1,25(OH)2D3对PRV引起小鼠流产的影响检测小鼠妊娠7 d 时,按照1.5方法,使用不同浓度的1,25(OH)2D3预处理小鼠后6 d,每只小鼠皮下注射1 000 TCID50PRV 0.35 mL。对照组小鼠使用生理盐水预处理。小鼠接种PRV后,每隔6 h,观察小鼠流产及死亡情况。
1.7 1,25(OH)2D3对PRV增殖及PRV引起的流产小鼠组织病理学影响确定小鼠生殖系统中VDR表达量最高的时间和1,25(OH)2D3最佳质量浓度后,妊娠7 d左右的小鼠,使用300 μg/kg 1,25(OH)2D3 预处理,预处理后6 d,接种0.35 mL 的1 000 TCID50PRV。共分为4组:对照组(NC)、1,25(OH)2D3试验组、PRV试验组和1,25(OH)2D3+PRV试验组,每组小鼠8只。注射PRV后,每隔6 h观察小鼠的流产和死亡情况。当PRV试验组小鼠出现流产症状后,处死所有小鼠,取小鼠卵巢和子宫,一部分提取核酸后,通过荧光定量PCR,检测1,25(OH)2D3对PRV增殖的影响;一部分使用SAKURA Tissue-Tek®O.C.T.Compound包埋,-20℃保存30 min后,制作冰冻切片,并进行HE染色。通过组织学病理切片观察,检测1,25(OH)2D3对PRV引起的流产小鼠组织病理学影响。
染色的具体步骤:将固定好的切片放在自来水中浸泡约1 min,苏木精染液中染色3 min,盐酸乙醇分化10 s,自来水浸泡30 s,伊红染液染色1 min,自来水浸泡30 s,70%,80%,90%,100%酒精脱水各1 min,二甲苯Ⅰ和二甲苯Ⅱ各染色15 min,最后用中性树胶封片,室温放置,镜下观察流产小鼠卵巢、子宫的病理变化。
2 结果
2.1 引起小鼠流产的PRV最佳接种量的确定小鼠妊娠12 d 时,分别颈背部皮下注射不同剂量的PRV。与接种生理盐水的对照组相比,低剂量组小鼠在攻毒后的54 h逐渐出现了奇痒,注射部位因小鼠抓咬而被毛脱落,72 h 开始出现了死亡,84 h 时小鼠死亡4只,其中2只小鼠出现流产症状;中剂量组小鼠接种病毒后48 h 开始出现奇痒,并伴随有流产症状,随着时间的延长,流产小鼠数量增多,至84 h 流产6只。高剂量组的主要症状为奇痒,小鼠在接种PRV后36 h出现奇痒症状,之后精神萎靡,接种后48 h开始出现死亡,至72 h全部死亡,3只出现流产症状(图1,2)。结果显示,PRV可引起妊娠小鼠流产,且注射0.35 mL 1 000 TCID50PRV的小鼠出现流产的时间较早、症状最显著,为诱导小鼠流产的最佳接种剂量。

图1 PRV攻毒后60 h小鼠临床症状 A.对照组;B.低剂量组;C.中剂量组;D.高剂量组
2.2 1,25(OH)2D3对小鼠VDR表达量的影响小鼠妊娠7 d左右时,使用不同浓度的1,25(OH)2D3预处理的妊娠小鼠,每隔1 d 取2只小鼠检测生殖系统内VDR mRNA含量。将取得的卵巢和子宫提取RNA并反转录为cDNA,普通PCR扩增结果与目的条带大小一致,且测序结果与GenBank登录的VDR序列比对一致。经荧光定量PCR分析结果显示,与对照组(NC)相比,注射不同浓度1,25(OH)2D3的妊娠小鼠卵巢和子宫VDR mRNA表达水平均有所提高,且在注射后6 d达到最高。与其他1,25(OH)2D3预处理组比较,300 μg/kg 1,25(OH)2D3预处理的小鼠在6 d 时VDR mRNA表达水平最高(图3)。
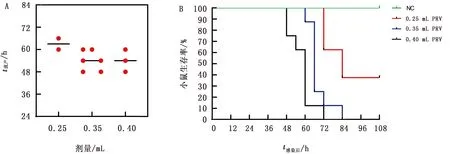
图2 PRV感染小鼠的流产及存活情况 A.小鼠流产情况;B.小鼠存活情况

图3 不同剂量1,25(OH)2D3处理小鼠生殖系统的VDR mRNA表达水平
2.3 1,25(OH)2D3对PRV引起小鼠流产的影响的检测对不同质量浓度(200,300,400 μg/kg) 1,25(OH)2D3预处理的小鼠接种PRV后,连续监测108 h,每隔6 d观察1次。观察发现,经200 μg/kg 1,25(OH)2D3预处理的小鼠出现流产的时间延缓至60~72 h,300 μg/kg 1,25(OH)2D3预处理的小鼠出现流产的时间延缓至66~72 h,400 μg/kg 1,25(OH)2D3 预处理的小鼠出现流产的时间延缓至60~72 h。此结果与生理盐水预处理的PRV感染小鼠出现流产的时间(48~60 h)相比较,显著延迟小鼠的流产时间(图4A)。同时,高、中、低剂量1,25(OH)2D3处理的小鼠流产率分别为50%,50%,62.5%,而生理盐水预处理组小鼠的流产率则达到87.5%(图4B)。结果表明,用1,25(OH)2D3预处理怀孕小鼠,可延缓PRV引起的小鼠流产时间,降低小鼠的流产率,且300 μg/kg 1,25(OH)2D3作用效果最显著。
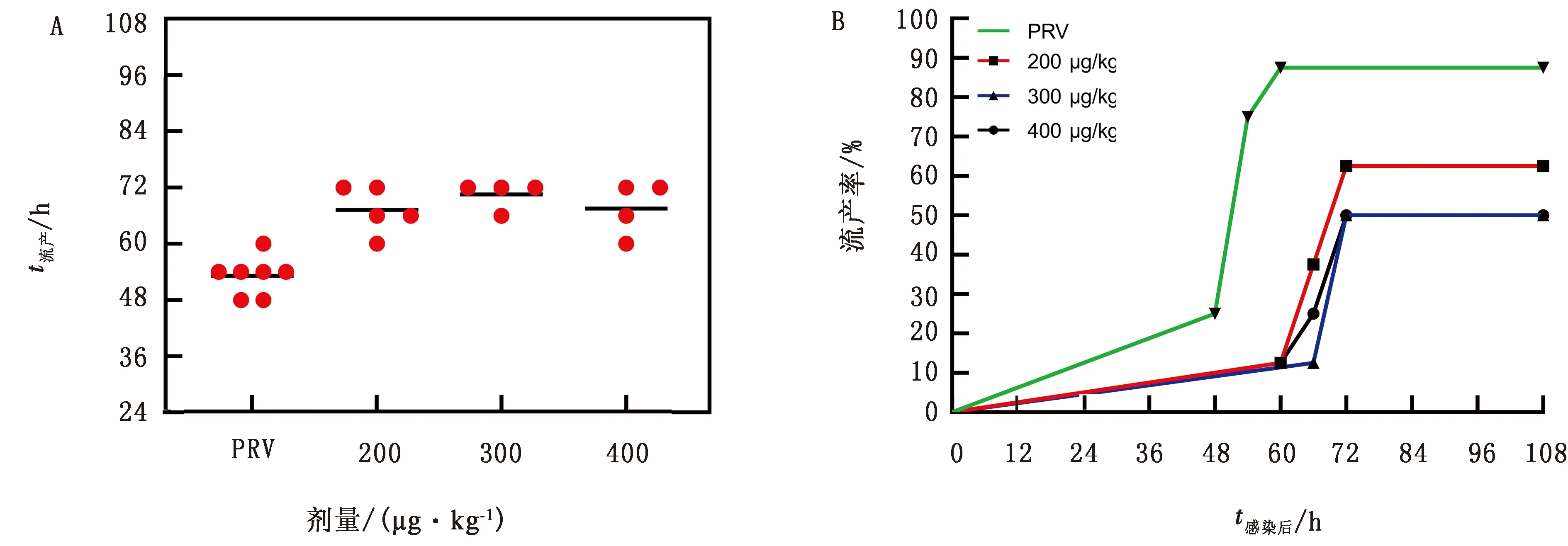
图4 1,25(OH)2D3对PRV感染小鼠流产的影响 A.小鼠流产的时间分布; B.小鼠的流产率
2.4 1,25(OH)2D3对PRV引起的流产小鼠组织病理学影响妊娠7 d的小鼠,用300 μg/kg 1,25(OH)2D3预处理6 d后感染0.35 mL 1 000 TCID50PRV。当PRV试验组小鼠出现流产症状后,处死所有小鼠,取卵巢和子宫制作切片,进行组织病理学观察。结果显示:对照组(NC)卵巢黄体明显,有较多发育成熟的卵母细胞,子宫内膜皱褶较多且呈明显的波浪形,子宫内膜腺体多;1,25(OH)2D3组小鼠的卵巢和子宫的组织学变化与对照组相似;PRV组小鼠可见卵母细胞形状不规则,卵泡内有大量的红细胞,卵泡之间界限模糊,子宫内膜皱褶减少,较平坦,子宫腔变窄,腺体减少甚至消失,红细胞增多;1,25(OH)2D3+PRV试验组与PRV组相比,小鼠卵泡界限较明显,卵泡腔内颗粒细胞增多,红细胞数量减少,子宫腔内红细胞数量减少或消失,子宫内膜皱褶增多,皱褶间的空腔增多(图5)。结果表明,1,25(OH)2D3可有效地减轻PRV感染小鼠的病理变化。
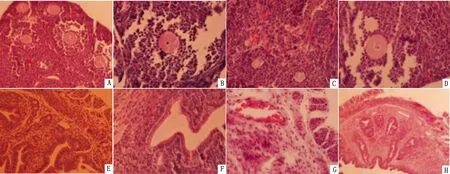
图5 1,25(OH)2D3对PRV引起的流产小鼠卵巢(A~D)和子宫(E~H)的组织病理学观察结果(HE染色×40) A,E.对照组(NC);B,F.1,25(OH)2D3试验组;C,G.PRV试验组;D,H.1,25(OH)2D3+PRV试验组
2.5 1,25(OH)2D3对PRV增殖的影响按照方法1.7处理后小鼠的子宫和卵巢,提取核酸后,通过荧光定量PCR检测PRV的量,结果显示,与PRV组相比,经300 μg/kg 1,25(OH)2D3预处理的小鼠生殖系统中PRV的量明显降低(图6)。

图6 1,25(OH)2D3对 PRV增殖的影响
3 讨论
PRV自1947年在我国首次报道以来,已在全国广泛存在和流行[4],已成为影响养猪业健康发展的重要病原。PRV引起的怀孕母猪流产是造成猪场经济损失的重要因素,因此有效抑制病毒在怀孕母猪体内增殖,降低流产率,是有效防控PR的措施之一。
1,25(OH)2D3为维生素D的活性成分,可参与多种细胞的调控[12],具有抗病毒、抗肿瘤细胞的增殖和抗炎作用[12-14]。另外,1,25(OH)2D3还可促进胎盘滋养层细胞和蜕膜细胞合成VDR,维持雌性正常妊娠[10-11,15]。因此,研究1,25(OH)2D3对PRV感染引起的怀孕母猪流产的影响,将有助于PR的防控。由于PRV可引起小鼠流产、奇痒、全身的炎症反应和死亡[16-17],因此,本试验开展了1,25(OH)2D3对PRV引起小鼠流产的抑制效果研究。
PRV感染试验显示,相较于其他剂量的PRV感染组,妊娠7 d的小鼠在接种0.35 mL 1 000 TCID50PRV后出现了明显的流产症状,为诱导小鼠流产的最佳病毒量。
1,25(OH)2D3在体内的吸收和代谢与VDR是否表达及表达量的高低有关[10]。为了确定1,25(OH)2D3在怀孕小鼠体内有效吸收的使用量,本研究分别使用不同量的1,25(OH)2D3处理妊娠7 d 左右小鼠,并对小鼠生殖系统内VDR mRNA表达量进行检测。结果显示,经不同浓度1,25(OH)2D3处理后,妊娠小鼠的VDR mRNA表达量均高于生理盐水处理的对照组,且300 μg/kg 1,25(OH)2D3预处理的小鼠在6 d 时VDR mRNA表达量最高,为1,25(OH)2D3对PRV引起的小鼠流产影响的研究中1,25(OH)2D3使用量的选择提供了依据。
为了确定1,25(OH)2D3对PRV引起的小鼠流产有何影响,以及产生的影响与1,25(OH)2D3剂量之间的关系,妊娠7 d左右的小鼠分别使用不同量的1,25(OH)2D3预处理,并在预处理后的6 d 接种0.35 mL 1 000 TCID50PRV,结果发现,1,25(OH)2D3可使小鼠出现流产的时间延迟,流产率降低,死亡率降低,且300 μg/kg 1,25(OH)2D3预处理组的作用最为明显。说明1,25(OH)2D3能降低PRV 引起的小鼠流产率和死亡率,且该作用的大小与小鼠体内的VDR表达量有关。
1,25(OH)2D3能抑制病毒的复制,在抗病毒研究中起着重要作用[18]。为了确定1,25(OH)2D3降低小鼠的流产率是否与抑制病毒的增殖及降低PRV对感染小鼠生殖系统的损伤有关,本试验在PRV感染组小鼠出现流产后,对所有试验组小鼠子宫和卵巢进行了组织病理学检查和PRV量的检测,结果显示,经1,25(OH)2D3预处理的小鼠子宫病理变化程度及PRV量明显低于未处理组。有研究表明,1,25(OH)2D3可增加大鼠子宫质量,并促进子宫内膜至蜕膜分化[19-20],维持正常妊娠的过程。本试验中,1,25(OH)2D3预处理组小鼠相较于未处理组,卵泡界限较明显,卵泡腔内颗粒细胞增多,红细胞量减少;子宫腔内红细胞数量减少或消失,子宫内膜皱褶增多,皱褶间的空腔增多。提示1,25(OH)2D3参与小鼠正常妊娠的调控。而1,25(OH)2D3预处理组PRV的量比未处理组低,与KUMAR等[12]的体内高水平的1,25(OH)2D3可抑制病毒的复制研究结果相一致。HUANG等[18]研究表明,1,25(OH)2D3可通过自噬或炎性反应抑制病毒的复制,本试验中1,25(OH)2D3对PRV增殖的抑制,是否也是通过诱导自噬或炎性反应的方式,有待进一步研究。
