猪伪狂犬病病毒变异株TK/gE/gI三基因缺失突变株在小鼠体内的免疫原性
2020-11-06郑慧华田润博崔建涛陈红英
郑慧华,刘 芳,张 宇,赵 宇,田润博,崔建涛,陈红英,2*
( 1.河南农业大学 牧医工程学院,河南 郑州 450002;2.郑州市猪重大疫病防控重点实验室,河南 郑州 450002)
伪狂犬病(pseudorabies,PR)是由伪狂犬病病毒(pseudorabies virus,PRV)引起多种家畜及野生动物的一种急性传染病[1]。PR可引起妊娠母猪流产、死胎,公猪不育,新生仔猪大量死亡,育肥猪呼吸困难、生长停滞等,给全球养殖业造成极大的危害[2]。目前,防控PR的关键技术是采用PR基因缺失疫苗和相应的血清学鉴别诊断相结合的方法[3-4]。
自2011年后,我国多个省份在已免疫PR疫苗的猪群中出现了新一轮的PR[5-6]。有报道陆续从发生PR新疫情、免疫过PR疫苗猪场的死亡仔猪和流产胎儿中分离到了PRV流行株,证实PRV新流行株的抗原性已发生变异,且对仔猪的致病性有所增强,现有的经典PRV Bartha-K61弱毒疫苗已不能完全保护目前PRV流行株引起的感染[7-9]。由PRV流行变异株引发的PR使我国养猪业面临巨大的风险,因此针对PRV流行变异株的有效疫苗研发已迫在眉睫[10-11]。
很多未缺失TK基因的PR弱毒疫苗,使用中存在毒力返强的可能性,还可能引起PRV潜伏感染的危险[12]。因此,本试验进一步对PRV变异株gE/gI双基因缺失株rPRV NY-gE-/gI-进行了TK毒力基因的敲除,同时初步探究了PRV三基因缺失毒株在小鼠体内的安全性和免疫效力,以评估其作为疫苗候选株的潜力。
1 材料与方法
1.1 质粒、毒株、疫苗及细胞PRV转移质粒pG由郑州市猪重大疫病防控重点实验室构建,其中(Pst Ⅰ-Pst Ⅰ)部分含有完整的绿色荧光蛋白基因(EGFP)表达盒,包括CMV、EGFP、MCS、SV40 PolyA尾基因片段,大小为1 672 bp;载体pMD18-T和pUC19购自宝生物工程(大连)有限公司。PRV NY株由郑州市猪重大疫病防控重点实验室分离、鉴定并保存;rPRV NY-gE-/gI-株由郑州市猪重大疫病防控重点实验室以PRV NY株为亲本株,进行gE/gI双基因缺失株的构建并保存[13];PR活疫苗(Bartha-K61株)购自哈尔滨维科生物技术开发公司;猪睾丸(ST)细胞购自中国兽药监察所。
1.2 实验动物40只6周龄雌性昆明小鼠购自河南省实验动物中心。
1.3 主要试剂2×Taq Master Mix酶和DNA凝胶回收试剂盒购自康为世纪生物技术有限公司;EcoRⅠ、PstⅠ、HindⅢ等限制性内切酶、T4DNA连接酶、XfectTMTransfection Reagent购自宝生物工程(大连)有限公司;UNIQ-10柱式病毒基因组抽提试剂盒、质粒小量提取试剂盒购自生工生物工程(上海)股份有限公司;E.Z.N.A.TMEndo-Free Plasmid Mini KitⅠD6948-01B购自OMEGA公司;DMEM购自武汉博士德生物公司;2×DMEM、低熔点琼脂糖购自索莱宝科技有限公司;羊抗小鼠酶标二抗(HRP标记)购自博奥森生物公司;SPRD、FITC、PE 标记的抗CD3+、CD4+、CD8+单克隆抗体购自 Southern Biotech公司。
1.4 转移质粒pUC-TKLRE的构建参考PRV TJ株UL区基因序列(GenBank登录号:KJ789182),设计2对特异性引物,分别用于左右同源臂的扩增。L同源臂包括部分UL24基因和部分TK基因,上游引物(TKL/F):5′-AAGCTTHind ⅢGCCTTATCATCCCCGCT-3′;下游引物(TKL/R):5′-CTGCAGPstⅠCTGATGTCCCCGACGAT-3′。R同源包括部分TK基因和部分UL22基因,上游引物(TKR/F):5′-CTGCAGPstⅠTCCAGGACACCCT-CTTC-3′;下游引物(TKR/R):5′-GAATTCEcoRⅠGCGGAGATGATGACCTC-3′。引物由生工生物工程(上海)股份有限公司合成。
通过相应的酶切位点,将左右同源臂与pG载体中含有完整绿色荧光蛋白基因(EGFP)表达盒的(PstⅠ-PstⅠ)片段进行连接,构建PRV转移质粒pUC-TKLRE,用于后续转染。
1.5 共转染当ST细胞融合度达到70%左右时,将rPRV NY-gE-/gI-毒株直接浸染细胞,吸附2 h后,参照XfectTMTransfection Reagent试剂说明书将PRV转移质粒pUC-TKLRE(去内毒素质粒试剂盒提取)转染到ST细胞中。转染后约4 h时,移除转染液,加入2 mL含有10%胎牛血清的DMEM培养液,37℃、5% CO2中继续培养48 h,反复冻融3次收取病毒液,3 000 r/min离心5 min,取上清液,-80℃ 保存备用。
1.6 PRV三基因缺失株的空斑纯化与鉴定当ST细胞融合度达到90%时,将10-2~10-7稀释度的上述病毒液分别接种到6孔板中,并用低熔点营养琼脂铺板,进行PRV三基因缺失株的蚀斑筛选。挑选在荧光显微镜蓝光下观察到最大绿色荧光蚀斑,反复冻融3次,进行下一轮病毒蚀斑的筛选,直至在蓝光条件下观察到的所有蚀斑均可呈现绿色荧光。利用特异性引物TKQS/F和TKQS/R(TKQS/F:5′-TCGTCGGGGACATCAGC-3′;TKQS/R:5′-GAC-GGGCACGGCAAACT-3′)对PRV三基因缺失株进行PCR鉴定,并将回收纯化的PCR产物进行序列测定,验证TK基因上缺失的序列。再用gB全基因特异引物gB/F和gB/R(gB/F:5′-TTGCA-GTCTTCAGGTCGGTCTT-3′;gB/R:5′-TATTA-TCTGCGGGGAGGGGGCT-3′),对PRV三基因缺失株进行gB基因的扩增。
1.7 小鼠免疫将40只6周龄SPF雌性小鼠随机分为A、B、C、D共4组,每组10只,试验具体分组和接种情况见表1,接种途径为背部皮下分点注射。一免前随机选取20只小鼠进行尾静脉采血,然后按分组分别进行免疫;首免2周后对小鼠进行二免。于一免后 1~6周,每周对小鼠进行尾静脉采血,分离血清,-20℃ 保存备用。免疫后每天观察并记录小鼠临床反应情况。
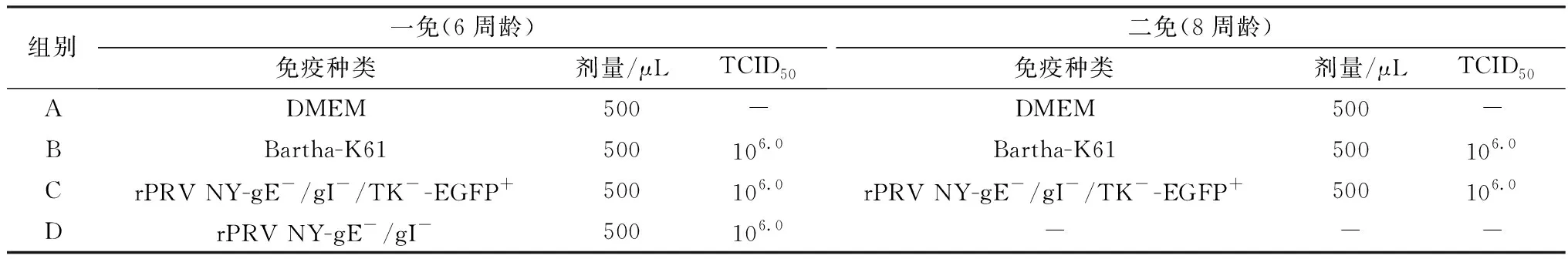
表1 试验小鼠分组及免疫情况
1.8 间接免疫吸附测定(ELISA)采用间接ELISA检测小鼠血清中PRV抗体水平,参照文献[14]的方法进行。ELISA阴阳性临界值为0.382,即样品D450>0.382判为阳性,D450<0.382判为阴性。
1.9 血清中和试验检测PRV抗体水平采用固定病毒-稀释血清法(β法)[14]对每周采集的小鼠血清测定中和抗体效价。
1.10 小鼠外周血T淋巴细胞亚群的测定首免后6周(即二免后4周)每组随机抽取5只小鼠,采集小鼠抗凝血300 μL,加入荧光标记的抗CD3、CD4、CD8的单克隆抗体各1 μL,轻缓摇匀后,室温孵育30 min;孵育结束后,每管待检样品中再加入2 mL 溶血素,轻缓摇匀,室温作用20 min;2 000 r/min 离心 5 min后,再加入2 mL 2% FBS-PBS,2 000 r/min 离心 5 min;最后加入400 μL PBS缓冲液,用流式细胞仪检测CD3+、CD4+、CD8+T细胞数量。
1.11 攻毒保护试验首免后6周(二免后4周)每组随机抽取5只小鼠,用PRV NY株以背部皮下注射对小鼠进行攻毒,攻毒剂量为每只小鼠500 μL (病毒滴度为106TCID50/0.1 mL),之后连续饲养4周进行观察,记录并分析小鼠的免疫保护情况,同时绘制生存曲线。
1.12 脑部病理切片取各组发病死亡的小鼠和C组未死亡的小鼠脑部,石蜡包埋后切片,观察病理变化。
2 结果
2.1 PRV三基因缺失株的构建与纯化通过对左右同源臂进行扩增、测序,将其连接至含有EGFP的pG载体中,成功构建重组转移载体pUC-TKLRE,其含有可以与亲本株rPRV NY-gE-/gI-发生同源重组的同源臂,CMV启动子控制下的EGFP报告基因。测序显示,转移质粒pUC-TKLRE中含有左同源臂(部分UL24基因和部分TK基因)、右同源臂(部分TK基因和部分UL22基因)与EGFP表达盒及阅读框完全正确。
将转移质粒pUC-TKLRE转染至已感染rPRV NY-gE-/gI-毒株的ST细胞中,pUC-TKLRE与rPRV NY-gE-/gI-在细胞内发生同源重组,拯救出PRV三基因缺失株rPRV NY-gE-/gI-/TK--EGFP+(图1)。PRV三基因缺失株带有EGFP基因,筛选含有绿色荧光病毒蚀斑,连续进行4轮纯化,直至所有病毒蚀斑均表达绿色荧光,表明PRV三基因缺失株已纯化完全。
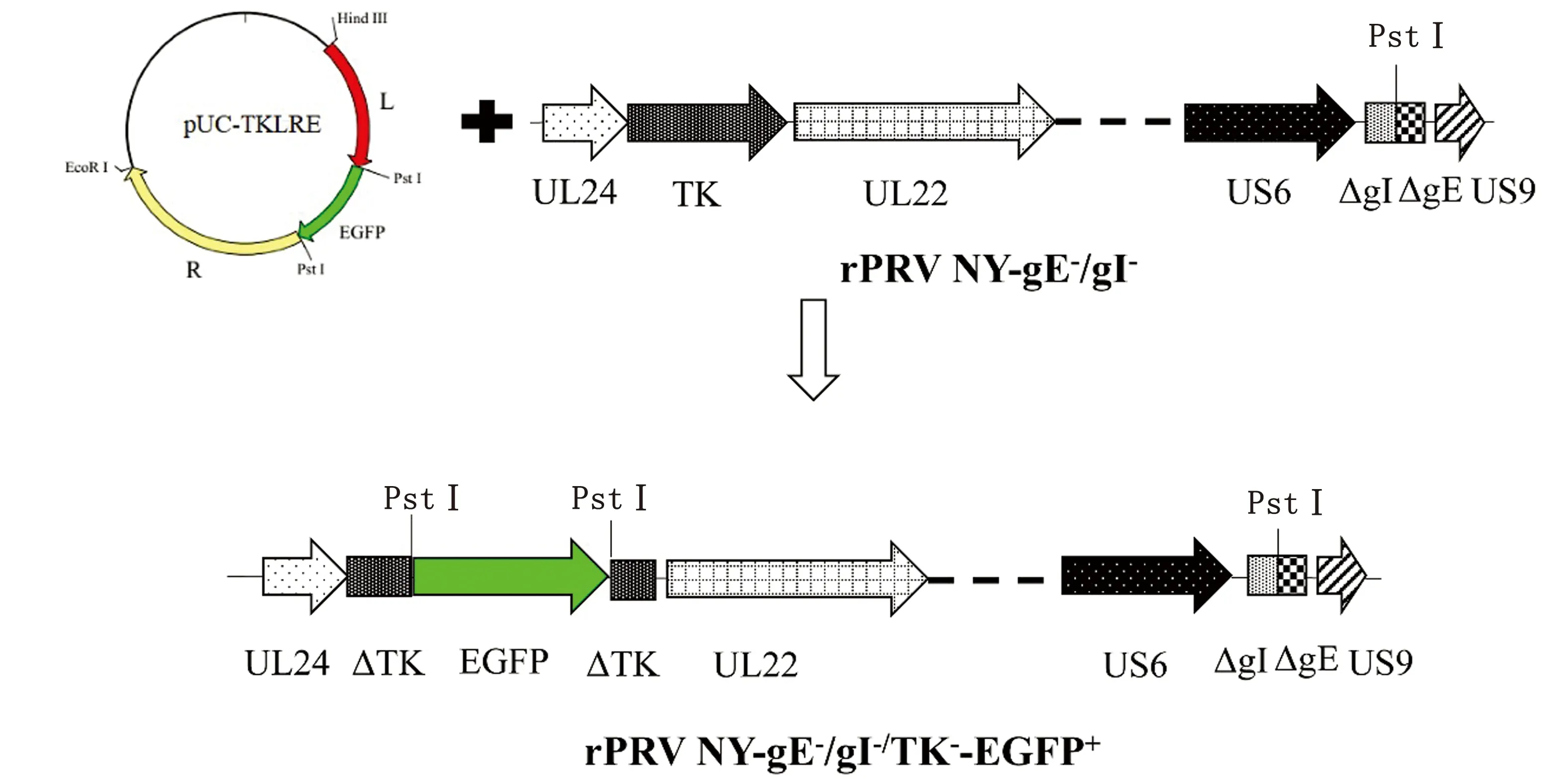
图1 PRV三基因缺失株rPRV NY-gE-/gI-/TK--EGFP+的构建示意图
2.2 PRV三基因缺失株的PCR鉴定利用特异性引物TKQS/F和TKQS/R,对PRV三基因缺失株左右同源臂间的缺失部分进行PCR鉴定,结果显示,PRV三基因缺失株DNA扩增出1条约2 100 bp的片段(包括414,1 672 bp EGFP基因表达盒),而未缺失TK基因的rPRV NY-gE-/gI-株DNA扩增出1条约725 bp的片段(包括414,311 bp),与预期结果相符。测序结果显示,获得的PRV三基因缺失株在TK基因上缺失了311 bp,并在缺失部位插入了含EGFP基因的Pst Ⅰ-Pst Ⅰ片段(1 672 bp)。
利用gB全基因特异引物,对PRV三基因缺失株进行鉴定,结果显示,扩增出1条约3 000 bp的片段,与预期结果相符。
2.3 小鼠免疫后的临床表现对小鼠进行免疫后,DMEM(A组)、Bartha-K61(B组)和rPRV NY-gE-/gI-/TK--EGFP+(C组)免疫组小鼠均未出现不良症状,全部存活;而rPRV NY-gE-/gI-(D组)免疫组小鼠在免疫72 h后陆续出现精神低沉、发痒抓挠等典型的PR发病症状,96 h内D组小鼠全部死亡。
2.4 间接ELISA检测PRV抗体结果应用间接ELISA检测方法对每周采集的各组小鼠血清进行PRV抗体检测,所测得的数据使用GraphPad Prism 6.0绘制成折线图并计算P值,结果如图2所示,第1次免疫7 d后Bartha-K61(B组)和rPRV NY-gE-/gI-/TK--EGFP+(C组)已有效地刺激小鼠产生了抗PRV的抗体(P<0.001);之后Bartha-K61免疫组(B组)和rPRV NY-gE-/gI-/TK--EGFP+免疫组(C组)抗体水平均保持稳定升高,在整个试验过程rPRV NY-gE-/gI-/TK--EGFP+免疫组(C组)抗体水平略高于Bartha-K61免疫组(B组),但两组抗体水平差异并不显著(P>0.05)。DMEM免疫组并未刺激小鼠产生PRV抗体。

图2 小鼠PRV抗体检测 ***.P<0.001
2.5 血清中和试验检测PRV抗体结果首免后6周(即二免后4周),从各组小鼠中随机抽取5只小鼠,断尾采血,取血清,56℃灭活,2倍稀释,最低浓度稀释至2-9,与PRV NY株第8代(TCID50为10-9/mL)进行中和试验,逐日观察细胞病变情况,结果表明,rPRV NY-gE-/gI-/TK--EGFP+(C组)免疫组的血清1∶32稀释可保护50%的细胞免于出现细胞病变(CPE),而Bartha-K61疫苗免疫组血清的中和效价相对较低(1∶22),DMEM免疫组不能保护细胞。Bartha-K61(B组)和rPRV NY-gE-/gI-/TK--EGFP+(C组)在刺激小鼠机体产生PRV中和抗体水平方面均有明显作用,且DMEM免疫组并未刺激小鼠产生PRV中和抗体。
2.6 小鼠外周血T淋巴细胞亚群的测定通过流式细胞技术检测小鼠外周血T淋巴细胞亚群的分布情况,所测得的数据使用GraphPad Prism 6.0绘制成柱状图并计算P值。由图3可见,与DMEM免疫的对照组(A组)相比,Bartha-K61(B组)和rPRV NY-gE-/gI-/TK--EGFP+(C组)免疫的试验组小鼠的外周血T淋巴细胞亚类CD3+、CD4+和CD8+的数量较多,且rPRV NY-gE-/gI-/TK--EGFP+(C组)免疫组的T淋巴细胞亚类CD3+、CD4+和CD8+的数量最多。
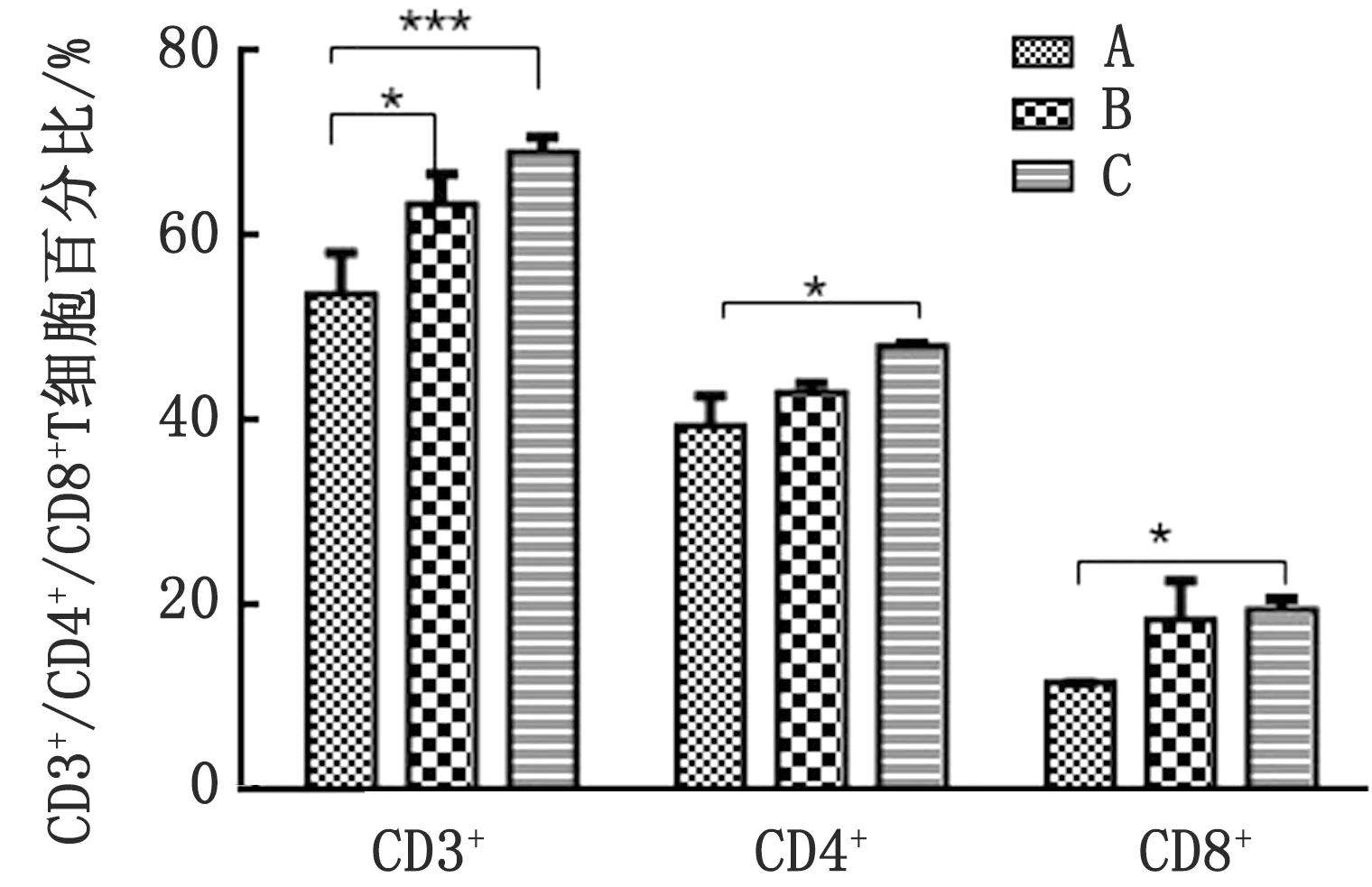
图3 小鼠外周血中CD3+、CD4+、CD8+T淋巴细胞数量的测定 *.P<0.05;**.P<0.01;***.P<0.001
2.7 攻毒保护试验DMEM免疫组(A组)在攻PRV NY株48 h后有2只小鼠开始出现发痒抓挠等典型的PR发病症状,随后该组另外3只小鼠陆续发病,攻毒72 h内DMEM免疫组(A组)小鼠全部死亡,小鼠从发病到死亡经历的时间短、发病迅速。Bartha-K61免疫组(B组)在攻PRV NY株48 h 后有1只小鼠开始出现发痒抓挠等典型的PR发病症状,攻毒60,72 h后又各有1只小鼠发病,3只发病小鼠均在2~3 d后死亡;其他2只小鼠在4周观察期内均健康成长,保护率为40%。rPRV NY-gE-/gI-/TK--EGFP+免疫组(C组)在攻PRV NY株48 h后有1只小鼠开始出现发痒抓挠等典型的PR症状,攻毒72 h后又有1只小鼠发病,2只发病小鼠在2~3 d后死亡;该组存活3只小鼠,保护率为60%。根据每组小鼠的死亡情况,绘制生存曲线(图4)。
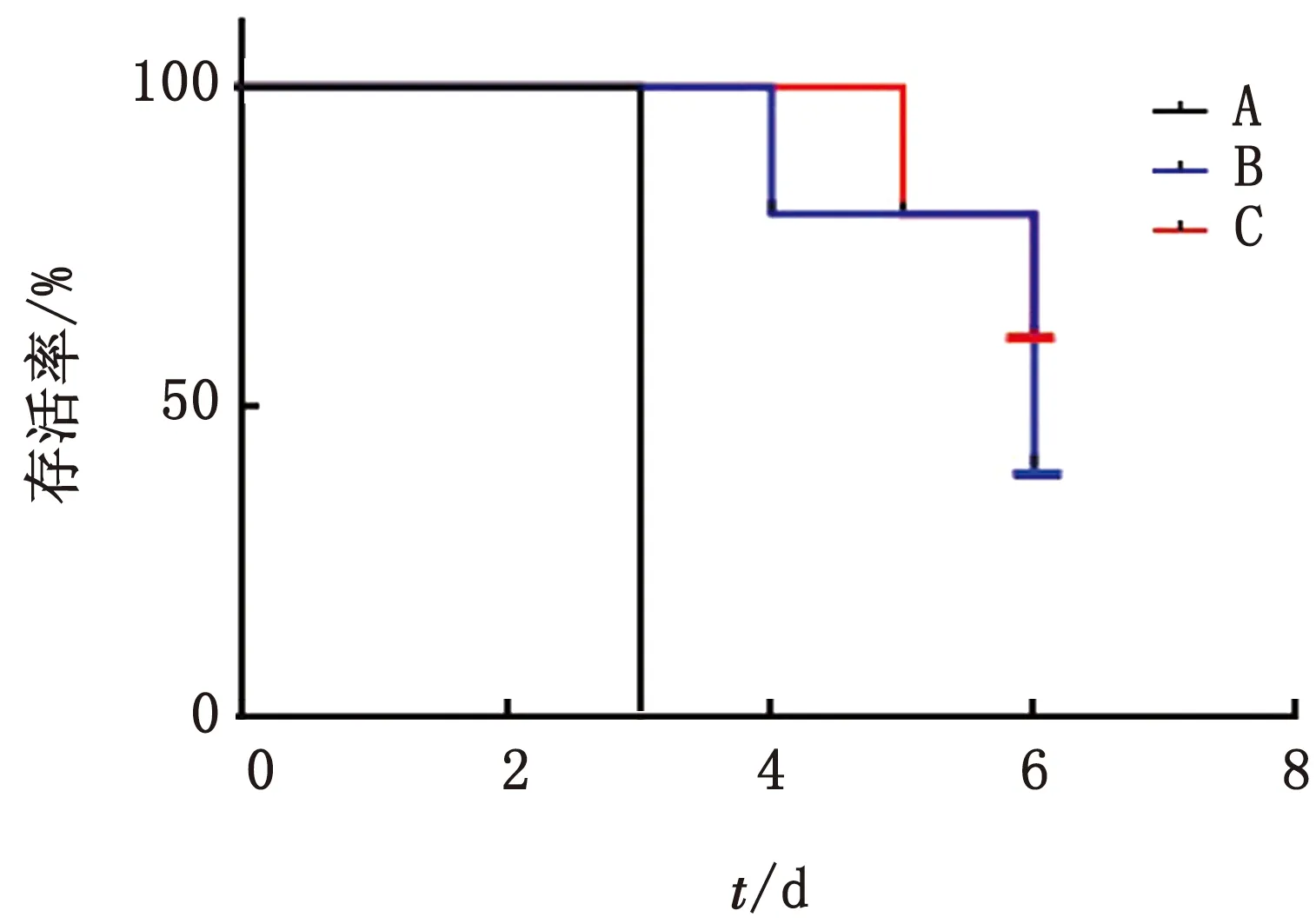
图4 小鼠的生存曲线
DMEM免疫组(A组)发病小鼠死亡迅速,皮肤仅有少量破损处(图5A);而Bartha-K61免疫组(B组)和rPRV NY-gE-/gI-/TK--EGFP+免疫组(C组)中的发病小鼠因经历2~3 d的病程后才出现死亡,所以小鼠发痒抓挠皮肤出血十分严重,产生了大片损伤(图5B)。

图5 死亡小鼠的伤口状态 A.DMEM免疫组;B.Bartha-K61免疫组
2.8 脑部病理切片病理切片结果显示,DMEM免疫组(A组)死亡小鼠的脑组织中血管周围可见小胶质细胞聚集(图6),炎症反应明显,同时脑神经细胞内可见大量核内嗜酸性包涵体(图7A);Bartha-K61免疫组(B组)和rPRV NY-gE-/gI-/TK--EGFP+免疫组(C组)死亡小鼠的脑神经细胞内可见少量核内嗜酸性包涵体(图7B,C),而C组存活小鼠的脑神经细胞内未见核内嗜酸性包涵体(图7D)。
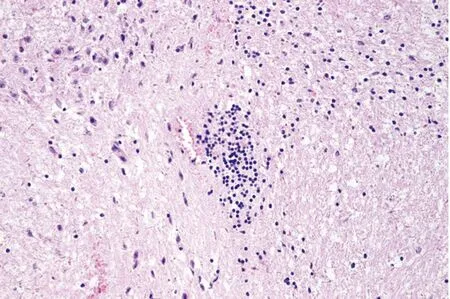
图6 小胶质细胞聚集
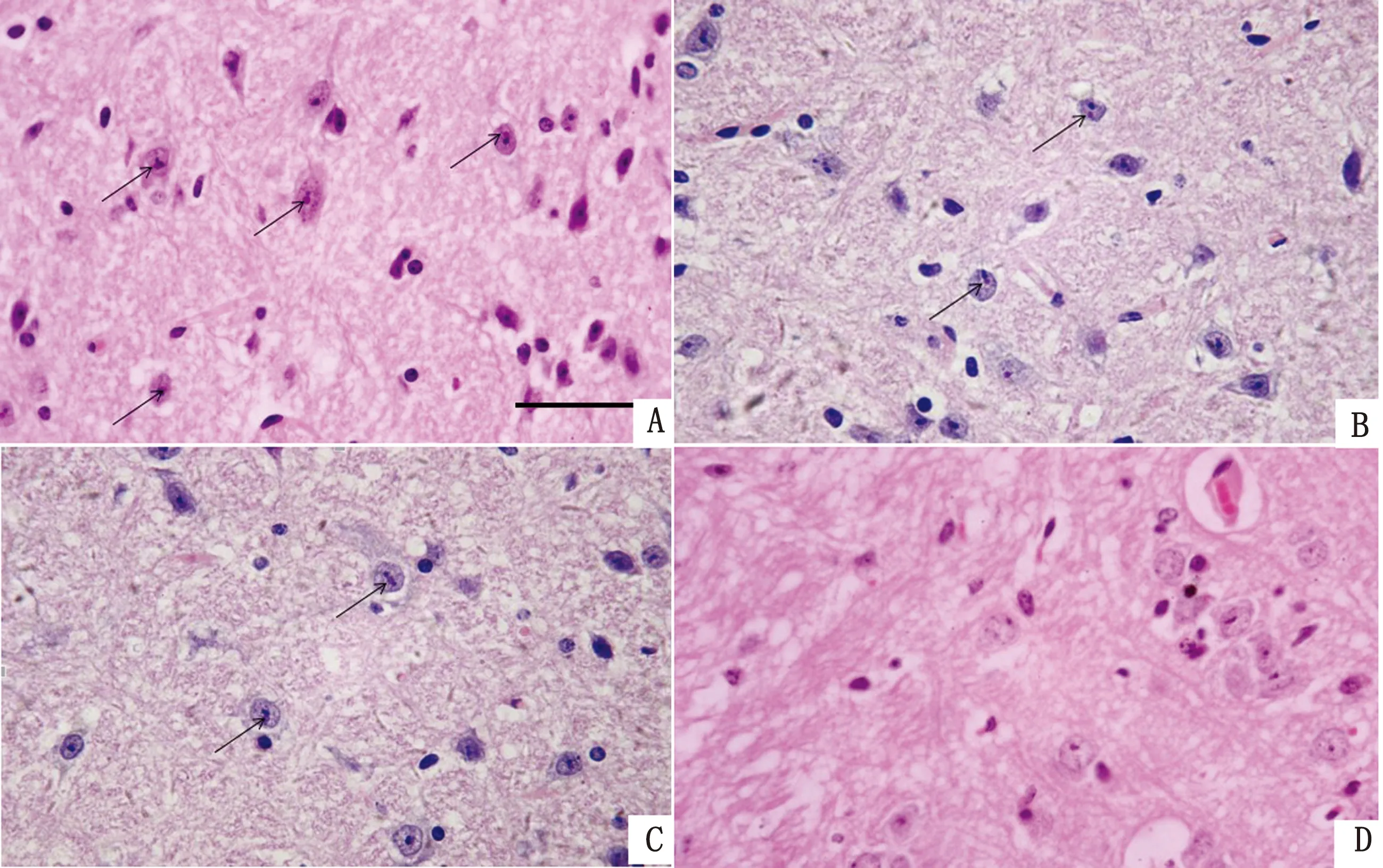
图7 小鼠的脑部病理切片 A.DMEM免疫组(A组)死亡小鼠脑神经细胞内可见大量核内嗜酸性包涵体;B,C.Bartha-K61(B组)和rPRV NY-gE-/gI-/TK--EGFP+(C组)免疫组死亡小鼠脑神经细胞内可见小量核内嗜酸性包涵体;D.C组存活小鼠脑神经细胞内未见核内嗜酸性包涵体
3 讨论
PRV具有十分庞大的基因组,其中包括丰富的非必需基因和非编码区,通过在这些区域插入外源基因来构建重组病毒,并使外源基因在机体内表达进而刺激产生针对外源蛋白的免疫应答[15];因此构建PRV基因缺失疫苗也可为实现以 PRV 疫苗株为载体的“一针多防”型重组疫苗的构建奠定基础。
在本试验的共转染过程中,并未采用转移载体与病毒基因组共转染细胞的方式,而是采用先将rPRV NY-gE-/gI-双基因缺失毒株以自然感染的方式进入细胞,再将转移载体转染细胞与毒株发生同源重组。因PRV基因组庞大,传统的提取基因组共转染方法难以保证PRV基因组的完整性,而采用病毒直接侵染细胞就可以避免因病毒基因组纯度而影响同源重组效率的问题,且更为简便[16]。另外,转染试剂的毒性会造成细胞的损伤和死亡,而良好的细胞状态和足够数量的细胞也直接影响到病毒重组效率的高低,因此本试验先将PRV感染细胞再使转移载体转染这一顺序的调整也保证了PRV侵染细胞的数量。
本试验进一步在小鼠模型上对获得的rPRV NY-gE-/gI-、rPRV NY-gE-/gI-/TK--EGFP+缺失病毒进行了安全性和免疫效力的初步评价。rPRV NY-gE-/gI-/TK--EGFP+免疫组小鼠在试验过程中没有出现任何不良反应,病毒致弱情况理想;但rPRV NY-gE-/gI-免疫组小鼠可能由于免疫接种量过大,导致组内小鼠全部死亡,说明rPRV NY-gE-/gI-双基因缺失毒还存在一定的毒力,证实了未缺失TK基因的PRV对于非靶动物小鼠是不安全的,与报道结果相符[17-18]。
间接ELISA结果表明,rPRV NY-gE-/gI-/TK--EGFP+免疫组在免疫过程中产生了较高滴度的PRV抗体,中和抗体水平也证实了该缺失病毒保持了良好的免疫原性。此外,小鼠外周血T淋巴细胞亚群的测定结果也表明该缺失病毒可有效地刺激小鼠机体产生细胞免疫。在攻毒保护试验过程中,可能是由于注射的PRV NY株攻毒量过大等原因,导致rPRV NY-gE-/gI-/TK--EGFP+免疫组的保护率为60%,并未达到理想的完全保护,但仍可看出rPRV NY-gE-/gI-/TK--EGFP+株的保护力优于Bartha-K61株。此外rPRV NY-gE-/gI-/TK--EGFP+免疫组和Bartha-K61免疫组相比,可能由于免疫量较大等原因,导致rPRV NY-gE-/gI-/TK--EGFP+免疫组的免疫效果仅略优于Bartha-K61免疫组,并未出现显著性差异,而目前临床上也采用加大Bartha-K61疫苗免疫量以提高免疫效果的手段来抵御PRV流行变异株;同时本试验获得的rPRV NY-gE-/gI-/TK--EGFP+基因缺失株则仅是通过ST细胞培养后获得的病毒液,与成熟的商品疫苗Bartha-K61株相比,需在后续研究中进行免疫接种量、免疫途径、免疫佐剂、有效抗原浓缩等问题的进一步探究。
总之,本试验所获得的rPRV NY-gE-/gI-/TK--EGFP+三基因缺失病毒对非靶标动物小鼠是安全的,免疫后能有效并迅速产生PRV特异性抗体,且能有效地激活细胞免疫,为下一步构建不含外源EGFP基因的三基因缺失PRV奠定基础。
